原发性帕金森病患者唾液DJ-1 蛋白与非运动症状、α-突触核蛋白的相关性研究
杨钊 康文岩 刘军
帕金森病(PD)是最常见的神经变性病之一,临床表现可分为运动症状与非运动症状(NMS)[1]。 因其起病隐匿、临床表现复杂、缺乏特异性诊断标记物等原因,PD 早期诊断与鉴别诊断的研究进展较为缓慢[2]。随着蛋白质组学、基因组学、代谢组学等技术的出现,唾液已成为研究生化标记物的热点标本来源[3-4]。DJ-1是一种由189 个氨基酸组成的蛋白质,其所发挥的抑制α-突触核蛋白(α-syn)形成低聚物的作用是PD 病理学的关键部分。 DJ-1 突变可导致早发家族性常染色体隐性PD。 我们之前的研究结果提示唾液DJ-1是评价PD 患者黑质纹状体多巴胺(DA)功能的潜在标记物[5]。 既往的研究表明NMS 可能在运动症状出现之前即已存在[6],而目前关于PD 患者唾液DJ-1蛋白水平与NMS 及唾液α-syn 的相关性研究尚少,因此我们通过比较原发性PD 患者唾液DJ-1 水平与NMS、唾液α-syn 水平的相关性,旨在探讨其在PD诊断中的潜在价值。
对象与方法
1.对象:2011 年 3 月 ~ 2012 年 12 月于我科门诊确诊的原发性PD 患者81 例(PD 组),其中男49 例,女32 例,平均年龄(63.49 ±9.45)岁,均符合英国脑库PD 诊断标准[7],排除各种原因所致的帕金森综合征、帕金森叠加综合征及经过功能神经外科治疗的PD患者。 招募年龄和性别与PD 组患者相匹配的社区人群65 例作为对照组,其中男41 例,女24 例,平均年龄(61.25 ±10.08)岁,无帕金森综合征、认知障碍或其他神经系统疾病病史,且无任何迹象和症状。 排除标准:中度或重度吸烟(超过10 包/年)、饮酒和使用任何心理治疗药物。 本研究经上海交通大学医学院附属瑞金医院伦理委员会审批通过,所有受试者均签署知情同意书。
2.方法
(1)NMS 评估:采用简易智能精神状态检查量表(MMSE)[8]、17 项汉密尔顿抑郁量表(HAMD-17)[9]、快速眼动睡眠行为障碍筛查问卷(RBDSQ)、16 项气味辨认测试(SS-16)、罗马Ⅲ便秘标准对NMS 进行评定。 RBDSQ 用于筛选可能的临床快速眼动期睡眠障碍(cpRBD),共计 15 分,评分≥6 分为阳性;SS-16 用于评估嗅觉功能,评分≤8 分为存在嗅觉障碍[10-11];HAMD-17 用于评估患者情绪,评分<7 分为正常;罗马Ⅲ便秘标准用于评估慢性便秘[12]。
(2)唾液的采集与处理:唾液样本收集步骤参考文献[5]和[11],患者唾液采集前1 h 内禁食水(上午9 ~11 时),安静房间内静坐10 min(不能有食物和咀嚼物的刺激)后收集3 ml 左右唾液。 收集完成后将盛有唾液的离心管立刻置于冰上,每900 μl 唾液加入蛋白酶抑制剂 cocktail(美国 Sigma 公司)100 μl,使用Vortex 混匀后低温 4 ℃、2 600 g 离心 15 min,弃掉沉淀,再次4 ℃、15 000g 离心15 min,然后将上清液每500 μl 分装至 EP 管内,储存在 -80 ℃冰箱中待用。使用BCA 试剂盒(美国Pierce 公司)检测唾液总蛋白浓度。
(3)唾液中DJ-1 与α-syn 蛋白含量的检测:应用Luminex 技术检测唾液中DJ-1 蛋白含量,检测方法参考文献[5]和[11]。 首先使用Bio-Plex 蛋白微球氨基耦联试剂盒(美国Bio-Rad 公司)将C00H 磁珠与DJ-1兔单克隆抗体(Abcam 公司)连接,然后将捕获抗体加入96 孔Bio-Plex 检测板,重组的人DJ-1 蛋白(Covance公司)作为标准品,设置唾液样本、标准品和空白对照,最后在Liquichip Luminex 200(美国Bio-Rad 公司)上进行相关参数的设置并对96 孔板上的标准品及样品中的DJ-1 蛋白含量进行测定。 唾液DJ-1 蛋白含量指每单位唾液体积所含DJ-1 蛋白总质量;唾液DJ-1蛋白相对含量指每单位唾液蛋白质量中所含DJ-1 蛋白总质量。 唾液α-syn 的检测方法同前[11]。
3.统计学处理:应用SPSS 21.0 软件进行统计分析。 符合正态分布的计量资料以表示,组间比较采用t检验或单因素方差分析(ANOVA);不符合正态分布的计量资料以M(P75,P25)表示,组间比较采用非参数Kruskal-Wallis方差分析。 计数资料以例和百分比表示,组间比较采用χ2检验或Fisher精确检验。 相关性分析采用Spearman秩相关检验。 以P<0.05 为差异有统计学意义。
结 果
1.PD 患者各NMS 量表评分情况:所有PD 患者的SS-16 评分为(8.37 ±2.78)分,伴嗅觉障碍43 例,无嗅觉障碍 38 例;HAMD 评分为(4.72 ±3.84)分,伴抑郁18 例,不伴抑郁 58 例;MMSE 评分为(27.41 ±2.31)分;RBDSQ 评分为(3.52 ± 2.84)分,伴 RBD 18 例,不伴RBD 63 例;此外,35 例 PD 患者伴便秘,46 例患者不伴便秘。
2.PD 组和对照组唾液DJ-1 蛋白水平比较:PD 组患者的唾液 DJ-1 蛋白含量为(4.07 ±6.42)ng/ml,相对含量为(2.91 ±4.12)ng/mg;对照组受试者的唾液DJ-1 蛋白含量为(3. 78 ± 5. 41)ng/ml,相对含量为(3.58 ±5.61)ng/mg。 两组受试者的唾液 DJ-1 蛋白含量和相对含量比较差异均无统计学意义(分别为P=0.79 和P=0.99)。
3.PD 患者唾液DJ-1 蛋白水平与NMS 的相关性分析结果:Spearman秩相关检验结果显示,唾液DJ-1蛋白水平与 SS-16、HAMD-17、MMSE、RBDSQ 评分无明显相关性(P>0.05),见表1。 根据量表评分将PD组分别分为有无嗅觉障碍、RBD、便秘、抑郁亚组,并与对照组进行比较结果显示,PD 各NMS 亚组患者的唾液DJ-1 蛋白水平与对照组比较差异均无统计学意义(P>0.05),见表 2 ~5。
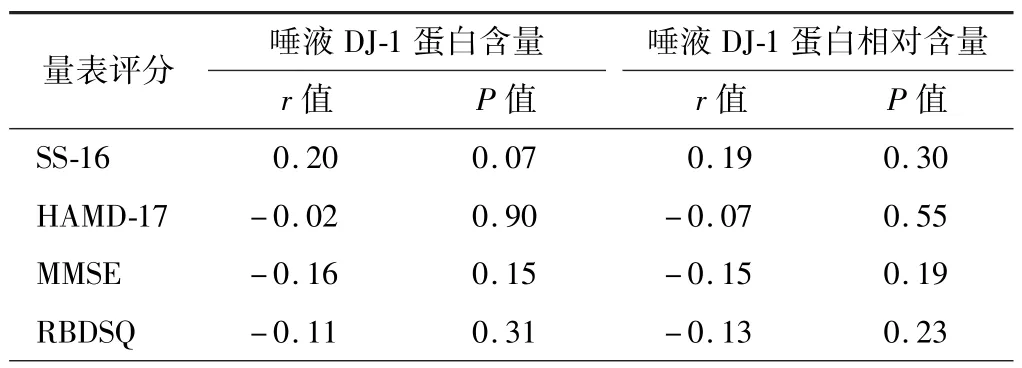
表1 PD 患者唾液DJ-1 蛋白水平与NMS 各量表评分的相关性分析
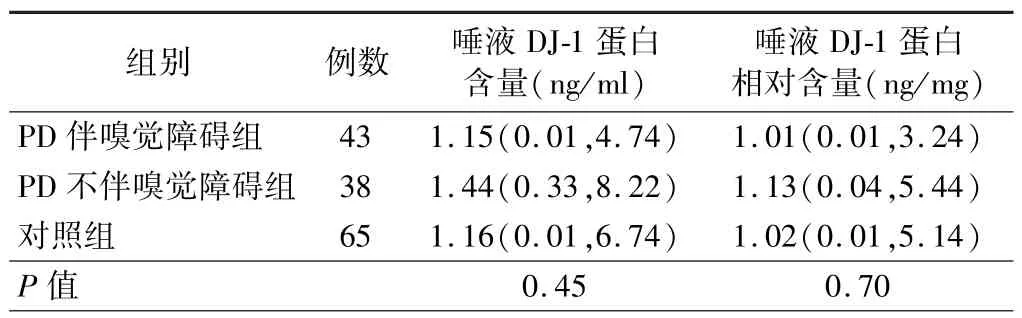
表2 PD 患者伴/不伴嗅觉障碍亚组与对照组唾液DJ-1 蛋白水平的比较[M(P25,P75)]
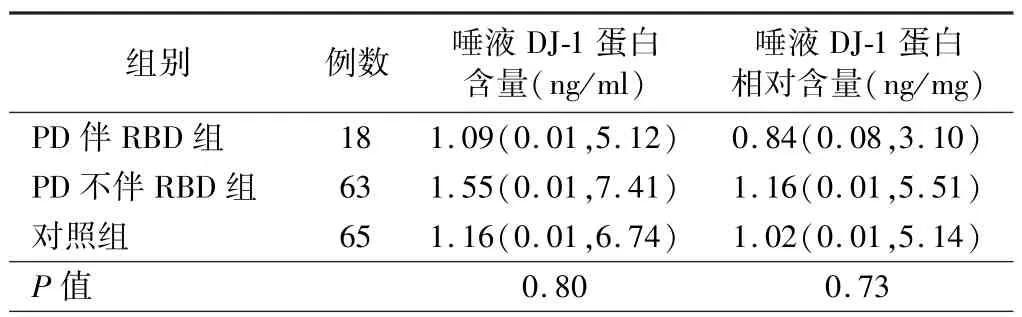
表3 PD 患者伴/不伴RBD 亚组与对照组唾液DJ-1 蛋白水平的比较[M(P25,P75)]
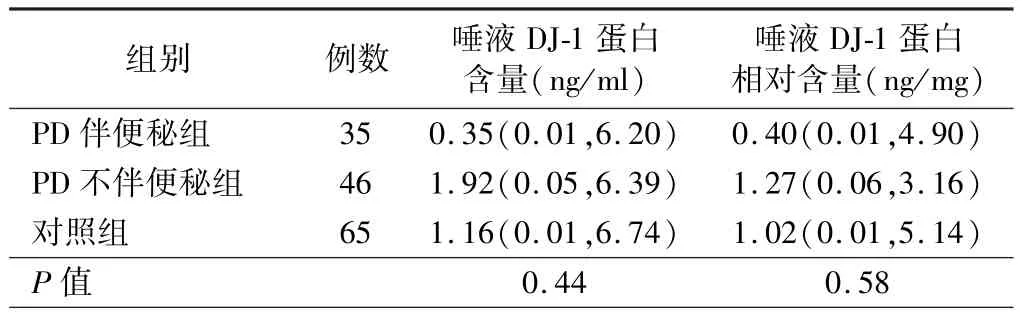
表4 PD 患者伴/不伴便秘亚组与对照组唾液DJ-1 蛋白水平的比较[M(P25,P75)]
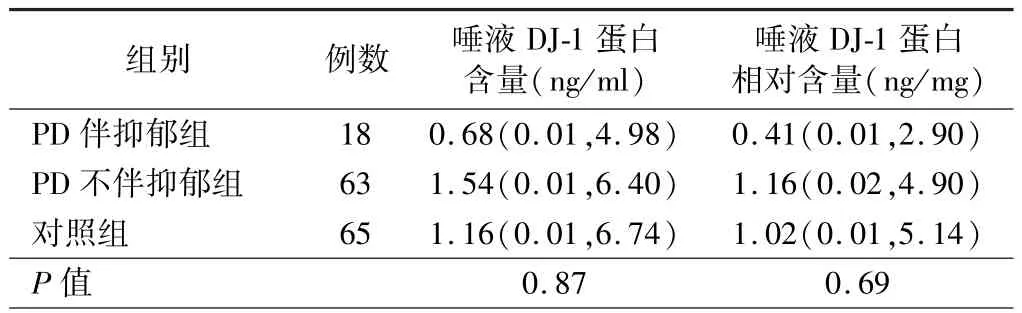
表5 PD 患者伴/不伴抑郁亚组与对照组唾液DJ-1 蛋白水平的比较[M(P25,P75)]
3.唾液DJ-1 蛋白与α-syn 的相关性分析结果:无论在PD 组还是对照组,唾液DJ-1 蛋白水平与α-syn含量均呈轻度负相关(P<0.05),而与α-syn 相对含量无明显相关性(P>0.05),见表6。

表6 唾液DJ-1 与α-syn 水平的相关性分析结果
讨 论
PD 起病隐匿,在患者出现明显的运动症状前数年,其黑质多巴胺神经元已经开始损失[13-14]。 因此,PD 的早期诊断、提高诊断准确性、监测疾病进展和治疗效果等需求尤为迫切,而已有的影像学技术包括正电子发射计算机断层成像(PET)、单光子发射计算机断层成像术(SPECT)等检查及一些早期生物学标记物检测虽然有助于PD 的早期诊断[15],但由于价格昂贵、放射性大等原因难以在临床普及。 因收集简便、成本低廉且无创,唾液可能是发现PD 生物标记物的理想标本。 野生型DJ-1 是氧化应激传感器和抗氧化剂,同时具有分子伴侣、蛋白酶、乙二醛酶及保护线粒体免受氧化应激的转录调节因子的作用[16]。 在PD 中,DJ-1蛋白通过多种机制保护多巴胺能神经元。 既往研究结果显示,DJ-1 是脑脊液、血液中PD 的潜在生物标记物[17]。
PD 患者的唾液腺功能可能受到影响,表现为唾液分泌不足和唾液成分异常[18]。 近期一项横断面研究发现PD 患者唾液中总蛋白浓度和DJ-1 浓度均升高,但调整总蛋白浓度后,唾液中DJ-1 浓度无差异;DJ-1水平与国际运动障碍协会-统一帕金森病评定量表(MDS-UPDRS)测量的疾病严重程度相关;同时还发现PD 患者唾液中淀粉酶、白蛋白等浓度升高,这项研究提示PD 患者自主神经功能障碍导致其唾液成分不同于健康对照人群,唾液可能是探索PD 早期诊断的潜在生物标志物储存库[3,18-19]。 本研究组既往进行的一项大样本量队列研究发现,虽然唾液DJ-1 不受统一PD 评定量表(UPDRS)评分、性别、年龄和药物治疗的影响,但 H&Y 4 期 PD 患者的唾液 DJ-1 水平高于H&Y 1 ~3 期 PD 患者和健康对照组;混合型(MT)PD患者唾液DJ-1 水平也明显低于震颤型(TDT)和强直型(ARDT)患者,并提示唾液DJ-1 可作为评价PD 患者黑质纹状体多巴胺功能的潜在标记物[5]。
NMS 在PD 的前驱阶段占主导地位,部分NMS 可能作为PD 的临床生物标志物。 大多数PD 患者伴有NMS,平均症状数量为 4 ~19 种[20]。 除 DA 能途径、遗传或药物等因素外,常见的NMS 可能涉及其他神经递质的异常,如5-羟色胺、去甲肾上腺素、乙酰胆碱、甘氨酸、谷氨酸和 γ-氨基丁酸。 PINK1 基因敲除(KO)大鼠的基础DA、谷氨酸和乙酰胆碱存在年龄依赖性异常;Parkin-KO 和LRRK2-KO 大鼠的基础DA 代谢产物均存在年龄依赖性异常;Parkin-KO 大鼠的甘氨酸释放量增加;DJ-1-KO 大鼠的谷氨酸释放量减少,乙酰胆碱释放量增加[20-21]。 NMS 的临床评估方法包括国际运动障碍学会和其他国际组织推荐的各种量表[20]。既往研究结果显示,唾液α-syn 含量与NMS 各量表评分无明显关联[11],本研究进一步分析发现唾液DJ-1水平与 MMSE、HAMD、RBDSQ 等 NMS 量表评分同样无明显相关性。 根据不同的NMS,我们将PD 分为是否伴嗅觉障碍、便秘、RBD、抑郁等亚组[6,14],并与对照组比较,仍未发现唾液DJ-1 水平有明显差异。 或许PD 需要进一步的队列研究来确定这些亚型的具体临床特征以及生物标记物。 PD 可能是一种不同的、特定的神经递质缺陷导致一系列复杂的、相关的综合征,故Titova 等提出了一种更为相关的基于神经递质功能障碍的NMS 亚组分类的观点,并得到了影像学和其他生物标志物研究的支持[20,22]。
我们之前的研究显示唾液α-syn 水平可以通过不同的α-syn 单核苷酸多态性(SNPs)来控制,唾液寡聚型α-syn 可能是PD 的潜在诊断指标,但PD 组与对照组总α-syn 水平差异无统计学意义,且与NMS 无明显相关性[11,23]。 目前唾液 DJ-1 与 α-syn 水平的相关性尚缺乏研究,而我们分析发现无论在对照组还是PD组,唾液DJ-1 与总α-syn 水平均呈负相关,提示唾液蛋白水平变化可能反映唾液腺的病理变化,但其临床意义仍需进一步探索研究[24-25]。
由于现有研究数据的缺乏和不同研究结果相互矛盾,目前在神经系统疾病的检测和监测中,唾液生物标记物缺乏可靠性。 如采用非侵入性筛选技术,则需要不断加大研究力度,同时标准化唾液收集、处理及检测流程以减少偏差。 此外,唾液生物标记物在PD 的早期阶段,不能简单地代替其他侵入性检查,但可以作为辅助诊断的手段。 而研究PD 相关的突触功能障碍和神经递质动力学,以及研究这些PD 相关突变基因的正常功能和致病机制及其与NMS 的相关性,对于筛选体液中的生物标记物具有积极的指导意义。

