脑淀粉样血管病诊断标准的演变
付佳玉 苏娅 程忻
脑淀粉样血管病(CAA)是淀粉样物质沉积在大脑皮层和软脑膜小动脉的中外膜,导致血管功能障碍和脑实质损伤的一类神经系统疾病,以β-淀粉样蛋白(Aβ)的沉积最常见,最常累及枕叶。 CAA 是一种常见的老龄相关的脑小血管病,死后尸检病理显示,25%的70 岁以上社区老年人存在轻至极重度的CAA 病理改变[1],在痴呆人群中,该比例升高至50% ~80%[2]。CAA 是老年人原发性脑出血的常见病因,也可导致认知功能减退、短暂性局灶性神经症状发作(TFNE)和脑病表现(CAA 相关炎症,CAA-ri)等。 对于 CAA 脑出血,在排除其他原因后,诊断的难点在于与高血压脑出血进行鉴别,两种脑出血病因对应不同的危险因素和预后,且CAA 脑出血的复发率比高血压脑出血高出6 倍[3],因此二者鉴别尤为重要。 随着社会老龄化、人们对高血压的控制和磁敏感加权成像(SWI)序列在临床的广泛应用,CAA 的发病率和临床识别率正逐渐升高,国内外多项队列研究也对CAA 相关生物及影像标志物进行探索验证,不断更新完善其诊断标准,本文旨在汇总CAA 诊断标准的演变并提出未来研究设想。
一、CAA 波士顿诊断标准1.0[4-5]
1996 年新英格兰杂志报道了1 例表现为TFNE 的CAA 病例:69 岁女性反复发作性言语障碍、右侧肢体麻木无力,头颅MRI 检查提示脑小血管病表现,曾考虑短暂性脑缺血发作,相继予阿司匹林、噻氯匹定、肝素及华法林后,仍有反复发作;后该患者发生急性脑叶出血死亡,除外华法林相关脑出血后,患者尸检结果提示重度血管性Aβ 沉积,诊断为CAA。 该团队首次提出CAA 的诊断标准——CAA 波士顿诊断标准1.0:确诊CAA 需要死后尸检病理结果提示脑叶出血、重度血管性Aβ 沉积,并除外其他病灶;而临床诊断很可能的CAA 则要求年龄≥55 岁,临床和影像学检查结果提示局限于脑叶、皮层、皮层下的多发脑出血,且除外其他出血病因(表1)。 这一标准的提出为临床诊断CAA提供了依据,但对单次脑叶出血患者的诊断仍存在不足,其敏感性为89.5%,特异性为81.2%。
二、CAA 波士顿诊断标准1.5[6]
随着磁共振T2∗梯度回波和SWI 序列在临床的应用,皮层表面铁沉积(cSS)在CAA 诊断中的作用逐渐被认识。 cSS 是含铁血黄素在脑、脊髓和颅神经的软膜下层的沉积,可由出血性肿瘤、创伤、血管畸形/动脉瘤、脑膜血管淀粉样沉积导致的蛛网膜下腔反复或慢性出血引起。 回顾性分析38 例病理确诊的CAA 脑出血和22 例非CAA 脑出血患者的T2∗梯度回波序列发现,CAA 组cSS 发生率高达60.5%,而对照组为0。针对CAA 的研究表明,脑叶出血是cSS 的独立危险因素,推测CAA 中出现cSS 的病理生理机制可能有两种:一种是Aβ 沉积的软脑膜小血管反复出血进入蛛网膜下腔(独立于脑叶出血),另一种是既往脑叶出血或微出血漏入蛛网膜下腔[7]。
在很可能的CAA 患者中,cSS 与年龄、慢性脑叶出血、TFNE 独立相关,并被认为是导致 CAA 患者TFNE 临床表现背后的机制[7]。 此外,cSS 也是 CAA脑出血复发的独立预测因素,且大多数新发出血位于cSS 出现部位[8]。 因此,CAA 波士顿诊断标准 1.5 纳入cSS:单次脑叶、皮层、皮层下出血合并局灶性或弥漫性cSS 即可诊断很可能的CAA,其诊断敏感性升高至94.7%,而特异性不变[6](表1)。
三、CAA 爱丁堡诊断标准[9]
基于头颅MRI 检查结果的波士顿诊断标准对CAA诊断有较好的敏感性和特异性,但对于急性发病或生命体征不平稳的患者,或在无法进行MRI 检查的国家或地区难以实现,因此英国学者在2018年提出爱丁堡诊断标准(表2),该标准以携带ApoEε4 基因、头颅CT中蛛网膜下腔出血(SAH)和指状出血征象为评价指标:若3 个指标均为阴性,则诊断为CAA 的概率<7%,除外CAA 诊断的敏感性为100%(95%CI88% ~100%);若存在 SAH 或 ApoEε4 基因,其诊断 CAA 的概率为44% ~64%;若 SAH 合并 ApoEε4 基因或指状出血,其诊断CAA 的特异性为96%(95%CI78% ~100%)。这一诊断标准纳入基因和简单的影像学检查结果,从另一个角度理解CAA 的发病机制,但该诊断标准来源于症状重、早期预后差的脑叶出血患者,是否适合轻型脑叶出血患者尚不清楚,此外,ApoE 基因的检测存在费用相对较高、报告时间长等缺陷,且这一标准与波士顿标准的一致性仍有待探究。

表1 CAA 相关脑出血波士顿诊断标准的演变
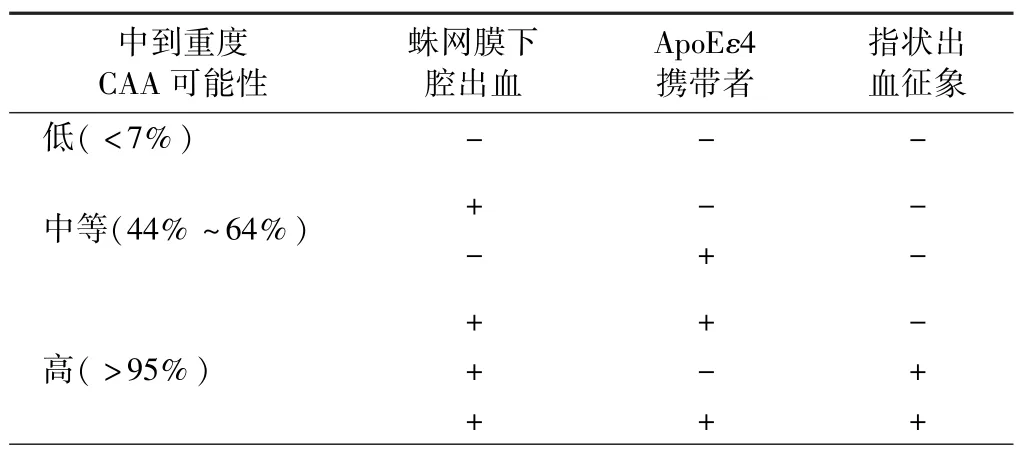
表2 CAA 相关脑出血爱丁堡诊断标准[9]
四、CAA 波士顿诊断标准2.0 试行版[10]
既往对CAA 的认识主要集中在出血性表现,包括脑叶出血、脑微出血、凸面 SAH、cSS 和TFNE,近来越来越多的证据提示,包括脑白质高信号、微梗死、血管周围间隙扩大、认知障碍和CAA-ri 的非出血性表现在CAA 的病理生理过程中同样重要。
以脑白质高信号为主要特征的缺血性病变贯穿CAA 病程的始终[11],是临床前期的遗传性阿尔兹海默病和遗传性CAA 的核心特征之一[12-13],对CAA 早期病程具有较好的提示作用。 CAA 患者的脑白质高信号分布以脑后部为主[14],与CAA 病理改变多累及枕叶一致。 研究提示,CAA 多见皮层下多灶分布的点状白质高信号病灶,而高血压性小血管病多表现为基底节区白质高信号[15]。
血管周围间隙扩大是另一项重要的脑小血管病影像标志物,CAA 患者扩大的血管周围间隙多分布于半卵圆中心。 将半卵圆中心重度扩大的血管周围间隙纳入波士顿诊断标准后可将其诊断敏感性提升至92.3%[16]。基于上述发现,2018 年国际CAA 大会提出CAA 波士顿诊断标准2.0 试行版,这一诊断标准拓宽了对CAA临床和影像学表现的认识,不再局限于脑出血和出血性影像标志物;其中,诊断CAA 的年龄放宽至50 岁以上,临床表现中新增了TFNE 和认知障碍,影像学表现中除经典的脑叶出血、脑微出血和cSS 外,肯定了半卵圆中心重度扩大的血管周围间隙和多灶状分布的脑白质高信号对CAA 诊断的支持作用,以提高诊断标准的敏感性,并删除了“可能的CAA”这一诊断分类,以提高特异性。 2.0 版诊断标准尚未正式发布。 但这一诊断标准也存在一定局限性,如仅在症状性患者中进行验证而无基于人群的样本支撑、存在深部微出血的脑出血患者样本量有限、尸检(金标准)病例数量有限。
五、CAA-ri 诊断标准
CAA-ri 是CAA 相对少见的病理类型,对激素治疗反应较好,因此早期识别具有重要意义。 根据病理类型可以将CAA-ri 分为炎症性CAA(血管性Aβ 合并血管周围炎性细胞浸润)和Aβ 相关血管炎(血管性Aβ合并血管透壁炎性细胞浸润)两种亚型[17]。 2011 年首次提出的CAA-ri 诊断标准分为确诊的CAA-ri 和很可能的CAA-ri[18];2016 年修订版本新增可能的CAA-ri这一诊断,并对临床和影像学表现及特征进一步细化[19](表3)。
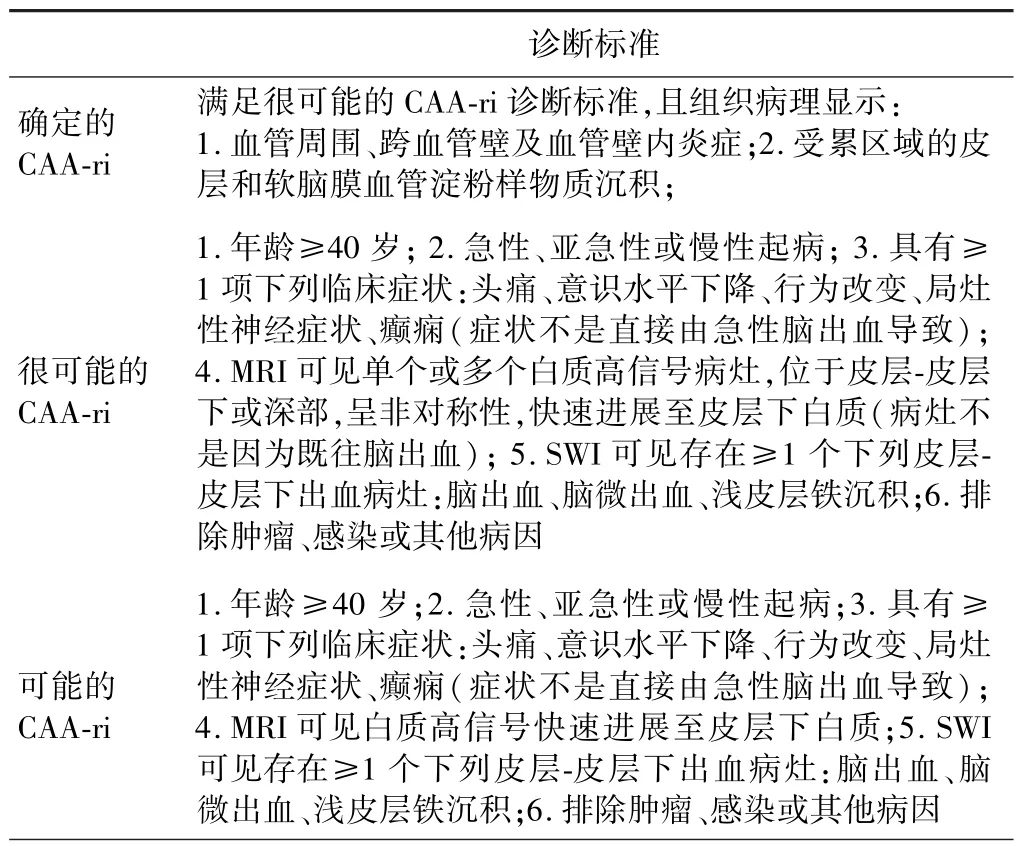
表3 CAA-ri 诊断标准(2016)[18-19]
六、现有诊断标准的局限性
首先,CAA 临床诊断标准均来自于西方患者队列的研究,尚缺乏在东方人群中进行的临床-病理对照研究来进一步证实其在我国患者中应用的敏感性和特异性;其次,东方人群的脑小血管病疾病负担显著高于西方人群,尤其是高血压的高患病率使得深部和脑叶多发微出血灶(混合性微出血)共存的比例在东方人群中明显升高[20],为临床诊断CAA 带来了难度;第三,目前CAA 临床诊断仍依赖于基因和影像学检查,而可以反映CAA 早期病理生理改变的淀粉样、tau 蛋白正电子发射计算机断层显像(PET)和脑脊液、外周血生物标志物在CAA 诊断中的应用尚不明确,有待未来进一步研究。
七、小结
CAA 的诊断在临床中有重要意义,一方面,对需要进行抗栓治疗患者的临床决策起一定作用;另一方面,精确的诊断标准可以为CAA 患者的预后判断及其相关临床试验提供依据。 越来越多的生物和影像标志物使得诊断标准的特异性和敏感性不断提升,但目前也存在对CAA 认识不足、诊断不规范、缺乏国内大规模队列研究的现状,有待进一步研究。

