口腔纳米材料的神经毒性及作用机制
谢琳, 冯晓黎, 邓梓, 马瑞, 胡琛, 邵龙泉
1.南方医科大学口腔医学院,广东 广州(510515); 2.南方医科大学口腔医院,广东 广州(510280)
纳米材料是尺寸为1~100 nm 的颗粒凝聚而成的材料,由于其尺寸大小与DNA、蛋白质、病毒等相近,纳米材料的生物学效应尚未完全清楚。纳米材料因其独特的性质如小尺寸效应、表面效应、界面效应、量子效应,使其广泛应用于各大领域。纳米材料在口腔领域中也有着较大范围的应用,例如有大量的研究在粘接剂[1]、种植体表面涂层[2]、漱口水[3]等加入纳米材料;并在肿瘤治疗[4]、种植体表面改性[5]、抗菌[6]、骨缺损修复[7]、牙周组织修复[8]、缓释载体[9]等方面得到广泛运用。因此,其潜在的毒性也成为学者们日益关注的热点。研究证实纳米颗粒通过呼吸道、消化道等方式进入人体,经过淋巴、血液循环后沉积在靶器官,继而穿透细胞膜、进入线粒体产生细胞毒性[10-11]。此外纳米材料还可通过穿过血脑屏障、嗅神经[12]、感觉神经末梢[11]转运作用于中枢神经系统,可引起一定的神经毒性,造成神经组织损伤。许多体内和体外研究探索了纳米材料与生物大分子、细胞、器官和组织的相互作用,发现了纳米材料的生物毒性可能是由氧化应激[13]和炎症反应[14]、细胞自噬[15]、基因毒性[16]等机制引起。为更好了解口腔纳米材料对中枢神经系统的毒性,以进一步完善生物安全性评估系统,本文对口腔纳米材料及其进入中枢神经系统的途径,以及引起神经毒性的可能机制进行综述。
1 纳米材料进入机体的临床途径
在生活中,生产研究开发人员、口腔工作者和患者是最常接触到纳米材料的人群。在临床中,口腔纳米材料直接用于口腔或者颌面部区域,纳米材料在吞咽后通过口腔黏膜吸收或通过消化道轻易进入血液循环、淋巴循环。纳米颗粒进入人体后,可沉积在肝、心、脑等不同器官。人体暴露途径主要有皮肤接触、黏膜接触、呼吸道及消化道等。
在皮肤接触中,研究表明纳米TiO2在健康的或受损的皮肤中不会穿透角质层进入活细胞,因此不会到达全身循环[17]。纳米颗粒等有可能通过黏膜由感觉神经末梢摄取,最终沿神经转运。至于其他暴露途径,纳米颗粒等主要通过呼吸道吸入体内,沉积在肺泡表面后,经巨噬细胞吞噬作用进入血液循环,进而进入中枢神经系统产生相应毒性[10]。纳米二氧化钛颗粒可通过呼吸系统进入鼻腔黏膜,并沿神经细胞轴突由鼻异位至脑,最终通过鼻-脑通路的逆行性轴突转运进入脑组织[18]。
2 纳米材料进入中枢神经系统的途径
随着人们对纳米材料的深入研究,发现纳米材料能够通过血脑屏障(blood brain barrier,BBB)进入中枢神经系统,进而产生一定的神经毒性。纳米颗粒可以通过以下3 种途径进入中枢神经系统:①跨越血脑屏障;②先经鼻黏膜转运至嗅球,再经嗅神经转运至中枢神经系统;③经感觉神经末梢直接摄入并转运至中枢神经系统。
2.1 血脑屏障
血脑屏障由脑微血管内皮细胞(brain microvascular endothelial cells,BEMC)及BEMC 之间广泛的紧密连接构成,紧密连接由跨膜蛋白(Claudin-1等)、胞浆附着蛋白(ZO-1 等)与细胞骨架蛋白相连而组成,是细胞之间的通透屏障(图1)。紧密连接蛋白表达量、位置分布及结构功能的变化可引起血脑屏障的通透性发生改变。纳米颗粒主要利用内皮细胞或胶质细胞的内吞/外排作用穿透血脑屏障。
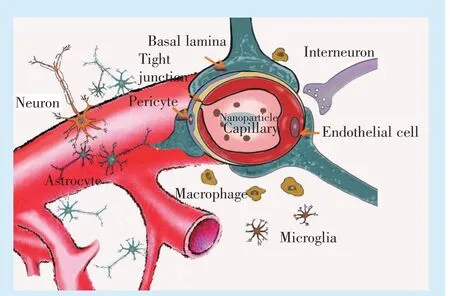
Figure 1 Schematic of the blood-brain barrier and the associated components of the neurovascular unit图1 血脑屏障及其神经血管组成部分示意图
2.2 嗅觉及味觉神经通路
神经系统的内脏感觉传导通路分为一般内脏感觉和特殊内脏感觉传导通路,其中,嗅觉和味觉同属于特殊内脏感觉传导通路。纳米颗粒可以通过鼻腔滴注、舌体滴注分别进入嗅细胞和味蕾,从而进入嗅觉味觉神经通路,引起神经毒性。
嗅球-大脑的转运途径主要有2 条通路:嗅神经通路和三叉神经通路。其中,经由嗅神经入脑途径是转运的主要途径。将纳米材料滴注进入小鼠的鼻腔之后,可经鼻黏膜沿嗅神经或嗅黏膜上皮通路进入嗅球,进而到达中枢神经系统,产生神经毒性[12]。另外,也有研究发现通过在舌体上滴注纳米颗粒,其可经由味觉神经通路进入脑组织,沉积在小脑、大脑皮层和海马等部位[19]。
2.3 感觉神经末梢直接摄入及神经转运
研究发现经气管滴注,支气管区域的感觉神经可摄入纳米颗粒并能将其转运至颈部的迷走神经节。纳米颗粒还可以被三叉神经分布在口、鼻腔黏膜的感觉神经末梢摄取,最终沿神经转运至中枢神经系统[11]。
3 纳米材料对机体的毒性表现
根据目前的研究进展,笔者汇总了一些纳米材料对机体神经系统的损害。其中包括纳米材料对中枢神经系统的组织损伤、中枢神经系统功能的影响、胚胎的神经毒性作用。
3.1 纳米材料对中枢神经系统的组织损伤
3.1.1 体内毒性表现 口腔纳米材料会对脑组织的不同部位有不同程度的损害。经纳米颗粒暴露的动物会对动物的海马体、纹状体、大脑皮质、小脑、脑的腹侧表面近端额叶有损伤。纳米材料对大脑不同分区的损害程度不同,有研究将单壁碳纳米管通过尾静脉注射至清洁级大鼠,发现纳米颗粒对其小脑损伤较小,而纹状体和海马的损伤程度较重。纳米材料损害海马体的结构和细胞、使其发生了形态、结构及增殖率减少的改变,会影响机体学习记忆功功能[20]。纳米材料暴露后的大鼠大脑皮层和海马组织松解,细胞排列松散。在海马结构中,海马CA1 亚区和齿状回是最易受损的结构。纳米材料的暴露破坏了CA1 海马区域的锥体神经元将会影响机体的条件反射和记忆[18]。
3.1.2 细胞毒性表现 纳米材料会使神经元变形、结构破坏,小胶质细胞完整性破坏、变形及活力下降,还会激活凋亡信号通路使人神经胶质瘤细胞(SH-SY5Y 细胞)发生凋亡、抑制细胞增殖期。研究发现纳米材料对神经元损害包括突触可塑性改变,神经元超微结构变化如神经元结构紊乱,核固缩核膜破坏,部分线粒体膜破坏消失,内质网损伤,部分细胞溶酶体中还可见黑色聚合物,突触后膜致密物增厚[11]。
3.2 纳米材料对中枢神经系统功能的损伤
纳米材料通过血脑屏障进入中枢神经系统后,通过影响神经元、小胶质细胞的凋亡、自噬以及不同的形态变化、结构损害等一系列细胞层面的损害导致组织发生损害,影响高级神经中枢如躯体感觉中枢、视觉中枢、听觉中枢和嗅觉中枢,并由此导致大脑功能的损害,主要体现在低级神经行为如自发性活动及高级神经功能,包括抑郁行为、颜色的辨知、学习能力及退行性神经功能障碍等。
3.3 纳米材料对胚胎发育的神经毒害
机体的血脑屏障是随着年龄的增长逐渐发育完善的。在胚胎期和幼儿期间,由于血脑屏障的功能尚未完全建立,因此,纳米材料更易通过血脑屏障进入到脑组织,进而产生毒性作用。因此,对纳米材料对胚胎发育的神经毒性应该进行严格评估。在动物实验研究中发现,纳米材料对胚胎有神经毒性,可使胚胎致死、胚胎致畸以及造成胎儿的发育异常。
研究发现,暴露于100 μg/L 的氧化石墨烯的斑马鱼胚胎,氧化石墨烯对胚胎的发育影响主要表现为明显升高斑马鱼死亡率、胚胎畸形如小头畸形、色素减少的小眼睛或发育不全[21]。子代的血脑屏障在怀孕的母体中发育需要一定的时间,血脑屏障发育完善是胚胎的第15 天,因此产前暴露,特别是在屏障未发育完全之前,纳米材料可能更易通过血脑屏障进入到胎儿的脑组织,进而产生毒性效应。产前暴露于纳米ZnO 的孕鼠的子代,观察到子代大脑中锌的浓度显着升高,神经元异常凋亡坏死,出现学习和记忆功能障碍[22]。
4 纳米材料的神经毒性机制
目前所知的纳米材料所导致的神经毒性反应包括细胞凋亡、氧化应激、炎症反应、遗传毒性和细胞成分的直接损伤等。同时,其他因素如信号传导途径破坏、自噬和DNA 甲基化、神经递质失调和突触可塑性也被证明促进纳米颗粒的神经毒性。
4.1 细胞自噬
纳米颗粒可以引发细胞自噬。所研究纳米材料引起的自噬类型为巨自噬,即纳米材料被细胞吞噬后,被自噬泡包覆并运送至溶酶体中分解。
经纳米颗粒处理过的细胞,会出现核固缩固裂,见自噬体、溶酶体形成,自噬泡累积,自噬蛋白LC-3 和Beclin-1 表达增加。当用纳米氧化铜处理小鼠巨噬细胞Raw264.7(52 nm,24 h)发现LC3-11表达水平明显呈剂量依赖性上升,p38 蛋白和细胞外调节蛋白激酶(extracellular regulatory protein kinase,ERK)的磷酸化水平提高[15],说明纳米材料可能通过影响自噬有关信号通路p38 和ERK 信号通路。将大鼠肾上腺髓质嗜铬瘤分化细胞株(PC12细胞)暴露于纳米二氧化硅(25 nm,200 μg/mL,24 h)后诱导自噬,PC12 细胞中自噬蛋白LC3-Ⅱ和Beclin 1 水平升高。纳米二氧化硅(SiO2)抑制胞内磷脂酰肌醇激酶(phosphatidylinositol 3-kinase,PI3K)、蛋白激酶B(protein kinase B,AKT)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的磷酸化[23],即影响PI3K-AKT-mTOR 信号通路。
4.2 氧化应激
研究表明,当纳米颗粒作用于细胞时,可引起细胞的活性氧水平升高,造成DNA、蛋白质和膜等生物因子的氧化损伤。说明纳米颗粒具有细胞毒性和氧化应激作用。核转录因子Nrf2 信号传导途径与氧化应激反应有关。暴露于纳米SiO2-Fe(60 nm,20 μg/mL)的巨噬细胞激活了Nrf2 信号传导,核Nrf2 含量(Nrf2 活化的标志)从3 h 开始增加,并在9 h 恢复到基础水平[13]。氧化应激与泛素-蛋白酶体系统(ubiquitin-proteasomesystem,UPS)也有关,将PC12 细胞暴露于纳米二氧化硅(25 nm)后,抑制了20S 蛋白酶体的活性,并降低了在UPS 中的泛素、Parkin(PARK2 基因编码的一种蛋白)和泛素羧基末端水解酶L1 蛋白水平。表明纳米二氧化硅通过抑制UPS 诱导氧化应激[23]。
4.3 炎症反应
中枢神经系统由神经细胞和胶质细胞构成。纳米材料可能影响炎症反应有关信号通路,纳米氧化锌引起BV2 小胶质细胞的炎症反应引起p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)蛋白、c-Jun 氨基末端激酶(c-Jun NH2-terminalprotein kinase,JNK)、非受体型酪氨酸激酶(janus kinase 2,JAK2)、信号传导及转录激活蛋白(signal transducer and activator of transcription 3,STAT3)磷酸化水平增高,即通过激活p38MAPK、JNK、MAPK 及JAK2/Stat3 信号通路进行调节的[24]。非特异性免疫也参与其中,研究表明碳纳米管被巨噬细胞的Toll 样受体(toll like receptor,TLR)识别为病原体,单壁碳纳米管与TLR4 由疏水基团相互作用,从而触发机体的先天免疫反应并分泌白介素和趋化因子等炎性因子[25]。炎症反应通过诱导炎症的有毒副产物(如活性氧和补体蛋白)产生以及通过细胞凋亡/坏死来促进细胞死亡[26-27]。然而这些纳米颗粒诱导细胞毒性的级联反应尚未清楚,因此需要朝这个方向研究以充分识别炎症反应驱动细胞死亡的信号传导网络。
4.4 细胞凋亡
有研究者认为,神经细胞的减少主要是由于细胞凋亡和坏死性死亡共同造成的。纳米氧化锌可以诱导SH-SY5Y 细胞细胞凋亡,引起促凋亡Bax基因表达升高和抗凋亡Bcl-2 基因表达的降低[28]。凋亡相关因子caspase-3 被认为是一种“效应子”,与“死亡级联”的启动有关,是细胞进入凋亡信号通路的重要标志,纳米银暴露的斑马鱼胚胎的细胞凋亡与caspase 的内源性通路有关[29]。将神经元细胞暴露于柠檬酸盐包覆的纳米银后,磷酸化AKT(Ser473)水平升高,这表明AKT/GSK-3/caspase-3 信号通路的激活在纳米银介导的神经毒性中起着重要的作用[30]。在氧化石墨烯暴露的PC12 细胞中也观察到caspase-9 介导的凋亡,而且氧化石墨烯诱导的细胞凋亡与自噬底物p62/SQSTM 的异常积累有关[31]。
4.5 基因毒性
纳米颗粒介导的基因毒性的潜在机制有脱氧核糖核酸损伤、染色体断裂、细胞周期停滞、编码蛋白表达异常等。暴露于氧化石墨烯的斑马鱼胚胎会引起DNA 损伤,可能与BER 信号通路有关[16]。将PC12 细胞暴露于纳米二氧化钛颗粒,引起PC12 细胞的DNA 甲基转移酶总活力出现明显下调,并且下调的趋势与总体DNA 甲基化水平的改变相一致[18]。职业性接触纳米金属氧化物的工人会发生DNA 甲基化和DNA 损伤,血浆和尿液的8-羟基脱氧鸟苷水平与DNA 甲基化呈负相关[32]。纳米二氧化硅通过依赖细胞周期检测点激酶1(checkpoint kinase 1,Chk1)的G2/M 细胞周期检查点信号通路的激活,可以引起人脐静脉内皮细胞的脱氧核糖核酸损伤[33]。
5 影响纳米材料毒性的因素
影响纳米材料毒性的因素很多,例如颗粒的大小、数目、浓度、溶解度、物理及化学性质等。
5.1 粒径
一般认为,纳米金的粒径越小,越易通过血脑屏障,能引起更严重的氧化应激和神经损伤,神经毒性也就越大。细胞凋亡跟纳米颗粒的粒径也有关,10 nm 纳米二氧化硅诱导细胞凋亡最多,100 nm最少[34]。对金纳米颗粒研究表明,具有较小直径的纳米颗粒会促进细胞凋亡[35]。
5.2 形状
一般认为,球形的纳米颗粒比圆柱形、椭球形或立方形等形状的纳米颗粒更容易被细胞摄取,也有研究发现,较大长径比的纤维状结构的细胞毒性比球形结构更大。球形纳米颗粒比棒状纳米颗粒的细胞毒性更小[36]。
5.3 纳米颗粒的聚集状态、表面修饰
当纳米颗粒大量聚集后形成聚集体,其比表面积降低,理化性质也随之发生改变,更不易被细胞吸收,因此对细胞的生物学效应也相对减小。修饰集团会影响纳米颗粒在体内的分布及其清除效率,进而产生不同的生物毒性。相比之下,表面修饰物包被后的纳米材料神经毒性更弱,因为修饰集团会通过影响纳米颗粒在体内的分布及其清除效率,产生不同程度的生物毒性[37]。
5.4 暴露剂量和暴露时间
多数纳米颗粒具有剂量依赖性,纳米材料暴露浓度越高、时间越长,在生物体内的累积量越大,对生物的毒性也越强。量子点的毒性效应具有剂量、时间和尺寸依赖性[38]。类似地,纳米ZnO可降低PC12 细胞的存活率,表现为时间依赖性和浓度依赖性。多壁碳纳米管也表现出剂量依赖性的氧化应激诱导作用[39]。
6 总结与展望
随着纳米材料在口腔医学领域的应用范围不断扩大,牙科工作人员和患者对纳米材料的接触日益增多,因此需要接触生物安全性良好的材料。中枢神经系统可能是纳米材料的潜在靶器官,确定纳米颗粒的神经毒性作用至关重要。虽然近年来纳米颗粒对中枢神经系统的影响受到了关注,但体内和体外研究仍然有限。目前较为局限的测试方法和实验模型也使得建立科学评估系统变得困难。而纳米材料所导致的神经毒性反应如氧化应激、凋亡、坏死等机制尚未完全清楚。因此,不同纳米材料的神经毒性作用的机制研究仍将是下一步研究的重点。

