Leptin过表达对猪前脂肪细胞脂滴形成的研究
胡濒月 胡杨 成文敏 赵素梅 赵红业,4 魏红江
(1. 云南省动物基因编辑与体细胞克隆技术重点实验室,昆明 650201;2. 云南农业大学动物科学技术学院,昆明 650201;3. 云南农业大学植物保护学院,昆明 650201;4. 云南生物资源保护与利用国家重点实验室,昆明 650201)
在全球范围内,肥胖症患者呈逐年上升的趋势,已严重危害着人类健康。肥胖是世界范围内共同关注的社会性健康问题,也是世界各国致力解决的重大难点问题[1]。肥胖发生的直接原因是由于脂肪组织的过度沉积造成的。人和动物体内脂肪的沉积过程类似,一方面是脂肪组织细胞内脂肪不断合成、蓄积的过程;另一方面是脂肪组织中脂肪细胞的不断分化过程,这两个过程的协调统一是脂肪组织形成的基础,而脂肪组织的主要功能是为机体蓄积能量,但脂肪组织的过度增殖和脂肪的过度蓄积可导致人类肥胖和体脂的过度沉积[2-3]。当前,关于脂肪组织的沉积代谢规律的研究多使用3T3-L1前脂肪细胞系、大鼠原代脂肪细胞及肥胖鼠模型的原代脂肪细胞或脂肪组织、猪血管基质细胞的原代培养前脂肪细胞为材料[4-5]。猪可作为理想的人类疾病动物模型,但迄今为止,以转入目的基因的方式构建人类肥胖动物疾病模型来研究脂肪组织或细胞的沉积代谢规律及其相关功能基因的调控机制研究还未见报道。
Leptin又名瘦素、瘦蛋白、抗肥胖因子、苗条素,是由肥胖基因编码、脂肪细胞分泌的一种激素样蛋白质,具有调节动物摄食行为、增加能量消耗、抑制脂肪合成、促进脂肪分解和降低采食量的作用[5],并能维持正常的脂类代谢和机体的能量平衡[6],其作为一种脂肪细胞分泌的激素蛋白,在维持脂肪组织质量稳态中发挥着重要作用。有大量研究证实,Leptin可提高脂肪细胞的脂肪分解[7-9]。也有人报道,Leptin可通过下丘脑利用组织特异性方式调节外周组织中葡萄糖和脂质代谢[10]。体内Leptin的浓度与体脂储存的多少有关,且影响着脂肪细胞的大小[11-13]。Leptin受体蛋白可在包括脂肪细胞在内的多种组织中大量表达,表明Leptin可能通过自分泌的受体信号来调节脂肪组织代谢活动[14]。在体外,Leptin可降低组织中脂肪细胞的生成,增加甘油三酯水解,促进脂肪酸的氧化[15]。Leptin表达水平的增加能促进棕色脂肪组织[16]和白色脂肪组织[7]的交感神经传出脂肪酸的分解信号,从而可促进脂肪分解[8-9]。Shimabukuro等[17]的研究报道,在脂肪组织和成熟的脂肪细胞中,Leptin可促进甘油三酯分解。也有报道,脂肪细胞内Leptin基因的表达量与细胞内脂类的含量和脂肪细胞的大小密切相关[18]。携带有低水平Leptin表达的ob/ob鼠尽管其血浆瘦蛋白含量可维持在正常水平,但仍可导致ob/ob鼠产生肥胖[19],这表明降低脂肪组织内的Leptin基因表达可导致动物发生肥胖症。基于前人的这些相关报道,Leptin与脂质代谢的相关机制仍不清楚,尤其在利用过表达Leptin基因的方式构建猪等大动物模型来研究Leptin与脂质代谢相关的功能基因的调控机制也尚未被报道。
动物机体摄入过多的能量后,肝脏能将多余的能量通过形成脂肪或以中性甘油三酸酯(Triacylglycerol,TAG)的形式有效地沉积在脂肪组织中,前脂肪细胞是动物体内终生存在的一类具有增殖和脂肪细胞定向分化能力的特异化前体细胞[20],中性TAGs在脂肪细胞中的不断积累造成脂滴不断增大,而脂肪细胞通过分泌Leptin能够有效抑制甘油三酯的合成。动物机体脂肪的代谢还受脂质代谢通路相关基因的调控。有报道,PPARγ与脂肪代谢和脂滴形成密切相关,是PPARs家族成脂能力最强的亚型[21]。SREBPs裂解激活蛋白SCAP(SREBPs cleavage-activating protein,SCAP)用来控制SREBPs的激活。SCAP是处于内质网的一种膜蛋白,同时SCAP能与SREBPs在内质网形成复合物,参与甘油三酯的合成[22-24]。TAG合成涉及酰基转移酶将酰基脂肪酸转移至活化的甘油主链,酰基转移酶包括3-磷酸甘油酰基转移酶(GPAM),1-酰基甘油-3-磷酸O-酰基转移酶6(AGPAT6)[25]。另外,PLIN2基因在多种组织中广泛表达,是形成细胞脂滴的结构蛋白,能够刺激脂质的聚集和脂滴的形成[26]。本研究基于实验室前期Leptin过表达猪的研究基础[27],通过分离培养Leptin过表达猪和野生型猪前脂肪细胞进行传代培养,并诱导分化形成脂滴,通过油红O及Bodipy染色观察脂滴的形态,统计分析脂滴形成的数量及脂质含量,进一步利用Q-PCR检测分析脂质合成代谢相关基因mRNA的表达情况,旨为进一步阐明人类肥胖发生发展的分子机理研究奠定一定理论基础。
1 材料与方法
1.1 材料
所用Leptin过表达和野生型猪皮下前脂肪细胞均与实验室已发表文章[27]中的猪为同一个体。
1.2 方法
1.2.1 猪前脂肪细胞分离和传代培养 通过外科手术法从成年的Leptin过表达猪(Leptin)和野生型猪(control)皮下获取脂肪组织,立即将其浸入含有5%青霉素-链霉素溶液(PS)溶液中,置于碎冰中运送到实验室。用无菌PBS(含5%PS)洗涤3次,用不含PS的PBS洗涤,然后用眼科剪将脂肪组织充分剪碎并转移到加有2 mL胶原酶I的T-25瓶中,置于38℃二氧化碳培养箱中消化约1.5 h,室温1 500 r/min、3 min离心3次,收集细胞沉淀,用10%FBS、1%PS的DMEM完全培养液重悬后转移到35 mm培养皿中,置于38℃,5%CO2的培养箱中进行传代培养,2 d更换一次完全培养基。按照标准方案[28]诱导第3至第5代的猪前脂肪细胞进行分化,具体将猪前脂肪细胞传代接种在35 mm培养皿中并增殖至汇合度达50%-60%时,使用分化液(含有10%胎牛血清,0.87 μmol/L胰岛素,1 μmol/L地塞米松,0.25 mmol/L IBMX、1 μmol/L罗格列酮)诱导分化,此时记为0 d,诱导2 d后,将分化液替换为维持培养基(含有10%胎牛血清,0.87 μmol/L胰岛素,1 μmol/L地塞米松和1 μmol/L罗格列酮的DMEM培养基)促使其继续分化,此后每2 d更换一次新鲜的维持培养基,分别在诱导分化后第0、4、6、8、10和14天时收集细胞用于后续相关实验。
1.2.2 脂滴Bodipy染色 将前脂肪细胞诱导第0、4、6、8、10和14天进行脂滴Bodipy染色,弃去培养基,PBS洗涤细胞1次,并用含4%多聚甲醛的PBS溶液在室温下固定30 min,用PBS洗涤3次,滴加600 μL Bodipy工作液(将1 mg/mL储存液按1∶1 000用PBS稀释,工作液需避光4℃保存)。室温染色15 min后用PBS洗涤细胞3次,立即在荧光显微镜下观察并拍照,用ImageJ统计分析脂滴面积。
1.2.3 脂滴的油红O染色和脂质含量测定 分别选取诱导分化第0、4、6、8、10和14天的前脂肪细胞,弃去培养基,用PBS洗涤细胞1次,加入4%多聚甲醛在室温下孵育30 min,接着用PBS洗涤细胞3次,加入油红O工作液(将3.5 mg/mL的贮存液按6∶4用H2O稀释),室温下染色30 min,用PBS洗涤细胞3次,在显微镜下观察细胞并拍照。每个培养皿中加入等体积的异丙醇及4%NP-40进行萃取,并在充分混合后使用全波长酶标仪测量520 nm处的吸光度值。
1.2.4 RNA提取及Q-PCR检测相关基因mRNA表达水平 用TRIzol提取总RNA,使用Prime-Script RT试剂盒从总RNA合成cDNA,用Q-PCR评估脂滴分化及脂质合成代谢相关基因的mRNA表达水平。Q-PCR实验使用的PCR引物(表1)由Primer 5.0软件设计,并由北京擎科生物技术有限公司合成。20 μL Q -PCR反应体系:2×SYBR Green Master Mix 10 μL,ddH2O 7 μL,10 μmol Forward primer 1 μL,10 μmol Reverse primer 1 μL,cDNA 1 μL。Q -PCR特异产物通过溶解曲线分析,相对Ct值法即X = 2-ΔΔCt测定相对基因表达变化。

表1 Q-PCR所用引物序列表
1.2.5 统计学分析 本研究中所有的实验数据均以平均值±标准误(x-±s 表示,采用t检验进行统计学分析,#,*P<0.05为差异显著;##,**P<0.01为差异极显著),作图采用GraphPad Prism 7软件。
2 结果
2.1 Leptin过表达对猪前脂肪细胞诱导分化形成脂滴的影响
诱导分化后,Leptin过表达猪前脂肪细胞和野生型猪前脂肪细胞的分化进程存在差异(图1)。0 d时均呈现梭型,2 d后细胞开始膨胀,从原始的梭形逐渐形成球形,呈现出“环状”。第4天野生型细胞内生成的微小脂滴已汇集成多个小脂滴,而Leptin过表达细胞仅出现微小脂滴。直到第14天,Leptin过表达猪前脂肪细胞脂滴的生长才与野生型趋于一致,表明Leptin过表达猪前脂肪细胞分化形成脂滴的进程慢于野生型猪前脂肪细胞。
2.2 Leptin过表达对猪前脂肪细胞诱导分化过程中脂质合成的影响
根据Bodipy染色结果(图2-A,2-D),第4天时,野生型猪前脂肪细胞中的荧光强度明显高于Leptin过表达猪前脂肪细胞。之后第6天时两者细胞表达量仍然存在差异,直到14 d时,Leptin过表达的猪脂肪细胞与野生型猪脂肪细胞表达量也不相同。进一步,用油红O染色观察后再用异丙醇和NP-40萃取脂肪细胞中的甘油三酯进行吸光度测定(图2-B,2-C),结果与荧光强度值相符。从4-10 d,Leptin过表达猪前脂肪细胞的脂质形成显著低于野生型猪前脂肪细胞(P<0.05),直到诱导分化后第14天,Leptin过表达猪前脂肪细胞甘油三酯的含量与野生型猪的前脂肪细胞甘油三酯的含量趋于一致(P>0.05)。
2.3 Leptin过表达对猪前脂肪细胞诱导分化形成脂滴过程中脂质代谢相关基因mRNA表达水平的影响

图1 Leptin过表达猪前脂肪细胞与野生型猪前脂肪细胞诱导分化形成脂滴的情况
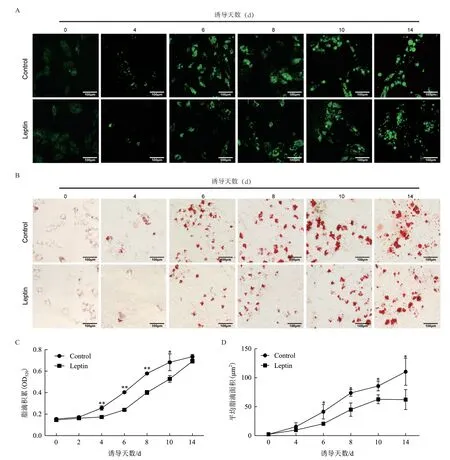
图2 Leptin过表达与野生型猪前脂肪细胞诱导分化过程中脂质合成含量测定结果
Q-PCR结果显示,Leptin过表达猪前脂肪细胞中Leptin的表达量显著高于野生型猪前脂肪细胞(P<0.05)(图3-A)。进一步利用Q-PCR检测了诱导0 d和4 d后的猪前脂肪细胞中脂质调节相关基因的表达情况。经过4 d诱导后,在3个脂质代谢相关的核转录因子,PPARγ和SREBP1的表达在野生型猪前脂肪细胞中极显著升高(P<0.01),SCAP的表达水平显著升高(P<0.05);而在Leptin过表达猪前脂肪细胞中PPARγ的表达水平显著升高(P<0.05),SREBP1和SCAP的表达无明显变化(P>0.05)。与野生型相比,开始诱导时,Leptin过表达猪前脂肪细胞中PPARγ基因的表达呈现极显著低的水平(P<0.01);诱导4 d后,在Leptin过表达猪脂肪细胞中,以上3个基因的表达均极显著降低(P<0.01)(图3-B)。这些结果表明,Leptin过表达抑制了脂质代谢通路中转录相关基因的表达。同时,诱导4 d后,脂肪酸转位酶FAT-CD36和脂蛋白酯酶LPL的表达水平在野生型和Leptin过表达猪前脂肪细胞中均极显著升高(P<0.01)。与野生型组相比,开始诱导时,在Leptin过表达猪脂肪细胞中FAT-CD36基因的表达均呈现极显著低的水平(P<0.01);诱导4 d后,在Leptin过表达猪前脂肪细胞中,FAT-CD36的表达仍显著低于野生型(P<0.05),LPL的表达极显著低于野生型(P<0.01)(图3-C)。
在诱导第4天时,3个TAG合成的相关基因AGPAT6、GPAM和PLIN2的表达水平在野生型猪前脂肪细胞均极显著升高(P<0.01),而在Leptin过表达猪前脂肪细胞中AGPAT6和PLIN2的表达水平极显著升高(P<0.01),GPAM的表达水平无显著变化。与野生型相比,开始诱导时,在Leptin过表达猪前脂肪细胞中的上述3个基因的表达均无显著变化(P>0.05);诱导4 d后,在Leptin过表达猪前脂肪细胞中以上3个基因的表达均呈现极显著降低的水平(P<0.01)(图3-D)。这些结果表明,Leptin过表达抑制了脂质合成转录相关基因、TAG合成相关基因以及长链脂肪酸摄取相关基因的表达。
3 讨论
Leptin是由脂肪细胞分泌的细胞因子,对脂质代谢调节具有重要的作用[5]。因缺少理想的肥胖实验动物模型,肥胖及体脂过度沉积发生的分子机制研究主要通过添加外源性Leptin的前脂肪细胞系体外分化进行研究。肥胖型ob/ob鼠是目前常用的肥胖实验动物模型,该鼠是由于OB基因缺陷而引起的先天性肥胖,但啮齿类动物和人在基因组和机体代谢上存在较大差异,其作为研究人肥胖的动物模型存在缺陷,因此需更理想的动物模型来研究人肥胖发生的分子机制。猪与人在解剖和生理代谢特点方面非常相似,对猪、人、鼠OB基因的研究表明,猪与人OB基因的同源性为88.5%[31],鼠与人OB基因的同源性为83%[32],本实验室前期已成功构建了过表达Leptin基因的猪模型,体外实验结果表明,6月龄野生型猪体重约为转Leptin基因猪体重的2.5-3.3倍,ELASA检测转Leptin基因猪血清中的Leptin水平显著高于野生型(P<0.05)[27]。Ke等[33]的研究表明低脂肪率与脂肪细胞中甘油三酯的合成与储存减少有关。因此,基于猪与人同源性高的优点,我们选择猪构建人类疾病的肥胖模型,并进一步成功构建了过表达Leptin基因猪模型,将更好地模拟人类肥胖疾病的发生,进而为揭示肥胖疾病发生发展相关的甘油三酯等代谢机制研究奠定了一定的理论基础。
在3T3-L1细胞系培养基中添加5-500 ng/mL外源性Leptin,可抑制脂质积累[34],提示Leptin在一定程度上能影响动物机体脂质的积累和脂肪细胞中TAG的积累。脂肪细胞的生成和分化还受激素、细胞间、细胞与间质间相互作用的转录因子的调控[35-37],如PPAR、SREBP1c等[38-42]。PPARγ主要在脂肪组织中参与脂肪细胞的分化,是诱导脂肪细胞分化的特异性转录因子,在脂肪细胞分化过程中,表达水平不断上升,对脂肪细胞的分化起着重要作用[43-44]。Kim等[45]研究发现SREBP1能促进小鼠脂肪细胞系3T3LI前脂肪细胞脂滴的积累,加速前体脂肪细胞的分化进程。Cabrero等[46]通过重组人Leptin处理原代培养人源单核巨噬细胞24 h,发现PPARγmRNA表达下调。本实验研究结果表明,过表达Leptin可抑制脂滴数量增加,在一定程度上致使甘油三酯的合成速率降低,并可促进PPARγ、SREBP1、SCAP基因的下调,这与前人所报道的结果一致,Leptin可抑制脂肪细胞分化和增殖,其机制可能是通过下调PPARγ、SREBP1、SCAP基因的表达来抑制脂肪细胞的分化和代谢。
脂肪细胞的分化过程在激素诱导的培养体系中4 d内完成,在分化的早期阶段进入细胞周期,经1-2次有丝分裂之后永久地退出细胞周期,开始蓄积脂滴,经过终末分化阶段分化为成熟脂肪细胞[47-48]。脂肪酸是合成甘油三酯的重要原料,有研究表明,FAT/CD36可将LCFA运输到脂肪细胞中[15],过表达FAT/CD36可增强脂肪酸的转运,而LPL是脂肪细胞早期分化的标志[49]。本实验研究结果表明,Leptin过表达猪前脂肪细胞中LPL和FAT/CD36基因的mRNA表达水平显著降低,与上述所报道的研究结果一致,表明Leptin在一定程度上可通过下调FAT/CD36、LPL基因的表达进而抑制LCFA的运输和脂肪细胞的分化。也有研究报道,在脂肪细胞分化的初期阶段,Leptin可抑制脂肪细胞脂肪酸的合成,从而减少脂肪沉积,PLIN2(Adipophilin)位于脂滴表面,还与脂滴的储存密切相关[50-51]。外源性添加10 ng/mL Leptin可有效减少大鼠脂肪细胞TAG的积累[15]。PPARγ特异性激活剂罗格列酮(Ros)与Leptin联合处理大鼠脂肪细胞,发现能有效减弱Leptin对PPARγ、PLIN2的mRNA表达的下调作用[6]。本研究结果显示,过表达Leptin猪前脂肪细胞TAG合成的相关基因(GPAM,AGPAT6)与脂滴储存相关基因PLIN2的mRNA表达水平均下调,与前人所报道的结果相一致,表明Leptin可通过下调TAG合成相关基因的表达及PLIN2基因的mRNA下调来抑制脂质的储存和积累。
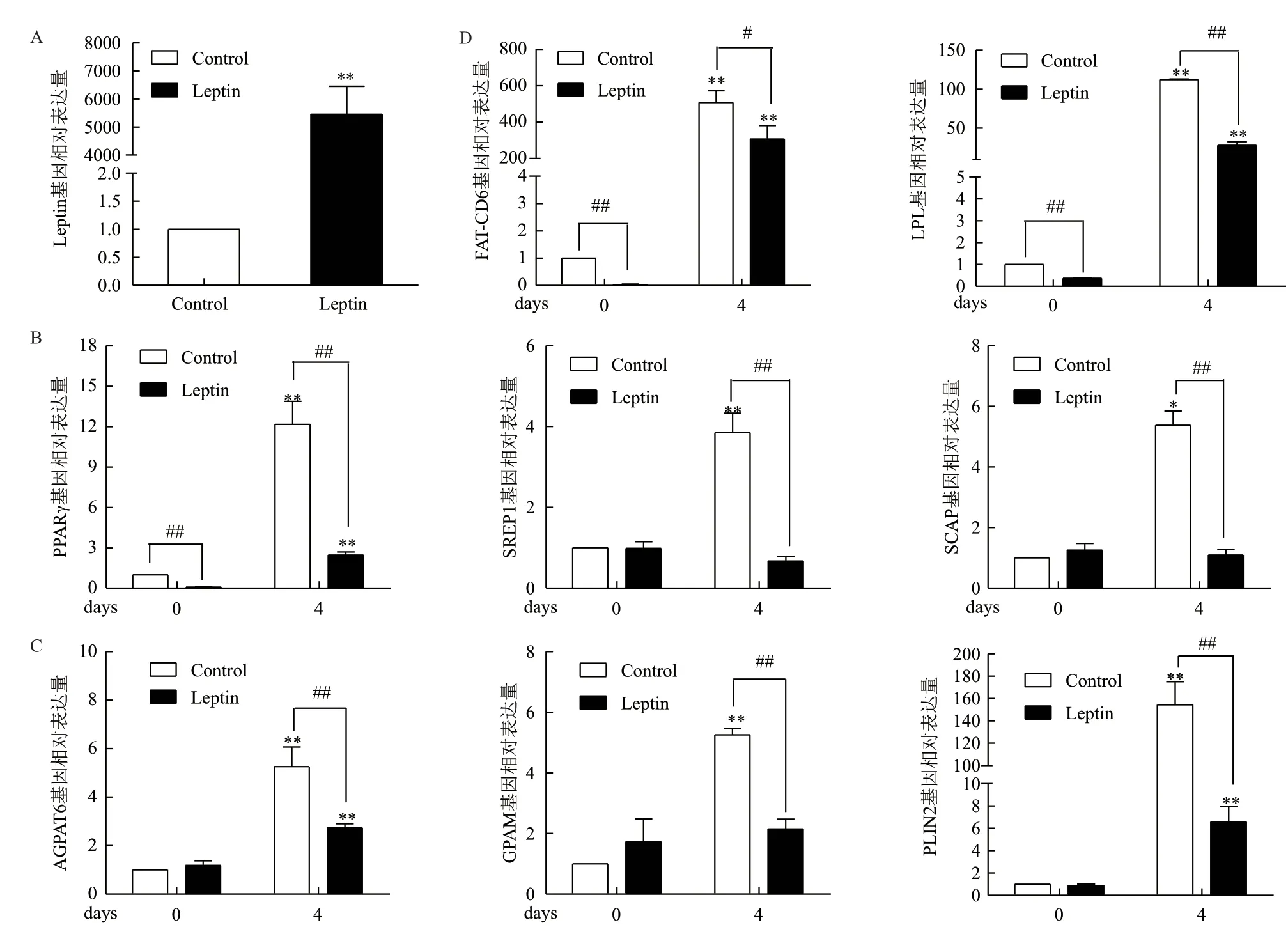
图3 Leptin过表达猪前脂肪细胞和野生型猪前脂肪细胞诱导分化形成脂滴过程中脂质合成代谢相关基因mRNA的表达水平
4 结论
在猪前脂肪细胞诱导分化形成脂滴的过程中,Leptin可通过下调脂质合成相关基因的表达水平来抑制前脂肪细胞分化形成脂滴的进程,降低脂肪细胞中甘油三酯的合成,从而在一定程度上降低动物机体内脂质合成的速率,进而降低动物机体内脂质的沉积,将为研究人类肥胖的发生发展过程及机制奠定理论基础。

