巨大芽孢杆菌ZS-3溶无机磷机制及其对樟树的促生作用
钱婷 叶建仁
(南方现代林业协同创新中心 南京林业大学林学院,南京 210037)
磷是构成有机化合物的重要组分之一,是限制作物产量的第二大营养要素。土壤中的磷绝大部分是以不能被植物直接利用的难溶性磷状态存在。为了提高作物产量,每年都要向土壤中施用磷肥,但是磷肥被施入土壤后,与土壤中的Ca2+、Al3+等离子作用形成难溶性磷酸盐,大部分磷肥又被固定在土壤中,以无效态储存起来,还会破坏土壤结构,导致土壤板结[1-2]。长期向土壤中施用化学磷肥并非长远之计。如何将土壤中难溶磷转化成植物可以吸收利用的有效态磷已经成为当前研究的热点。
在土壤中存在着广泛可供利用的溶磷微生物,它们能够将土壤中的难溶性磷转化为可溶性磷,供给植物有效的磷素[3]。溶磷微生物种类丰富,据不完全统计,全世界目前已经筛选出36属89种溶磷微生物[4-5],其中芽孢杆菌属是研究最广泛、最深入的溶磷微生物之一,而巨大芽孢杆菌作为解磷促生菌,也有一百多年的研究历史,它不仅能够分解土壤中难溶性磷,提高土壤速效磷含量,还能与解钾菌、固氮菌互作,增强固氮解钾能力[6-7]。20世纪80年代以后,我国也相继研发出了多种芽孢杆菌组成的复合解磷菌剂,但由于溶磷微生物的施用条件不清楚、作用机制不明确、遗传稳定性差等问题,这些菌剂的田间施用效果并不理想,从而大大限制了溶磷微生物的应用[8]。
我国对溶磷微生物的研究虽然已有一段时间,但发展不快,主要原因是溶磷微生物种类繁多,溶磷机制多样且复杂,最常见的两种观点是酶解学说和酸解学说,即溶磷微生物在代谢过程中能够分泌磷酸酶和有机酸,使土壤中难溶性磷转化为可供植物吸收利用的有效磷[9-11]。已有的研究表明不同菌株之间溶磷机制存在差异,同一菌株在不同条件下溶磷机制也不尽相同,所以需要探索溶磷微生物溶磷机制,为创造出安全、繁殖快、溶磷能力强的多功能菌株提供理论支持,从而促进溶磷微生物的生产与应用[12-13]。
本实验室前期从樟树枝干上筛选出一株具有溶磷功能的细菌ZS-3,经鉴定为巨大芽孢杆菌(B.megaterium),本研究针对该菌株从其溶无机磷特性出发,分析其溶磷的机理,探究菌株对樟树生长及土壤理化因子的影响,旨为提高菌株对难溶性磷源的利用效率和开发溶磷微生物肥料等提供依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株和植物 供试菌株为巨大芽孢杆菌ZS-3菌株,保存于南京林业大学森林病理学实验室;供试植物为一年生樟树苗,来自广西桂林市。
1.1.2 培养基 (1)LB培养基(g/L):胰蛋白胨10.0,酵 母 浸 粉5.0,NaCl 10.0,pH 7.2-7.4。(2)NBPIP培养基(g/L):葡萄糖10.0,Ca3(PO4)25.0,MgCl25.0,MgSO4·7H2O 0.25,KCl 0.2,(NH4)2SO40.1。
1.1.3 供试土壤 本实验选择2种不同类型的土壤,徐州土壤采自江苏省徐州市沛县天悦山庄,南京土壤采自南京林业大学北大山,在南京林业大学土壤测试实验室分析了土壤理化性质(表1)。
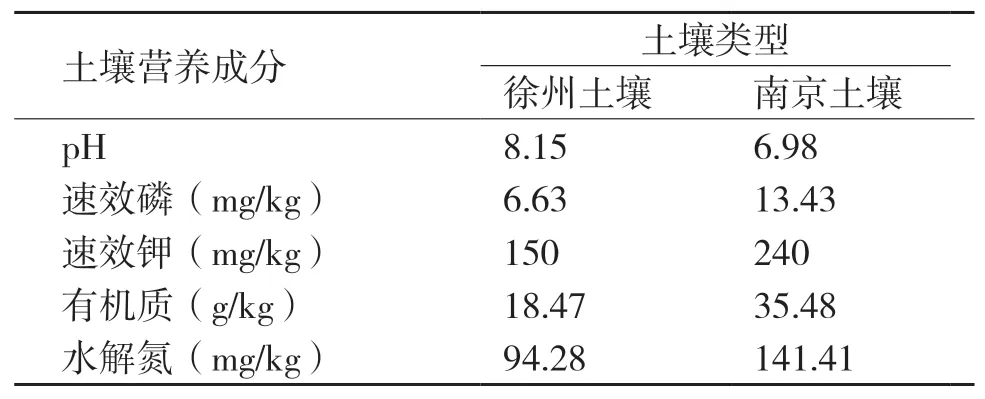
表1 原始土壤各项理化性质
1.2 方法
1.2.1 溶磷能力测定 在LB培养基中接种供试菌株,28℃,200 r/min摇培18 h后制成种子液。种子液以1%接种量(体积比)接种于50 mL NBRIP培养基中,以接相同体积LB培养基的NBRIP培养基为对照,28℃、200 r/min培养,每隔24 h经4℃、12 000 r/min离心10 min取5.0 mL发酵液,设3个重复。采用钼锑抗比色法测定上清液中可溶性磷的含量[14]。采用pH计测定发酵液pH。采用酸碱滴定法测定可滴定酸度[15]。每隔24 h采用平板稀释涂布法测定NBRIP培养基中的菌体含量。
1.2.2 菌株ZS-3对Ca3(PO4)2表面形态破坏作用的测定 在LB培养基中接种供试菌株制成种子液,以1%接种量(体积比)接种到装有50 mL NBRIP培养基的100 mL三角瓶中,以接相同体积LB培养基的NBRIP培养基为对照,28℃、200 r/min培养7 d。用滤纸过滤的方式回收摇瓶中的Ca3(PO4)2粉末,于烘箱中40℃烘干,将完全干燥的样品离子溅射喷金,采用扫描电镜对Ca3(PO4)2粉末表面进行观察。
1.2.3 磷酸酶活性测定 在LB培养基中接种供试菌株制成种子液,以1%接种量(体积比)接种到装有50 mL NBRIP培养基的100 mL三角瓶中,以接相同体积LB培养基的NBRIP培养基为对照。设3个重复,28℃、200 r/min培养,取发酵液12 000 r/min离心10 min,细胞内、细胞膜、细胞外酶活性参照李冠喜方法提取测定[16]。
1.2.4 有机酸测定 活化好的种子液以1%接种量(体积比)接种于装有50 mL NBRIP培养基的100 mL三角瓶中,以接相同体积LB培养基的NBRIP培养基为对照,28℃、200 r/min振荡培养4 d后,发酵液经4℃、12 000 r/min离心10 min,过0.22 μm孔径滤膜,采用高效液相色谱测定发酵液中有机酸的种类和含量,设3个重复。色谱条件为:色谱柱为安捷伦InfinityLab Poroshell 120 SB-C8,4.6 mm×100 mm,2.7 μm,流动相为0.02 mol/L NH4H2PO4-H3PO4(pH 2.9),流速0.4 mL/min,柱温30℃,检测波长210 nm。有机酸标准样品:草酸、葡萄糖酸、酒石酸、α-酮戊二酸、苹果酸、甲酸、乳酸、乙酸、柠檬酸、琥珀酸和富马酸。
1.2.5 盆栽实验 挑取菌株ZS-3单菌落于LB液体培养基中,28℃、200 r/min振荡培养18 h后,6 000 r/min,15 min离心收集菌体,用无菌水清洗菌体3次,将细菌悬浮液浓度调至1×108CFU/mL。将生长一致的樟树苗移栽到装有徐州土壤和南京土壤的花盆中,每盆种植1株樟树苗,每盆装入土壤500.0 g,每盆浇入上述供试菌株ZS-3的细菌悬浮液50.0 mL,空白对照接种等量无菌水,处理分别为XCK(徐州土壤,不施菌)、X+ZS-3(徐州土壤,施菌)、NCK(南京土壤,不施菌)、N+ZS-3(南京土壤,施菌)。每个处理设15个重复。盆栽期间各组处理其他管理措施均一致,适当浇灌水,30、60、90 d后测定各类指标。樟树叶片用H2SO4-H2O2法消煮,钼锑抗比色法测定全磷含量,土壤pH采用pH计测定,土壤有效磷含量采用NaHCO3浸提-钼锑抗比色法测定[17]。
1.2.6 数据分析 使用Origin 2017和SPSS 21.0统计软件进行数据处理与分析,采用Duncan’s新复极差法进行比较。
2 结果
2.1 巨大芽孢杆菌ZS-3菌株的溶磷能力
分析结果(图1-A)表明,菌株ZS-3在培养的168 h期间,溶磷量呈现出先升高后下降的趋势,在培养初期约24 h后溶磷量明显增长,达109 μg/mL,在96 h时达到最大值188 μg/mL,然后呈缓慢下降趋势,168 h后溶磷量为168 μg/mL。菌株在NBRIP培养基中的生长结果表明,菌株ZS-3从接种到96 h一直持续增长,菌体含量最大2.34×109CFU/mL。由图1-B可以看出,在菌株培养过程中,前24 h内pH下降速度最快,从8.06降到5.14,此后呈缓慢下降趋势。培养基的pH与菌株溶磷量呈负相关。可滴定酸度呈缓慢上升趋势,72 h时可滴定酸度值最大,达26.07 mmol/L。
2.2 Ca3(PO4)2表面形态的观察
由图2可知,未经菌株ZS-3作用的Ca3(PO4)2(图2-A)表面较光滑平整,边缘规则,棱角分明。菌 株ZS-3与Ca3(PO4)2作 用7 d后(图2-B),Ca3(PO4)2表面变得凸凹不平,棱角模糊,并且Ca3(PO4)2表面的薄层有脱落的趋势。由此可知,菌株ZS-3对Ca3(PO4)2有明显的溶蚀作用。
2.3 巨大芽孢杆菌ZS-3菌株的磷酸酶活性
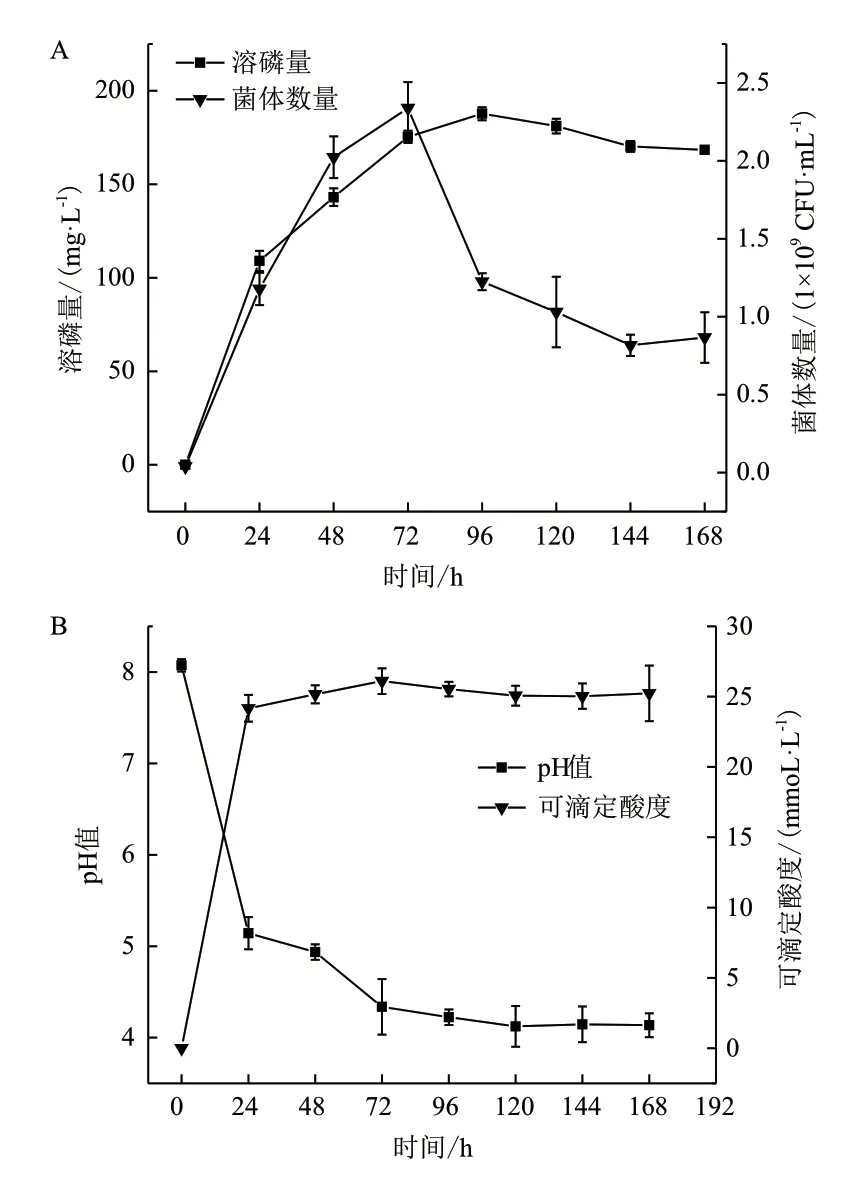
图1 168 h内菌株ZS-3溶磷动力学

图2 溶磷菌ZS-3发酵液对Ca3(PO4)2表面的溶蚀作用
酸酶活性测定结果(图3)表明,菌株ZS-3既可以产生酸性磷酸酶,也能产生碱性磷酸酶,这2种酶在细胞内、细胞膜和细胞外均有分布。其中细胞外酶分别为125.72 μmol/(L·h)和125.51 μmol/(L·h),细胞内次之,酶活为72.59 μmol/(L·h)和84.49 μmol/(L·h),细胞膜上的磷酸酶活性最低,分别为44.21 μmol/(L·h)和52.66 μmol/(L·h)。因此,可以确定菌株ZS-3的酸性磷酸酶和碱性磷酸酶主要定位于细胞外,即主要是通过分泌到胞外以达到溶解难溶性磷源的目的。
2.4 巨大芽孢杆菌ZS-3菌株产生有机酸的能力
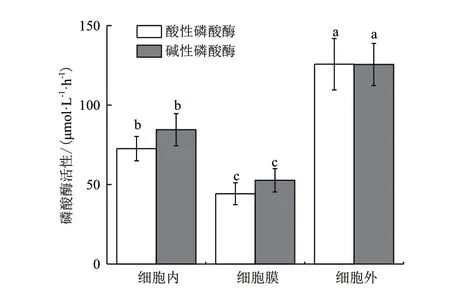
图3 巨大芽孢杆菌ZS-3磷酸酶活性测定
由测定结果(表2)可知,菌株ZS-3在NBRIP培养基中总有机酸分泌量达838.05 ng/μL,其中以分泌乙酸和甲酸为主,含量分别为484.12 ng/μL和255.1 ng/μL;其次是苹果酸、柠檬酸和酒石酸,以及微量的富马酸、α-酮戊二酸、乳酸和琥珀酸,菌株ZS-3在该培养条件下不产生葡萄糖酸。可见在磷胁迫下,菌株ZS-3可通过产生有机酸来溶解难溶性磷以达到溶磷效果,乙酸的大量产生在溶磷过程中发挥主要作用,推测乙酸产生是该菌株溶无机磷的一个重要机制。
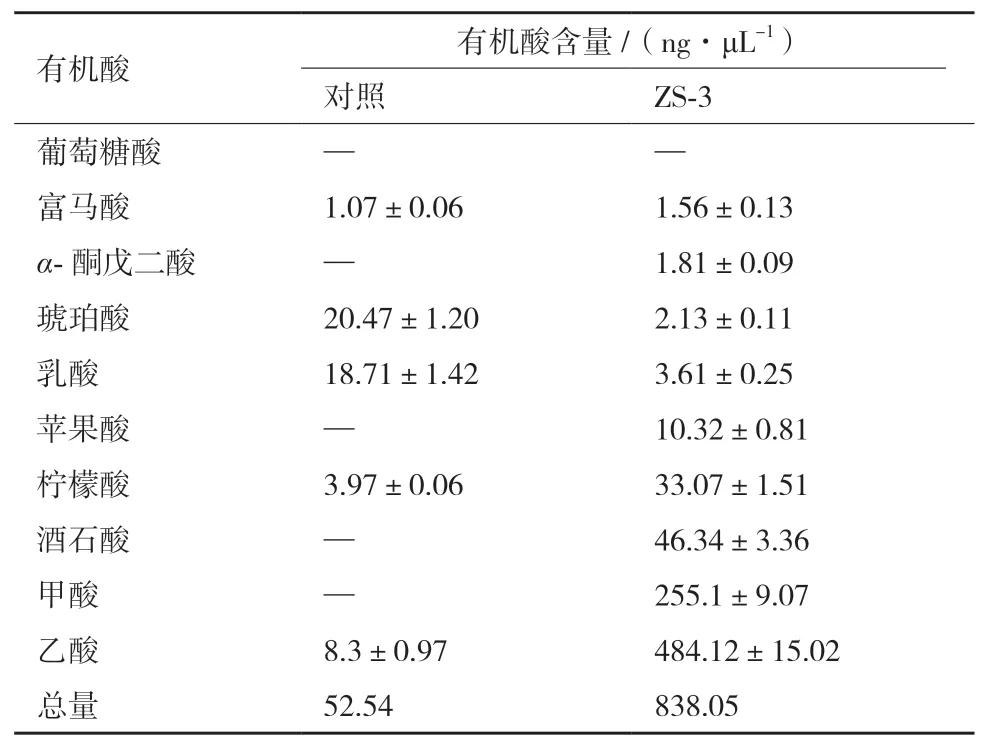
表2 菌株ZS-3在培养基中分泌的有机酸
2.5 菌株ZS-3对樟树生长及土壤理化性质的影响
从表3可看出,2种土壤栽种的樟树苗施菌处理后各项生长指标均有改善。徐州土壤和南京土壤接种樟树苗施菌处理后株高增长率和地径增长率都高于各自对照组,但菌株ZS-3对两种土壤栽种的樟树促生长作用存在一定差异,徐州土壤施菌处理组樟树的促生作用更为明显,优于南京土壤施菌处理组且差异显著。施菌组樟树叶片全磷含量也均有增加,徐州土壤施菌组叶片全磷含量与对照组相比提高了40.63%,存在显著性差异,南京土壤施菌处理后全磷含量高出对照19.9%,但差异不显著。
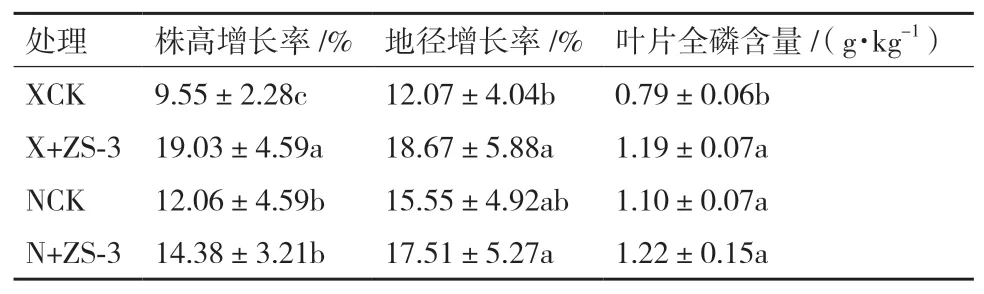
表3 接种菌株ZS-3对樟树生长指标的影响
由图4-A可知施菌处理对2种土壤pH影响不同。徐州土壤初始pH为8.15,施菌处理后土壤pH降低,尤其是施菌30 d后,土壤pH从8.11降至7.78,差异显著。南京土壤施菌组pH总体呈上升趋势,在接菌处理30 d、60 d和90 d后pH均高于对照。
施菌处理后樟树根际土壤速效磷含量与各自CK比较有提高(图4-B)。施菌30 d后,徐州土壤速效磷含量从6.72 mg/kg增加到10.29 mg/kg,提高了53.12%,南京土壤施菌组速效磷含量从12.85 mg/kg增加到13.51 mg/kg,提高了5.22%,随着栽培时间的延长,各处理根际土壤速效磷的含量普遍下降,但仍高于对照,90 d后徐州土壤施菌组与南京土壤施菌组速效磷含量无显著性差异。
3 讨论
本研究采用液体培养法测定巨大芽孢杆菌ZS-3对无机磷源的溶解能力,结果表明菌株ZS-3最高溶磷量为188 μg/mL,高于大部分已报道的溶磷细菌在相同条件下溶磷能力。例如,Pandey等[18]获得的铜绿假单胞菌(Pseudomonas aeruginosa)AU-3溶无机磷能力为87.34 mg/L,程园园等[19]分离的巨大芽孢杆菌WXD3-1溶解Ca3(PO4)2的量最高为93.20 mg/L,Pradhan等[20]从酸性土壤中分离到一株洋葱伯克霍尔德菌(Burkholderia cepacia)KHD08,其溶解无机磷能力达115.5 mg/L。因此,菌株ZS-3是一株高效溶磷菌,为微生物磷肥料的制备提供了材料,其应用前景十分广泛。菌株ZS-3在液体培养基中的有效磷含量呈现先上升后下降的趋势,且在第4天时有效磷含量达到最大值,该结果与薛应钰等[21]测定菌株P-1407溶磷能力、Behera等[22]分析菌株PSB-26溶磷特性的结果一致,其原因可能是随着培养时间的延长,培养基里的营养物质被逐渐消耗,限制菌体活动和有机酸的产生,其次培养基中已有的可溶性磷含量会抑制对Ca3(PO4)2的进一步溶解,因此一定时间后发酵液中可溶性磷含量不再增加。
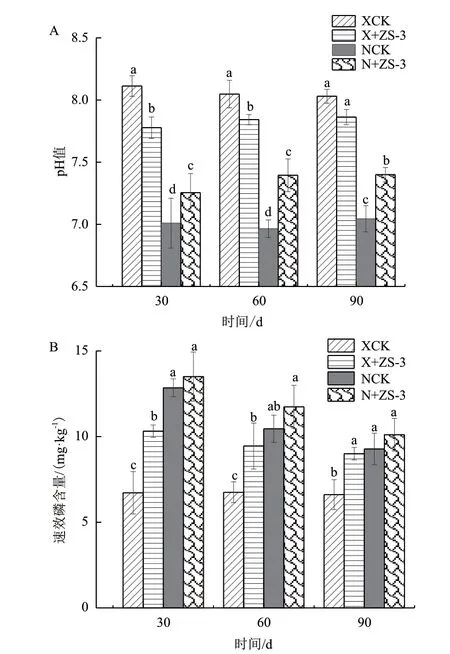
图4 施菌处理对樟树根际土壤pH和速效磷含量的影响
目前被人们广泛接受的微生物溶磷机理主要有2种方式,一是酸解作用,溶磷微生物在代谢过程中能够分泌有机酸,既能降低培养基pH,使难溶性磷在酸性条件下溶解,又能与Ca2+、Fe3+、Al3+等金属离子发生螯合反应,将PO43-释放出来[23-24]。二是酶解作用,即溶磷微生物会产生磷酸酶、植酸酶、核酸酶等[25-26]。从实验结果可以看出菌株ZS-3在细胞内、细胞膜和细胞外均有分布酸性磷酸酶和碱性磷酸酶,但酶活活性较低。卫星等[27]研究巨大芽孢杆菌NCT-2溶磷机制时发现,该菌株以Ca3(PO4)2为磷源酸性磷酸酶和碱性磷酸酶活性都很低,钟传青等[28]发现巨大芽孢杆菌P17溶解有机磷源时产生的磷酸酶活性显著高于溶解无机磷产生的酶活,说明巨大芽孢杆菌溶解无机磷并不主要依赖于磷酸酶。在培养过程中pH显著降低,培养液中可溶性磷含量显著增加,这表明菌株ZS-3产生了酸类物质达到溶磷目的,此研究结果与许多报道一致。任友花等[29]研究巨大芽孢杆菌11433-D溶磷机理时,发现有机酸的产生促进了溶磷量提高且使发酵液pH降低,主要有机酸为乙酸、葡萄糖酸、丙酸。吴海燕等[30]从缺磷黑土中分离到1株溶磷巨大芽孢杆菌,主要通过分泌葡萄糖酸溶解无机磷。本研究初步确定菌株ZS-3在溶磷过程中总有机酸分泌量达838.05 ng/μL,其中以分泌乙酸为主,与刘文干等[31]、萧龙珍等[32]研究一致,即乙酸含量的高低可能是决定溶磷量高低的重要因素。关于乙酸与菌株ZS-3溶磷能力的关系仍需要进一步研究。
已有的研究表明,溶磷菌能否将土壤中的难溶性磷释放成可溶性磷不仅取决于菌株溶磷能力的强弱,也与供试土壤理化性质有关,低水平的可溶性磷酸盐会诱导溶磷菌产生溶磷作用,而在高水平外源可溶性磷酸盐作用下则会被抑制[33-34]。故本实验首次选用2种类型的土壤进行盆栽实验,徐州土壤为碱性缺磷土壤,以难溶性钙磷为主,南京土壤为中性土壤,土壤速效磷含量高。实验结果表明施加菌株ZS-3后徐州土壤pH显著下降,主要是因为在磷胁迫下诱导菌株ZS-3分泌多种有机酸,在一定程度上降低徐州土壤的酸碱度,这一结果与前期室内实验结果相一致,菌株在无机磷培养基中摇培一定时间后产生有机酸导致pH下降。而南京土壤速效磷含量高,菌株在代谢过程中多产生蛋白质和脂类等碱性物质,故土壤pH上升。2种土壤施菌组的速效磷含量均高于对照且徐州土壤速效磷含量增长量更显著,徐州土壤是低磷土壤,低水平的可溶性磷酸盐更利于菌株ZS-3发挥作用,诱导菌株在代谢过程中产生了酸性物质、生长素等物质,提高了土壤根系速效磷和多种酶活活性。因此,对樟树促生作用也更加显著,这一实验结果为菌株ZS-3的施用范围提供了一些理论性支持。
溶磷微生物作为生物肥料,生产成本低,施用后不仅能提高土壤中速效磷含量,促进植物生长,还能改良盐碱地,改善土壤结构,对保持生态环境平衡具有重要意义[35-37]。本研究以Ca3(PO4)2为磷源,揭示了菌株ZS-3溶无机磷特性,探索其溶磷机制,为创造出安全、溶磷能力强的多功能菌株提供理论支持。在后续实验中,笔者将对菌株ZS-3的发酵工艺以及菌肥复配等方面做进一步研究,为其在肥料应用中的推广进行深入探索。
4 结论
巨大芽孢杆菌ZS-3在无机磷液体培养基中,最高溶磷量为188 μg/mL,菌体数量最大达2.34×109CFU/mL,pH从8.06降至5.14,可滴定酸度呈缓慢上升趋势。ZS-3与Ca3(PO4)2作用后能使其表面变得凸凹不平。ZS-3在溶磷过程中分泌酸性磷酸酶、碱性磷酸酶和大量有机酸。施菌处理对2种不同类型土壤栽种的樟树都具有促生作用,土壤速效磷含量均提高且缺磷土壤中速效磷含量增长量更显著。

