高通量测序技术解析中学校园细菌群落的特征组成
黄婷 方源 冯舟 沈和 聂勇 郑鑫 汪家权 许子牧
(1. 合肥工业大学资源与环境工程学院,合肥 230009;2. 北京大学工学院,北京 100871;3. 北京师范大学附属实验中学,北京 100032)
生存场所中的各种致病或条件致病微生物的污染给人类的健康带来威胁[1]。在诸多环境中,校园是一个包含有多种场所的特殊环境,是青少年接受课堂教育的主要场所,也是微生物传播和交流活跃的地方。所以,研究校园环境微生物的组成与功能、有助于了解青少年时期人体微生物组的发育规律,对青少年健康发育和流行疾病的防治具有重要意义。当前,校园环境微生物组学研究是全世界范围的热点之一,人们分别利用培养和免培养的方法对校园建筑物内的空气等方面进行研究。在我国,已报道的对校园环境微生物的研究主要集中于室内空气、教室教学设施、公用电脑等方面[2-5]。邓怡卿等[6]利用培养的方法,对上海师范大学教室内的课桌、手把和话筒上的微生物进行培养,结果显示课桌和话筒的细菌菌落较多,但未发现致病菌。陈宏伟[7]对校园内图书馆自习厅、学生教室、食堂、男女寝室等场所的样品进行微生物培养,结果显示各场所空气微生物污染数量随人员的密度活动量的增大而增大。然而,传统的可培养方费力且费时,可靠性也很差[8]。近年来,随着新一代测序技术的快速发展,可获得庞大的数据信息,通过现代生物信息学手段,获得微生物总体群落组成情况,具有高通量、价格低、运行周期短的优势,已被广泛应用于微生物群落结构研究[9-11]。总之,目前有限的校园环境研究,主要集中在以下几个方面:(1)大学校园多有研究,中小学校园中的研究还很缺乏;(2)对不同场所空气中微生物组成有研究,缺乏对建筑物场所表面微生物的研究。由于很多物质可能在表面的富集,表面上微生物的组成与空气中可能存在显著的差异;(3)利用可培养方法,对校园环境微生物组的认识不够深入。
为此,本研究以一所中学校园作为研究对象,收集校园内不同建筑物场所中楼梯扶手和门把手表面的微生物样品,通过高通量测序技术获得微生物群落结构信息,初步探究了校园建筑物的细菌群落组成和分布特征。
1 材料与方法
1.1 材料
采 样 缓 冲 液:0.15 mol/L NaCl,0.01%(V/V)Tween20(国药集团化学试剂北京有限公司),于121oC,20 min高压蒸汽灭菌,100 μL/管;一次性无菌采样植绒拭子(货号:5U018S.CN,COPAN公司);DNeasy Power Soil Kit(DNA提取试剂盒,货号12888-100,QIAGEN公司);E.Z.N.A.®Gel Extraction Kit凝胶回收试剂盒(OMEGA 公司);样品细菌16S rRNA基因V4区高通量测序由广东美格基因科技有限公司商业完成。
1.2 方法
1.2.1 样本采集 采样地点为北京市海淀区某中学校园内4个教学楼,2个实验楼,2个体育馆和4个食堂的门把手、扶梯等。本研究共取得12个样品。取样时将一次性无菌采样植绒拭子小心地从试管中旋出,用采样缓冲液将拭子润湿后,按一定方向旋转拭子擦拭采集物表面,平均采样面积50 cm2,擦拭时间2 min。采集完毕后将拭子放回试管于-20oC保存备用。
1.2.2 DNA提取与16S rRNA基因V4区高通量测序 将采样后的拭子放入含有缓冲溶液的离心管中搅拌30 s,然后将采集到的样品重悬至缓冲液中,然后利用QIAGEN的DNeasy Power Soil Kit试剂盒说明书的步骤提取样品中微生物总DNA。
利用不同的barcode标记的上游引物515F(5'-GTGYCAGCMGCCGCGGTAA-3')和 下 游 引 物806R(5'-GGACTACNVGGGTWTCTAAT-3')对细菌16S rRNA基因V4区进行 PCR 扩增。PCR反应体系(50 μL):2×Premix Taq 酶25 μL,10 mmol/L上游和下游引物各1 μL,20 ng/μL DNA模板3 μL,补ddH2O至 50 μL。PCR反应程序参数为:94℃ 5 min;94℃30 s,52℃ 30 s,72℃ 30 s,31个 循 环;72℃ 10 min;4℃ Hold。PCR完成后利用1%琼脂糖凝胶电泳检测扩增产物。利用GeneTools Analysis Software(Version4.03.05.0,SynGene)对PCR产物进行浓度对比后,按照等质量原则计算各样品所需体积,将各PCR产物进行混合;使用凝胶回收试剂盒回收PCR混合产物,TE缓冲液洗脱回收目标DNA片段。然后,样品送至广东美格基因科技有限公司,由其完成文库构建及Illumina HiSeq高通量测序。
1.2.3 数据处理与分析 将测序原始数据导入QIIME2[12]软件,利用软件中DADA2质量控制方法进行去噪,生成序列变体(Sequence variant,SV),选取代表性序列与数据库进行比对从而获得物种注释信息。基于物种注释信息,去除注释为叶绿体、线粒体以及不能注释为细菌的序列变体(SV)及其包含的序列。基于 SV的分析结果,进行样品微生物α多样性和β多样性分析,香农指数(Shannon)表示群落的多样性,其指数数值越大说明样本的多样性就越高。基于Unweighted-Unifrac距离和Weighted-Unifrac距离得到矩阵,运用R软件进行PCoA(主坐标分析,Principal co-ordinates analysis)分析,并结合置换多元方差分析(Permutational multivariate analysis of variance,PERMANOVA)去观察组间的差异性,其本质是基于F统计的方差分析,依据距离矩阵对总方差进行分解的非参数多元方差分析方法。一般以P<0.05 为显著,P< 0.01 为非常显著。
2 结果
2.1 数据质控与物种注释
将高通量测序得到的原始数据进行整理、过滤、分析后,19个样品获得了108万条有效序列,序列长度介于231 bp - 397 bp 之间,平均约为 253 bp。具体到样品,每个样品获得有效序列数为62 969-125 941条,大部分样品为70 000至100 000条,平均单个样品的序列数为89 724条在 100% 的序列相似性水平下,对样本进行聚类和注释,共得到3 036个SVs,归属于20个菌门,466个菌属。
2.2 不同场所微生物群落多样性分析
根据物种预测信息,分析表明:体育馆的物种丰富度最高(可观测SV数为414),其次是实验楼(可观测SV为255)和教学楼(可观测SV为223),最后是食堂(可观测SV为201)(图1-B)。与此类似的是,体育馆的Shannon指数也最高,其次是实验楼和教学楼,而食堂的Shannon指数也最低(图1-A)。为什么体育馆的物种丰富度最高而食堂的最低?究其原因,有如下几种可能:(1)该学校只有一个体育馆,到体育馆上课的学生数量大于其他10个样品对应学生数量;(2)在体育馆里的活动中,人体运动代谢产生产生更多的汗液、皮脂等等,为微生物生长和繁殖提供了营养物质条件。至于食堂中微生物相对丰度和多样性指数较低的原因,可能要归功于食堂中经常进行消毒灭菌。
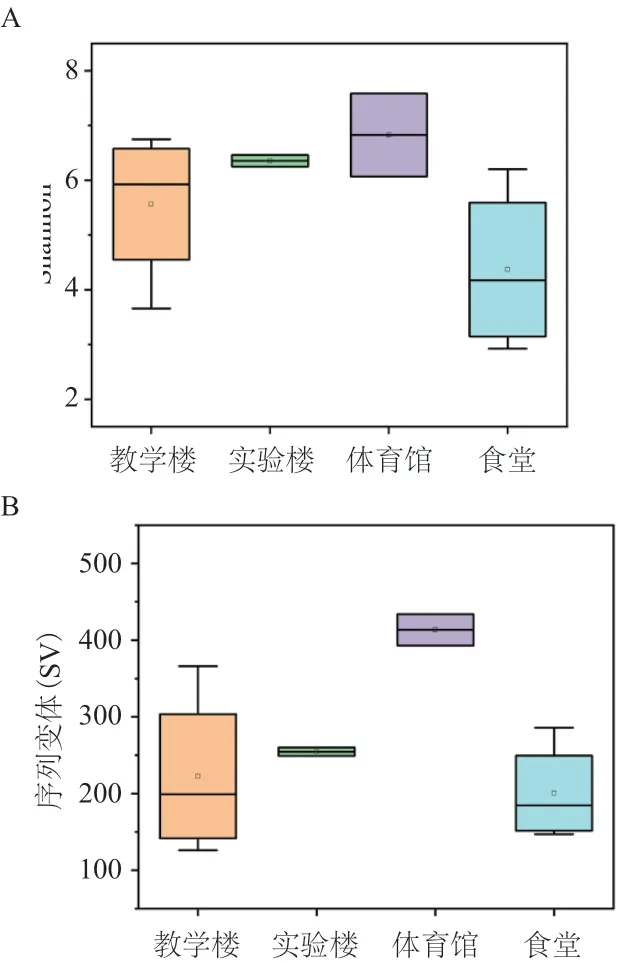
图1 不同场所样品的物种丰富度(SV)和α多样性分析-Shannon指数
依据上述SV的计算和预测,计算所有样本基 于SV的Unweighted-Unifrac距 离 和Weighted-Unifrac距离,进行主坐标(PCoA)分析,以图了解样品微生物群落的聚类情况和群落结构相似性。Weighted-Unifrac和Unweighted-Unifrac分析的区别在于Unweighted-Unifrac不考虑物种丰度。在PCoA图中,如果样本距离越接近,表示物种组成结构越相似。结果显示,各样品按照场所用途的不同在第一、二坐标上有明显区分。从Weighted-Unifrac分析(图2-A)和Unweighted-Unifrac分析(图2-B)结果,可以看出:来自于不同场所的样品微生物群落大体按照场所功能而聚类,例如食堂、实验楼、体育馆、教室楼样品中微生物群落基本各自聚在一起。进一步利用PERMANOVA相似性分析,结果表明教学区域与食堂之间存在显著差异,其中Weighted-Unifrac距离下P= 0.017,Unweighted-Unifrac距离下P= 0.006。
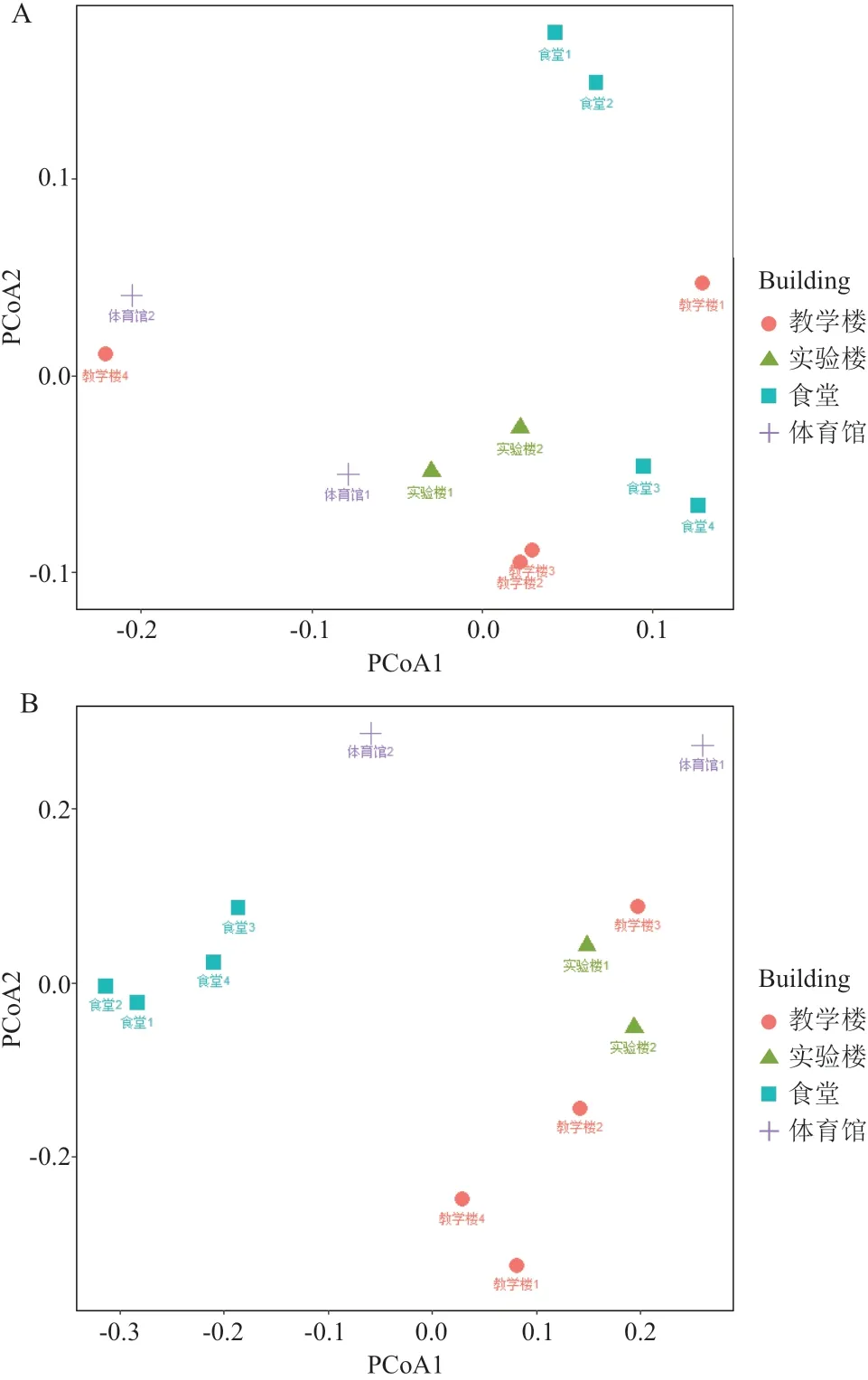
图2 用Unweighted-Unifrac距离和Weighted-Unifrac距离计算的PCoA图
2.3 不同场所微生物群落组成特征与变化
各样品基于门水平的细菌组成分布见图3-A。所有样品共检测到20个门,其中变形菌门(Proteobacteria,丰度范围19.73%-90.40%),厚壁菌门(Firmicutes,丰度范围1.67%-56.19%)和放线菌门(Actinobacteria,丰度范围0.83%-16.88%)的相对丰度较高。各场所之间的物种组成相似,但微生物丰度有较大差异。其中变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)存在于所有建筑物场所,尤其是变形菌门(Proteobacteria)的物种丰富度占据绝对优势,在食堂3和食堂4中发现厚壁菌门(Firmicutes)的丰度显著高于其他场所样品。说明在校园各建筑物场所之间,由于人员流动,这些优势物种在接触过程中进行了交流。
在 属 水 平 上(图3-B),一 共 检 测 到466个 SV,相对丰度较高的SV主要属于栖水菌属(Enhydrobacter,丰度范围0.49%-56.26%),链球菌属(Streptococcus,丰度范围0.36%-17.63%),葡萄球菌(Staphylococcus,丰度范围0.53%-11.26%)等。相较于门水平上微生物群落差异不显著,各样品在属水平的物种分布呈现出较大的个体差异,如教学楼相对丰度前5的菌属有异球藻科(Xenococcaceae),链球菌属(Streptococcus),栖水菌属(Enhydrobacter),葡萄球菌(Staphylococcus),甲基杆菌属(Methylobacterium)。实验楼相对丰度前5的菌属有栖水菌属,葡萄球菌,马赛菌属(Massilia),副球菌属(Paracoccus),棒状杆菌属(Corynebacterium)。体育馆相对丰度前5的菌属有异球藻科,马赛菌属,微红微菌属(Rubellimicrobium),小双孢菌属(Microbispora),副球菌属(Paracoccus)。食堂相对丰度前5的菌属有栖水菌属,气球菌属(Aerococcus),链球菌属,不动杆菌属(Acinetobacter),葡萄球菌。在各场所相对丰度前5的菌属中发现教学楼独有的优势菌属有甲基杆菌属,实验楼独有的优势菌属有棒状杆菌属,体育馆的优势菌属有微红微菌属和小双孢菌属,食堂的优势菌属栖水菌属,气球菌属。Venn 图分析结果表明,在属水平下,4种用途的建筑物中有 94个共有菌属,教学楼、实验室、体育馆和食堂各自独有的菌属分别为 47 个、28个、88 个和 43 个(图4-A)。可以看出体育馆扶手表面的微生物物种多样性显著高于其他3个场所设施表面微生物。各场所内部样品的Venn 图反映了建筑物内部的相似菌属与各自独有的菌属(图4-B-E)。
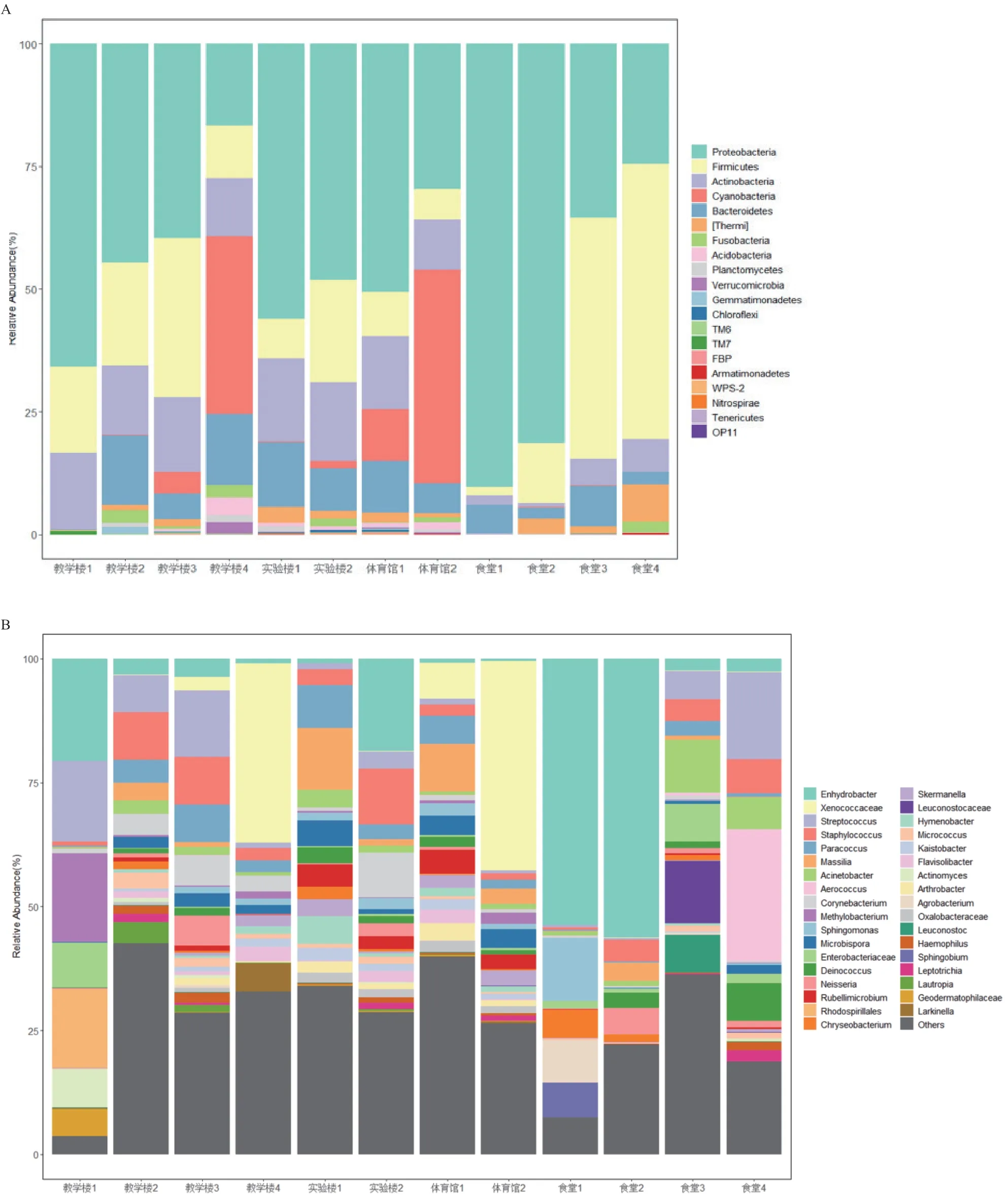
图3 各样品基于门与属水平的细菌组成
虽然在不同组别样品中都发现栖水菌属,但在小食堂中其丰度显著高于其他组的样品。并发现大食堂样品中气球菌属为优势菌属,而在其他场所中并未发现有此情况。推测这与大食堂供应的菜品有关,蔬菜肉类等会携带某些菌群,在接触过程中导致细菌发生交流,从而在大食堂内占据较高丰度。
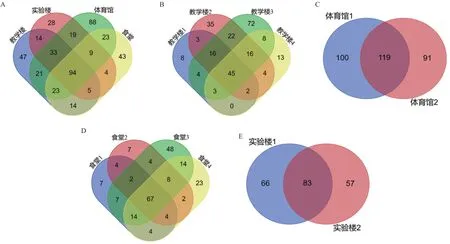
图4 各建筑物场所属水平下Venn图
3 讨论
本研究采用高通量测序的方法研究了校园内不同场所中微生物群落的组成特征。发现校园细菌群落的分布具有按场所用途进行区分的特征。体育馆的物种丰富度显著高于其他场所,而食堂的Shannon指数显著低于其他场所。体育馆是青少年运动的场所,运动过程中产生的汗液和丰富的皮脂给微生物提供了生长发育的有利条件。食堂作为饮食场所,消毒和卫生应是各场所之间最为严格的,这也是导致其微生物的多样性较低的原因。其次,教学活动频繁的区域越有可能更容易发生物种的交流,集体教学活动可能是影响校园建筑物微生物群落特征的主要原因。密集的人员活动会增加微生物的传播几率,从而提高公共区域微生物的多样性与稳定性。
物种群落组成结果表明,在门水平上,变形菌门,厚壁菌门和放线菌门构成样品微生物群落的主要微生物,这些微生物在其他场所环境中也广泛分布,是不同场所设施表面主要的微生物组成[13]。不同功能区微生物群落特征和丰度分布有显著差异,最为优势的变形菌门相对丰度为食堂>实验室>教学楼>体育馆。在属水平上,栖水菌属,链球菌属,葡萄球菌构成样品微生物群落的主要微生物[14]。有报道指出在前臂、手等部位这些微生物种类相对丰富[15-16],说明这些物种通过人手部的接触在各场所设施表面之间进行了交流,导致在各场所之间广泛分布。葡萄菌属是报道中的绝对优势菌属[17],且葡萄球菌属的部分菌株是引起人类化脓性感染的常见病原菌[18]。甲基杆菌属(Methylobacterium)分离于土壤、尘土、淡水、湖泥、叶表等环境[19]。此类菌属在初一1-2层扶梯出现较多,可能是学生在室外活动回教室的过程中没有洗手,在上楼过程中与楼梯扶手产生接触使该菌属产生交换。棒状杆菌属(Corynebacterium)寄生于人鼻腔、咽喉、眼结膜和皮肤等处,当人体抵抗力下降时,可引起化脓性感染、肺炎等疾病[20]。在空气细菌样品中发现甲基杆菌属,马赛菌属(Massilia),副球菌属(Paracoccus),微红微菌属(Rubellimicrobium)为优势菌属[21],这类菌属在体育馆样品中相对丰度较高,由于体育馆是相对封闭的空间,这类细菌在进入空气后由于环境适宜,学生活动又产生汗液等营养物质给这类菌提供了良好的生存环境。小食堂出现最多的栖水菌属是人体皮肤中的优势菌属[22],且在鱼类等水产中分布较广[23],可能由于小食堂供给鱼类等水产食物时,厨师直接与食物接触后又触碰其他物品,通过人员流动,手触碰餐具、桌椅、把手等公共物品时,手部微生物与物体表面微生物进行交流,导致小食堂内该菌属微生物丰度最高。在大食堂发现的气球菌属,该菌广泛分布于空气、腌肉的盐水及蔬菜等上[24],而食堂正是蔬菜肉类等食物的供应场所。不动杆菌属(Acinetobacter)广泛分布于自然界和人体的皮肤表面[25-26],常可引起肺炎脑膜炎、菌血症等各种难治性感染[27]。因此,在学校的日常教学活动和饮食生活中,学校要加强对校园公共区域卫生的管理,对学生做好卫生教育和知识普及,养成良好的卫生习惯,从而降低流行性疾病的传播几率。
4 结论
本研究主要研究中学校园不同场所的微生物群落构成,发现微生物群落构成与场所功能相关。本研究仅在不同场所设施表面进行了采样,分析其群落结构和多样性,但对于不同时间段各点的微生物群落特征并未做进一步研究,下一步有待完善不同时间点各场所微生物群落的结构和多样性,进而为校园卫生安全提供更有利的依据。

