癌症中microRNAs和表观遗传之间的相互调控作用
唐德平 姚慧慧 唐金舟 毛爱红
(1. 兰州交通大学化学与生物工程学院,兰州 730070;2. 甘肃省医学科学研究院,兰州 730050)
癌症是由遗传改变和/或表观遗传改变导致的基因表达和功能异常发展而来。早期癌症研究多聚焦于肿瘤发生过程中的基因改变,如突变、基因重排和拷贝数变异等,找出癌症的“标签”。然而,随着microRNA(miRNA)和表观遗传学的快速发展,越来越多的研究证明表观遗传改变,如DNA甲基化、组蛋白修饰、异常miRNA表达也参与调控癌症的发生过程。事实上,miRNA和表观遗传标记已被确定为调控致癌/抑癌基因表达的关键因子。重要的是,表观遗传改变和miRNA异常表达会相互影响:染色质表观遗传改变导致miRNA在癌症中的表达异常,异常表达的miRNA通过靶向调控表观遗传修饰的关键酶影响染色质重塑,miRNA和染色质重塑信号通路相互关联,互相调节。令人感兴趣的是,表观遗传改变是可逆的,抑制或逆转表观遗传改变具有良好的临床应用前景。
1 表观遗传
表观遗传是研究DNA序列没有发生改变的情况,由于化学修饰等原因导致基因表达和染色质结构发生可遗传的改变。表观遗传改变包括所有与DNA序列改变无关的、可遗传的基因表达变化,涉及染色质重塑的多个过程。到目前为止,大量的表观遗传特征被确定,包括DNA甲基化、组蛋白修饰、非编码RNA、核小体重塑和组蛋白变体等。一般认为异常的表观遗传修饰启动关键的致癌途径,促进肿瘤的发生发展,是癌症发病的关键决定因素之一。本文重点讨论癌症中DNA甲基化和组蛋白修饰与miRNA的相互调控关系。
1.1 DNA甲基化
DNA甲基化是目前细胞生物学领域研究最深入的表观遗传现象。主要发生在CpG岛区域。DNA甲基化是由DNA甲基转移酶(DNA methyltransferase,DNMTs)催化未甲基化的DNA甲基化和/或维持甲基化序列的甲基化。DNMT3A和DNMT3B负责DNA从头甲基化,而DNMT1则在DNMT3A和DNMT3B的辅助下,负责DNA维持甲基化。正常细胞中维持正确的DNA甲基化模式是必须的,有助于基因组印记和X染色体失活的建立。异常的DNA甲基化模式与多种疾病密切相关,如乳腺癌中的BRCA1(Breast Cancer 1,BRCA1)和结肠癌中的MLH1(MutL Homolog 1,MLH1)超甲基化,胰腺癌中的MASPIN(Mammary serine protease inhibitor,MASPIN)和多发性硬化中的PADI2(Peptidylarginine Deiminases,PADIs)低甲基化[1]。有趣的是,在癌细胞中,DNA高甲基化沉默抑癌基因,而低甲基化激活致癌基因[2]。此外,异常DNA低甲基化也可导致DNA螺旋断点,最终造成杂合性丢失(Loss of heterozygosity,LOH)或异常染色体重组。DNA甲基化异常是人类癌症检测和治疗的一个重要指标[3]。
1.2 组蛋白修饰
组蛋白是一类含有球状域和带电-NH2末端尾巴的、构成核小体的基础蛋白。基因表达调控可通过组蛋白尾巴翻译后修饰发生,包括乙酰化、甲基化、磷酸化、泛素化、类泛素化和脯氨酸的异构体、ADP-核糖基化。这些修饰代表了存储在组蛋白中的表观遗传信息,又称为组蛋白密码,能够影响DNA与组蛋白及其他DNA结合蛋白复合物的相互作用,在基因表达调控中发挥重要作用。组蛋白修饰的异常是癌症中常见的现象[4]。
组蛋白乙酰化是基因转录的主要调控机制,通过调控组蛋白乙酰转移酶(Histone acetyltransferase,HATs)和组蛋白去乙酰化酶(Histone deacetylase,HDACs)活性进行相互平衡。组蛋白尾巴含有一些可被乙酰化的赖氨酸残基,如与转录活化相关的乙酰化位 点H3K9ac、H3K14ac、H3K18ac和H4K5ac(图1)。组蛋白乙酰化调控一系列功能,包括组蛋白与DNA结合,转录因子活性,亚细胞定位和蛋白质稳定性。另外,组蛋白乙酰化也可介导其它功能,如DNA修复(H4K8ac、H3K56ac)和染色质重塑(H4K16ac、H2BK12ac)[5]。除组蛋白外,其他各种参与转录、翻译、拼接、DNA修复、细胞周期进展、蛋白折叠、细胞骨架动力学、信号转导和新陈代谢的蛋白都对乙酰化敏感。
除组蛋白乙酰化外,组蛋白甲基化也与基因的转录激活和抑制相关。组蛋白甲基化是一类比乙酰化改变更为复杂的表观遗传标志[6]。首先,它作为组蛋白赖氨酸残基的单甲基化、二甲基化或三甲基化,及精氨酸残基的单甲基化和二甲基化存在。第二,特定残基甲基化水平决定了其表观遗传标记功 能。例 如,H3K4me3、H3K36me3、H3K79me3、H4R3me1和H4K20me1与基因转录激活有关;而H3K9me3和H3K27me3与基因沉默有关(图1)。第三,组蛋白甲基化标记分布和核小体定位是可变的,并依赖于基因组区域的功能和活性。例如,H3K4me3和H3K79me3在活性启动子更为突出,H3K4me1常见于增强子区域,而H4K20me1和H3K36me3则定位于活性转录基因的基因体。但最近的数据表明,单个的组蛋白改变不足以影响基因表达,它们以组合模式调节转录[7]。
虽然DNA甲基化标记相对稳定,但组蛋白修饰是动态的、不断变化的。特定组蛋白修饰之间相互影响,如H2B泛素化是H3K4me3甲基化所必需的。此外,一些研究表明,DNA甲基化和组蛋白修饰密切相互作用,调控基因表达,如DNA甲基化允许MeCP2(methyl-CpG-binding proteint 2,MeCP2)结合,然后再募集HDACs,通过染色质凝聚,进一步使基因转录失活(图1)。

图1 DNA甲基化和组蛋白修饰控制基因表达的示意图[8]
2 miRNAs
miRNAs是一类内源性、非编码小RNAs(约22 nt),在转录后水平调节基因表达。miRNAs通过与 靶mRNA的3'-UTR(3'-Untranlated Regions,3'-UTR)碱基完全或不完全配对,调节靶mRNA的稳定性或抑制靶mRNA翻译。一个miRNA可调节上百个基因表达,一个基因也可被多个miRNAs调节。miRNAs及其靶基因组成一个复杂的相互作用网络,几乎参与调控恶性肿瘤相关的所有过程,包括肿瘤细胞增殖、分化、凋亡、侵袭及转移。另外,miRNAs与肿瘤干细胞特征,上皮-间质转化(Epithelial-mesenchymal transition,EMT),肿瘤侵袭和转移,放/化疗治疗应答密切相关,具有应用到癌症临床诊断和治疗的前景。事实上,在几乎所有的人类癌症中,miRNA组(miRNoma)异常是癌症的一个标志,可以作为癌症分类、病理诊断及预后的标记物[9]。
目前已知,大约45%的miRNAs来自非编码RNA转录本,其他来自蛋白编码位点,主要由RNA聚合酶II转录。miRNA基因被转录为初级 转 录 本(pri-microRNA),然 后 由Drosha-like RNase III内切核酸酶或剪接体成分剪切,形成前体miRNA(pre-microRNA),pre-microRNA由Ran-GTP受体和Exportin-5从细胞核输出到细胞质。在细胞质中,通过Dicer切割pre-microRNA形成成熟的miRNAs。成熟miRNAs被整合到一个核糖核粒子(Ribonucleoprotein,RNP)中,形成RNA诱导的基因沉默复合物(RNA-induced silencing complex,RISC),在转录后抑制靶mRNA的活性(图2)。
尽管miRNAs不被认为是真正的表观遗传调控因子,但miRNAs与其它关键的表观遗传调控因子密切相关,可通过靶向调控表观遗传修饰的关键酶参与表观遗传调控。miRNAs不仅影响表观遗传,同时它们也受到表观遗传的调控。表观遗传和miRNAs之间存在一个相互作用的、复杂的基因表达调控网络。
3 表观遗传调控miRNA表达
表观遗传通过多种方式调控miRNAs生物合成和表达过程(图2)。已有大量证据表明,大多数参与癌症发生的miRNAs常位于基因组的脆性位点,且在卵巢癌、乳腺癌和黑色素瘤中得到证实;另外,癌症中异常表达的miRNAs也可能是由于miRNAs生成机器缺失,如DROSHA或DICER表达和功能改变,或转录因子活性的改变[10]。随着miRNA研究的深入,miRNAs基因组序列深度分析表明,大约一半的miRNAs启动子区与CpG岛相关,这表明miRNAs的生物合成可能受DNA甲基化的调控。
早期的研究发现,在HCC细胞系和原代人肝细胞癌,miR-1甲基化,而在DNMT-/- HCT116细胞低甲基化并被激活[11];而miR-124a是唯一在正常组织未甲基化,而在肿瘤组织中超甲基化且沉默的miRNA,在DNMT1和DNMT3b缺失的结直肠癌细胞中被诱导上调表达[12]。这说明,microRNA基因的甲基化调控由特定DNMTs实施。事实上,用DNMT抑制剂5-Aza-2'-脱氧胞苷处理不同的癌细胞,发现一些在癌细胞中沉默的miRNAs被诱导上调表达,如miR-127、miR-9、miR-148a、miRNA-129、miR-181c、miR-107、miR-200c/miR-141基因簇、miR-34和miR-29家 族[10,13]。这 些miRNAs的 异常超甲基化与癌细胞侵袭和转移相关。相反,一些具有致癌作用的miRNAs在人类癌症中表达上调,是由于DNA低甲基化而被激活。如肺癌中的let-7a-3[14]和卵巢癌中的miR-21[15]。通过DNA 超甲基化沉默抑癌基因或低甲基化激活癌基因,代表了癌细胞所使用的一种有利于生存、增殖和癌症进展的机制。
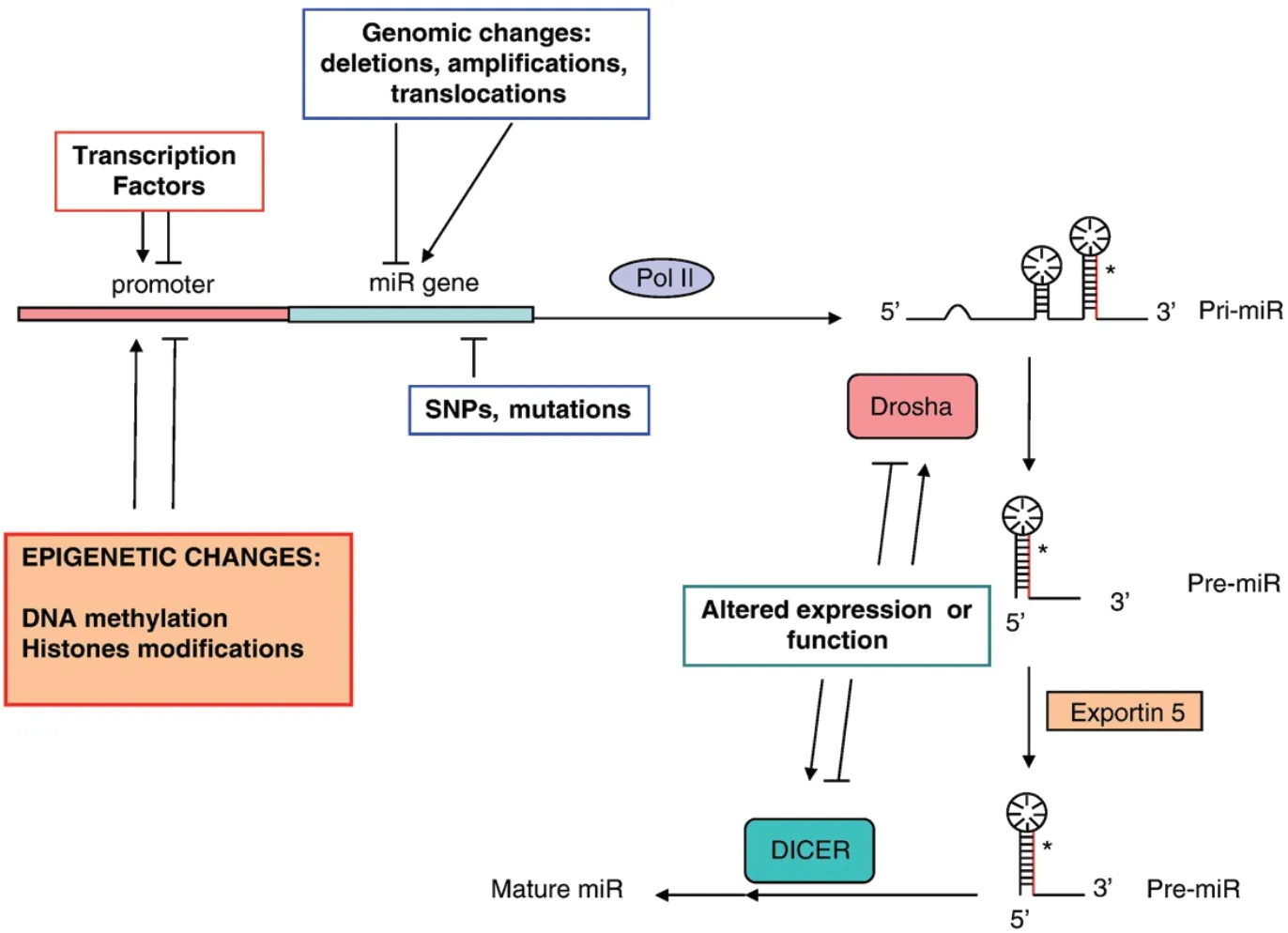
图2 miRNAs生物合成和表达过程受表观遗传调控[10]
启动子甲基化不是表观遗传影响miRNAs表达的唯一机制,组蛋白修饰在调控癌细胞miRNAs的表达中也发挥着关键作用。Scott等[16]研究表明,在SKBR3乳腺癌细胞中,抑制组蛋白脱乙酰酶活性导致miRNAs表达发生广泛而快速的变化。Vrba等[17]发现,转录激活修饰H3Ac和H3K4me3的缺失,和抑制性H3K9me2H3表观遗传标记的出现,导致miR-200c/141在乳腺癌细胞中低表达。另外,不同组织中58%的miRNAs通过启动子区H3K27me3沉默[18]。有趣的是,miR-29家族成员不但受组蛋白去乙酰化和三甲基化调控,而且还受DNA甲基化调控[19]。表明,一个miRNA可同时受到DNA甲基化和/或组蛋白修饰调控。
miRNAs和表观遗传之间的相互作用是复杂的,表观遗传能够调控miRNAs的表达,反过来,miRNAs也能够通过靶向调控DNA和组蛋白甲基化或乙酰化作用的关键酶,参与调控表观遗传。
4 miRNAs调控表观遗传
与表观遗传调控miRNAs的表达情况不同,miRNAs自身可调节表观遗传元件表达,形成一个严格控制的反馈机制,这些被称为“epi-miRNAs”的miRNAs异常表达,通常与癌症的发生或进展相关。既受表观遗传调控,又可调控表观遗传元件表达的miRNAs,如图3所示。
miR-29家族参与调控催化DNA甲基化的DNMT3A和3B的 活 性,是epi-miRNAs存 在 的 第一个证据。在肺癌中,miR-29家族成员直接与DNMT3A和3B的3'-UTR结 合,抑 制DNMT3A和3B的表达[20]。在肺癌中,高表达的DNMT3A和3B通过沉默抑癌基因促进肿瘤生长;抑制DNMTs表达导致DNA低甲基化和肿瘤抑制因子pI5(INK 4b)和ESR1的重新表达。随后,miR-29通过靶向DNMTs抑制肿瘤生长的作用在各种癌症中得到证实[19]。另外,miR-29b不仅能够直接与DNMT3A和3B结合,而且还能够通过其反式激活因子Sp1间接作用于DNMT1,高水平表达的miR-29b引起基因组DNA低甲基化,导致抑癌基因重新表达[21]。
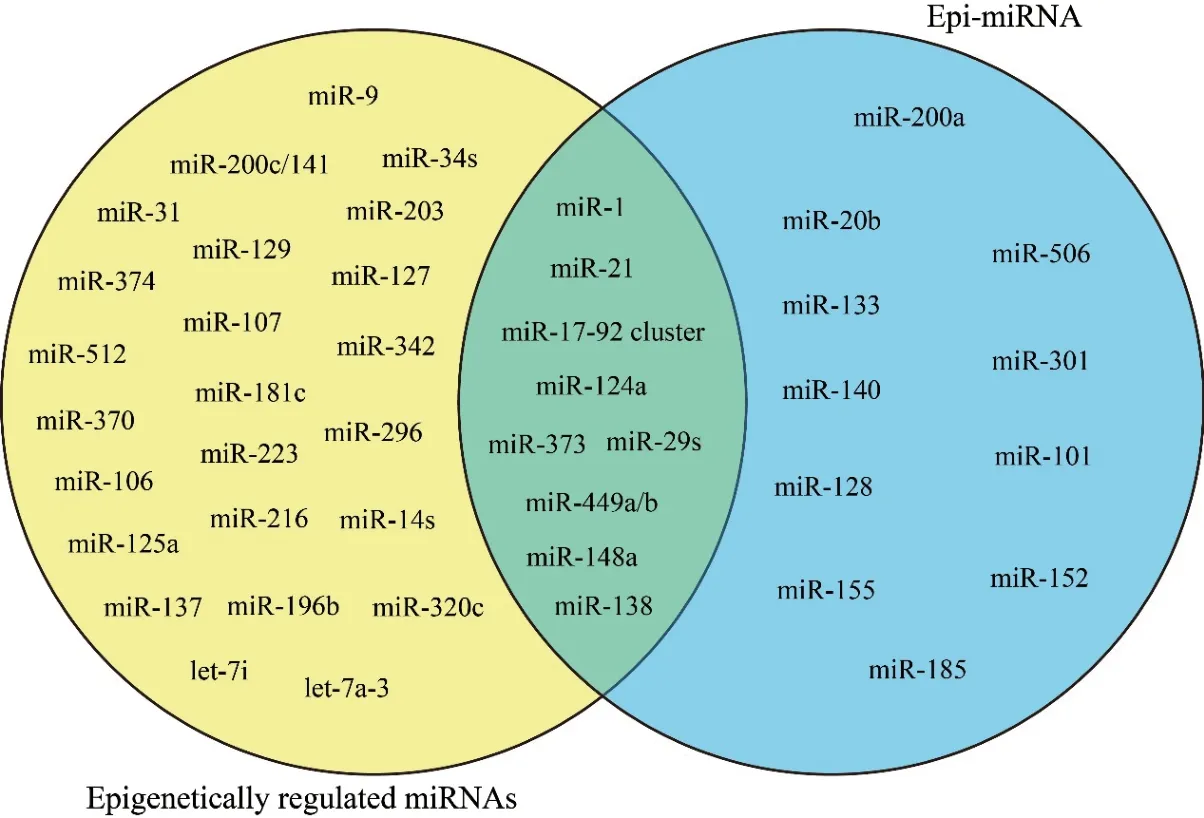
图3 表观遗传调控的miRNAs和Epi-miRNAs
后来研究发现DNMTs受到各种miRNAs的调控,包括miR-152、miR-148a、miR-185、miR-302、miR-342及miR-17-92簇的各个miRNA成员。在乳腺癌细胞中,一方面由于miR-148a和miR-152启动子区被DNMT1甲基化而表达下调;另一方面,DNMT1又是这些miRNAs的直接靶;miR-148a和miR-152下调增加IGF-IR和IRS1在乳腺癌中的表达,诱导肿瘤生长和血管生成[22]。在顺铂耐受的卵巢癌中,miR-152和miR-185表达下调,其靶点DNMT1表达水平升高;过表达miR-152和miR-185抑制细胞增殖、促进凋亡,提高卵巢癌细胞对顺铂的敏感性[23]。miR-17-92簇在DNA甲基化水平上受DNMT1调控,而DNMT1又被该基因簇miRNAs靶向调控,从而形成一个双重负反馈回路[24]。
另外,调节组蛋白修饰的酶也直接受epimiRNAs的调控。EZH2是PRC2的一个保守催化区域。由 于miR-26a、miR-101、miR-205和miR-214的特异性下调,EZH2在各种癌症中高表达。在肝癌细胞中,miR-101靶向PRC2复合物的2个亚单位:EZH2和EED;抑制miR-101表达导致PRC2活性增加及肝癌发生[25]。在脑胶质瘤,miR-128下调导致PCR2复合物成份Bmi-1过表达,通过染色质重塑造成肿瘤干细胞群自我更新[26]。转录因子YY1受miR-29家族成员,特别是miR-29b/c的调控[27],而YY1可将PRC2复合物和HDAC1招募到特定的基因组位置,通过调节染色质结构控制多个细胞过程,包括凋亡、细胞周期和肿瘤发生。此外,在细胞中,PRC2在生理功能上与HDACs相关,而HDACs受到多个miRNAs的调控,包括miR-1、miR-21、miR-29、miR-140、miR-155、miR-200a及miR-449家族[19,28-30]。在前列腺癌细胞中,miR-449a靶向抑制HDAC1表达,诱导细胞周期阻滞,凋亡和衰老 样 表 型[29]。而miR-140、miR-155和miR-200a直接通过下调HDAC4表达,整体上调组蛋白乙酰化[15,30-31]。而Sirt1是另一种组蛋白去乙酰化酶,通过压缩染色质结构发挥转录抑制作用。已有研究证明,Sirt1受miR-138调控,而miR-138又被Sirt1抑制,miR-138和Sirt1之间形成一个双重负反馈回路[32]。以上证据表明,miRNA和表观遗传之间形成一种复杂的调控网络,来严格控制基因表达。这一复杂网络成员的平衡改变将会导致病理条件的发生,如癌症(图4)。因此,使用miRNA直接调节基因表达或通过靶向表观遗传效应酶来控制表观遗传,从而影响广泛的调节分子表达,逆转癌症中的异常基因表达,具有极大的临床应用前景。
5 结语
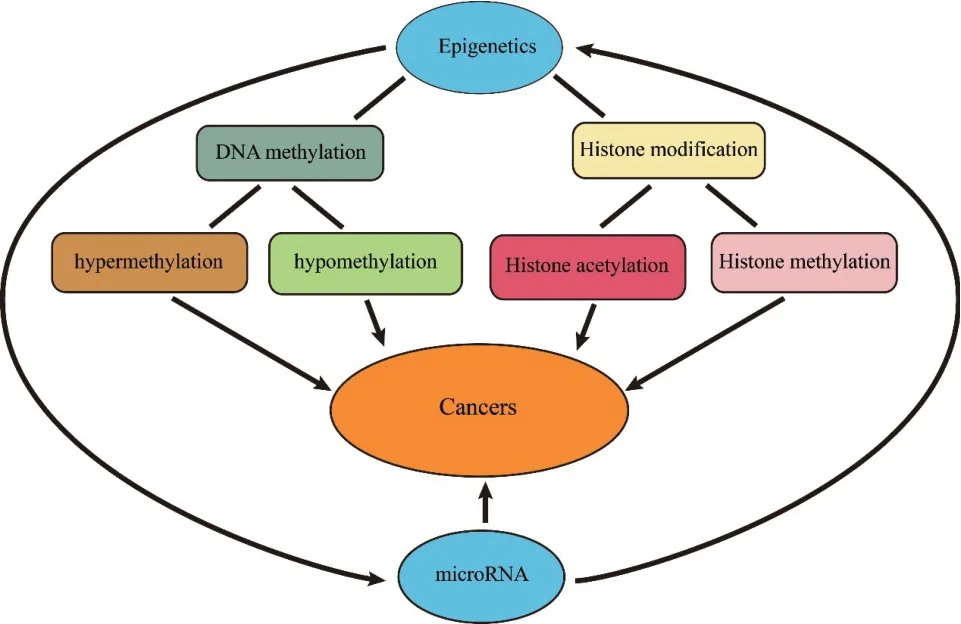
图4 癌症中miRNAs和表观遗传修饰之间的相互作用反馈回路
近年来,关于表观遗传修饰与miRNA相互作用的报道不断出现。越来越多的证据表明,miRNA可以通过靶向抑制表观遗传关键酶来影响表观遗传;反之,表观遗传(如DNA甲基化和组蛋白修饰)也能影响miRNA的表达。表观遗传-miRNA相互作用的调控网络为癌症治疗提供了一个非常有价值的靶点。表观遗传疗法(如DNMTs抑制剂5-Aza和HDAC抑 制 剂SAHA及miRNA mimics或inhibitors)在癌症的治疗中已显示出很好的前景[33-34]。目前,一 些miRNA mimics,如miR-34的MRX34或miR-107、miR-101和miR-16等mimics,已处在药物开发和临床试验的不同阶段,但如何有效地将小分子核酸运送到癌组织并被细胞吸收,仍是一个具有挑战性的问题。考虑到miRNAs和表观遗传之间存在相互作用,表观遗传关键酶抑制剂和/或联合miRNA mimics可能是癌症更有前景的治疗策略。

