普洱晒青茶顶空固相微萃取条件优化研究
钱 坤 ,李青春,安同伟 ,田向学,杨慧杰 ,沈永鑫
( 1. 天津市农业生态环境监测与农产品质量检测中心,天津 300402;2. 天津赫莱恩特生物科技有限公司,天津 301702;3.天津市畜牧兽医研究所,天津 300384;4.辽宁省检验检测认证中心,辽宁 沈阳110016;5.岛津企业管理(中国)有限公司,北京 100020)
普洱晒青茶是采摘的普洱茶鲜叶经摊凉、杀青、揉捻和干燥制作而成,是制作普洱熟茶和普洱生茶的原料,并在地理保护范围内采用特定的加工工艺制成,具有独特品质特征的茶叶,按其加工工艺的不同,普洱茶可分为普洱熟茶和普洱生茶[1]。其安全性直接影响普洱茶相关产品的安全性。农药残留检测大多需采用多种前处理方法,往往面临处理时间长、程序复杂等缺陷,样品的前处理(样品制备)是其分析的关键和难点,直接影响目标分析物准确性、成本和效率[2]。由于茶叶自身含有大量的茶多酚、茶色素、茶多糖、茶氨酸等成分,会严重影响农药残留的检测,对目标物带来干扰[3]。本研究采用HS-SPME技术结合气相色谱-串联质谱法建立普洱晒青茶中多种农药残留的快速检测方法,对影响HS-SPME技术的萃取头类型及其他影响因素进行考察和优化,并对云南省普洱市主要产区的普洱晒青茶进行检测。
传统提取方法有液液萃取法(LLE)、索氏提取(SE)、超临界流体萃取(SFE)、加速溶剂提取(ASE)等方法,这些方法易于推广、应用普遍,但是传统前处理方法普遍存在操作繁琐、溶剂用量大、选择性差、自动控制率低、消耗时间长等缺点。随着前处理技术水平的不断提升,高效、快速、少溶剂的样品前处理新技术和新方法不断的涌现,其中常见的有:固相萃取(SPE)[4]、液相微萃取(LPME)[5]、分散固相萃取(DSPE)[6]、基质固相分散萃取(MSPD)、搅拌棒吸附萃取(SBSE)[7]、固相微萃取(SPME)[8]等萃取技术,这些新技术的出现,有效的克服了传统前处理方法的缺陷,具备操作简单、萃取效率高、自动化程度高、省时省力、较少使用或无溶剂等优点。SPME技术作为新型的无溶剂样品前处理技术,在简化操作流程、节省有机溶剂消耗、减少环境污染和降低劳动力消耗等方面具有独特的优势,完全具备分析领域所倡导的“绿色分析”技术特点。目前,该技术在简单基质中单一几种或少数几类痕量化学污染物检测中有广泛应用,但对于茶叶这种复杂基质中农药多残留的研究尚未有报道。本研究以国家普洱茶质量技术监督检测中心的长期检测为参考,筛选出21种常见农药,采用具有高灵敏度、高选择性和良好重现性的GC-MS检测技术,并且针对普洱晒青茶基质特点,采用顶空固相微萃取(HS-SPME)前处理技术净化基质,浓缩分析物,并对仪器测定参数和前处理条件进行优化,以提高检测方法的选择性和灵敏度。
1 材料与方法
1.1 材料与试剂
茶叶样品:晒青茶购自普洱市茶叶交易市场。空白晒青茶样品:经国家普洱茶质量技术监督检测中心检测,未检测出目标农药残留,本样品用作顶空固相微萃取条件优化空白基质样品。
有机溶剂:乙腈(色谱纯)、丙酮(色谱纯)、甲醇(色谱纯)、甲苯(色谱纯),购自上海阿拉丁生化科技股份有限公司。无机盐:氯化钠(分析纯),购自天津市北方天医化学试剂厂。
1.2 仪器与设备
岛津气相色谱-质谱联用仪(GCMSQP2020),日本岛津公司生产。岛津毛细管色谱柱(SH-Rxi-17 Sil MS,30 m × 250μm ×0.25 μm),日本岛津公司生产。手动固相微萃取手柄(SPME-GC),美国Supelco公司生产。磁力搅拌器(IT-09A),上海一恒科学仪器有限公司生产。电子天平(YP1200型),上海精科电子有限公司生产。移液枪,德国 Eppendorf公司生产。Milli-Q高纯水发生器(Tankmpk 01),美国Millipore公司生产。85 μm PA萃取头、65 μm PDMS/DVB萃取头,购自美国Supelco公司。20 mL顶空瓶,购自日本岛津公司。
1.3 试验方法
1.3.1样品预处理 晒青茶样品和晒青茶空白基质样品经粉碎后过20目筛,粉碎后茶叶装入铝箔纸封袋中,放置于4 ℃冰箱中备用。
1.3.2 标准溶液的配制 根据21种农药标准品的浓度进行稀释到合适的含量作为分析用标准液。
1.3.3 GC-MS条件 (1)GC条件 色谱柱:SHRxi-17 Sil MS,30 m × 250 μm × 0.25 μm毛细管柱。
载气:高纯氦气(>99.999%);载气流速:1.1 mL·min-1。
进样方式:手动进样;进样模式:不分流进样;进样口温度:250 ℃。
色谱柱升温程序:初始温度60 ℃,保持1 min,以30 ℃每1 min升至160 ℃,再以5 ℃每1 min升至295 ℃,保持10 min。
(2)MS条件 离子化模式:EI源;电子能量:70 eV;离子源温度:230 ℃;色谱-质谱接口温度:290 ℃。
质谱扫描方式:全扫描模式(SCAN),扫描质量m/z40~500,确定各化合物扫描离子和保留时间;选择离子扫描模式(SIM),扫描离子及SIM分组根据全扫描结果确定。
其他质谱参数:采用全氟三丁胺自动调谐后生成参数。
1.4 试验设计
试验步骤:称取1.0 g粉碎空白晒青茶样加入到20 mL的顶空瓶中,加入4 mL超纯水和转子,聚四氟乙烯密封。将顶空瓶放置于磁力搅拌器上80 ℃的水浴中,300 r·min-1平衡10 min,后插入装有萃取头的SPME手柄,推出纤维萃取头在顶空瓶上部空间萃取60 min,收回萃取纤维头,拔出SPME手柄插入气相色谱进样口,推出纤维萃取头于一定温度下(65 μm PDMS/DVB在270 ℃,85 μm PA在290 ℃)解吸附4 min,同时启动仪器采集数据,每个萃取头重复萃取3次。
在单因素试验考察的基础上,利用Minitable 17(Minitab Inc., USA)进行Plackett-Burman试验设计,试验分别对加盐量、萃取温度、萃取时间、溶液pH值、加水量和搅拌速率6个影响因素进行全面考察,选择N=12的Plackett-Burman设计,根据单因素试验的结果确定Plackett-Burman试验的低水平(-1)值和高水平(1)值,以萃取目标化合物的峰面积为响应值。在HS-SPME分析中,pH值的改变往往可影响基质溶液的性质,进而改变目标分析物在样品基质和固定相之间的分配系数,同时提高待分析物的稳定性,提高萃取头对目标分析物质的萃取效率和分析结果的准确性。试验通过采用HCl和NaOH调节基质溶液的pH值,考察pH值对萃取头吸附目标农药检测峰面积的影响。对于85 μm PA,pH值为4时萃取量达到最大,随着pH值的进一步升高,萃取量有减小的趋势;对于65 μm PDMS/DVB随着pH值的增加,萃取量有增加的趋势,但是对于85 μm PA和65 μm PDMS/DVB来说,改变pH值对萃取头萃取影响都不是很明显,因此在萃取过程中选择直接加入超纯水,不进一步调整溶液pH值。试验设计如表1所示。

表1 Plackett-Burman试验设计的因素和水平
2 结果与分析
2.1 响应面因素水平
根据Plackett-Burman试验筛选的结果,对影响85 μm PA和65 μm PDMS/DVB萃取头萃取效率的重要影响因子采用Design-Expert 8. 0. 5b 软件(State-Ease Inc., USA)进行Box-Behnken试验设计(表2),进一步根据试验的响应值(峰面积)进行数据分析,从而得到显著影响85 μm PA和65 μm PDMS/DVB萃取头萃取效率的各因子的最佳取值。采用方差分析、F检验和回归显著性分析对模型的拟合进行检验分析。同时采用方差分析和t检验对影响因子及其交互作用进行显著性检验,删除无统计学显著意义的参数(P>0.05),进而简化预测模型。

表2 Box-Behnken实验设计及水平
2.2 回归方程及系数分析
根据表1因素和水平,分别采用Minitab软件进行试验设计(表3),同时根据设计程序下85 μm PA和65 μm PDMS/DVB检测到农药残留总峰面积进行数据回归分析。

表3 Box-Behnken试验设计及结果
在试验设计和检测的基础上,采用Mintab软件对检测结果进行分析,经过回归拟合,85 μm PA和65 μm PDMS/DVB萃取头各影响因素对检测结果有显著影响作用。PA影响因素回归方程:

PDMS/DVB影响因素回归方程:

通过对回归模型进行方差分析,结果如表4所示,2个回归模型均极显著(85 μm PA:P=0.000;65 μm PDMS/DVB:P=0.001),失拟项均不显著(85 μm PA:P=0.124;65 μm PDMS/DVB:P=0.517),同时也表明了未知因素对萃取结果的影响较小。85 μm PA和65 μm PDMS/DVB 2个萃取头模型R2adj分别为93.44%和93.95%,表明了2个模型与试验拟合度较好,可以采用模型对85 μm PA和65 μm PDMS/DVB萃取头萃取GC-MS检测响应值进行预测分析。85 μm PA萃取头模型中A、B、A2、B2、C2、D2对萃取检测响应值影响极其显著(P<0.01),表明了萃取温度、盐添加量、萃取时间和加水量4个因素对萃取检测响应值的影响不是单纯的线性关系,其中还存在二次项对萃取检测响应值的显著影响,而两两因素之间AB、AC、AD、BC、BD、CD对萃取头检测响应值影响均不显著(P值为0.067~0.942之间),说明模型中因素之间交互作用较小;65 μm PDMS/DVB萃取头模型中,A、B、A2、B2、C2对萃取检测响应值影响极显著(P<0.01),萃取温度、盐添加量和萃取时间3个因素对萃取检测响应值同时存在线性和二次项的影响,两两因素之间AB、AC、BC对萃取头检测响应值影响均不显著(P值为0.303~0.967之间),说明模型中因素之间交互作用较小。

表4 回归模型方差分析
2.3 响应面分析及优化
2.3.1 PA萃取头影响因素响应面 在回归模型分析的基础上,利用Mintab软件,将影响85 μm PA萃取的4个因素(萃取温度、盐浓度、萃取时间和加水量)中的其中2个因素固定在中心水平,绘制2个因素相应的曲面图和等高线图,结果如图1—图6所示。
试验固定萃取时间和加水量不变,绘制响应曲面和等高线图如图1所示,随着萃取温度和盐添加量的增加,85 μm PA萃取头萃取检测峰面积均呈现先增加后降低的趋势,从曲面变化的趋势可知,萃取温度对响应值的影响较大,通过等高线变化趋势,可见萃取温度和盐添加量之间交互作用不明显。


图1 萃取温度和盐添加量对85 μm PA萃取检测响应值影响的响应面(A)和等高线(B)图
试验固定盐添加量和加水量不变,绘制响应曲面和等高线图如图2所示,随着萃取温度和萃取时间的增加,85 μm PA萃取头萃取检测峰面积均呈现先上升后降低的趋势,从曲面变化的趋势可知,萃取温度对响应值的影响较大,通过等高线变化趋势,萃取温度和萃取时间之间交互作用不明显。

图2 萃取温度和萃取时间对85 μm PA萃取检测响应值影响的响应面(A)和等高线(B)图
试验固定盐添加量和萃取时间不变,绘制响应曲面和等高线图如图3所示,随着萃取温度和加水量的增加,85 μm PA萃取头萃取检测峰面积均呈现先增加后降低的趋势,从曲面变化的趋势可知,萃取温度对响应值的影响较大,通过等高线变化趋势,萃取温度和加水量之间交互作用不明显。

图3 萃取温度和加水量对85 μm PA萃取检测响应值影响的响应面(A)和等高线(B)图
试验固定萃取温度和加水量,绘制响应曲面和等高线图如图4所示,随着盐添加量和萃取时间的增加,85 μm PA萃取头萃取检测峰面积均呈现先增加后降低的趋势,从曲面变化的趋势可知,盐添加量对响应值的影响较大,通过等高线变化趋势,盐添加量和萃取时间之间交互作用不明显。
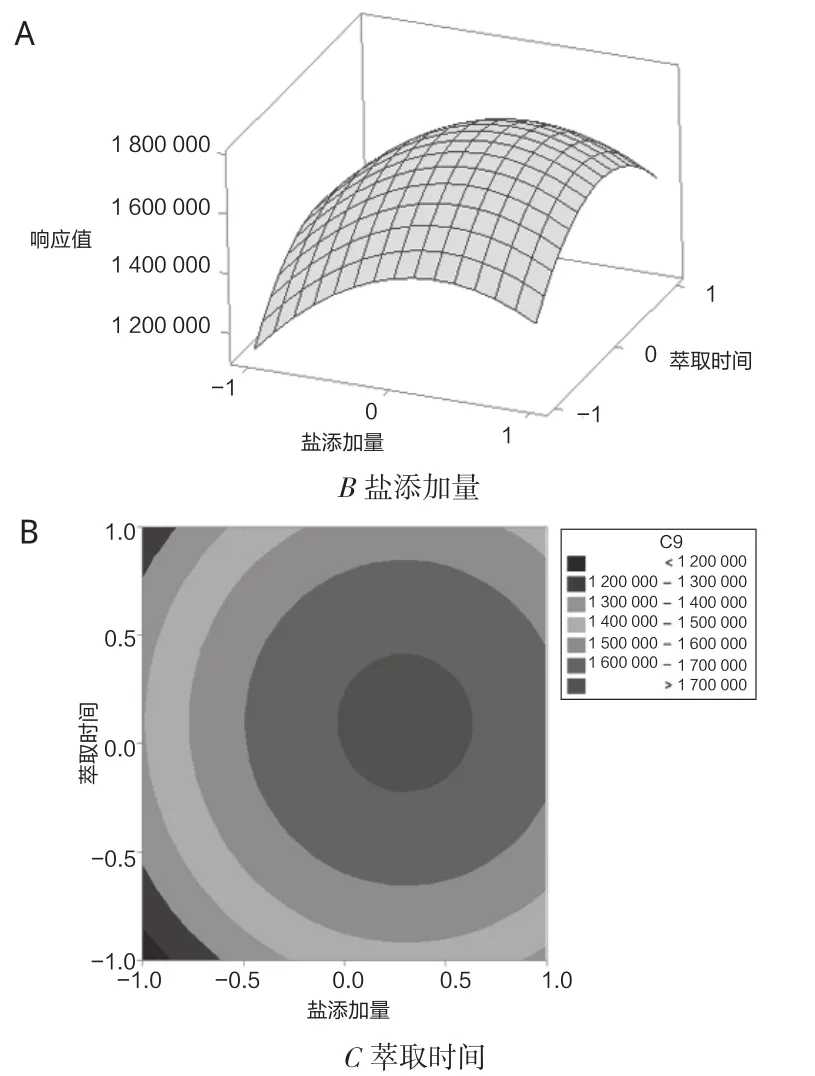
图4 盐添加量和萃取时间对85 μm PA萃取检测响应值影响的响应面(A)和等高线(B)图
试验固定萃取温度和萃取时间,绘制响应曲面和等高线图如图5所示,随着盐添加量和加水量的增加,85 μm PA萃取头萃取检测峰面积均呈现先增加后降低的趋势,从曲面变化的趋势可知,盐添加量对响应值的影响较大,通过等高线变化趋势,盐添加量和加水量之间交互作用不明显。
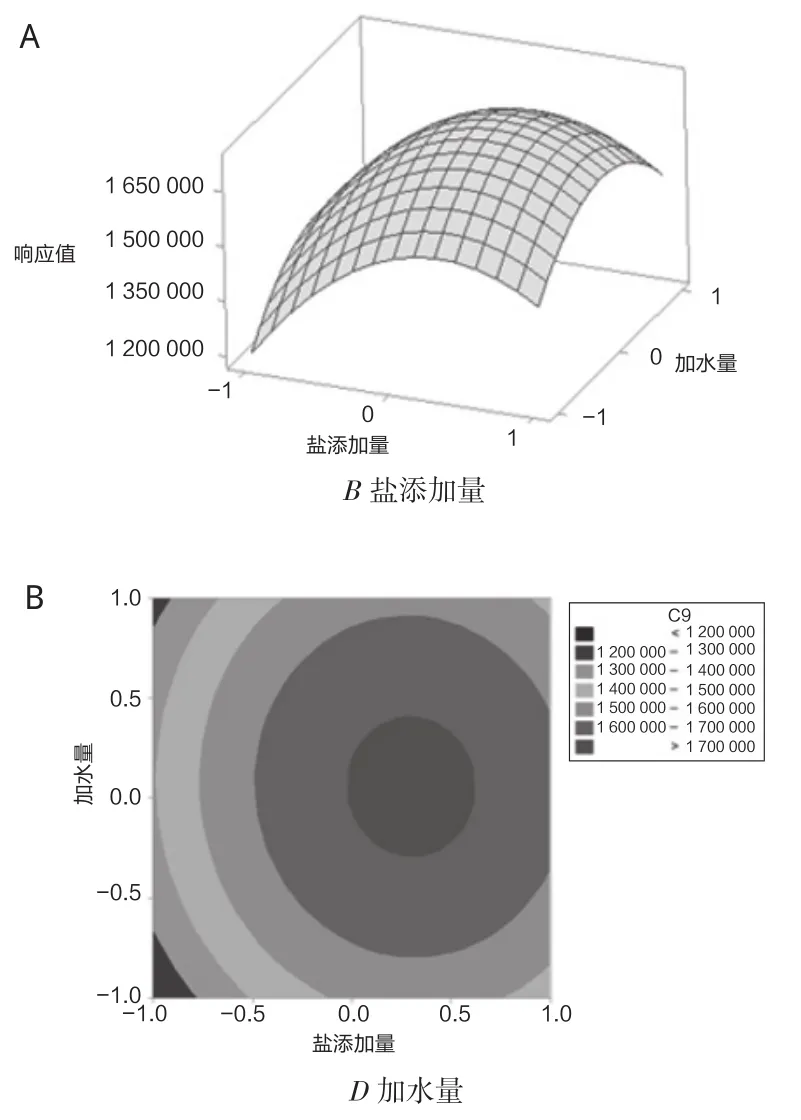
图5 盐添加量和加水量对85 μm PA萃取检测响应值影响的响应面(A)和等高线(B)图
试验固定萃取温度和盐添加量,绘制响应曲面和等高线图如图6所示,随着萃取时间和加水量的增加,85 μm PA萃取头萃取检测峰面积均呈现先增加后降低的趋势,从曲面变化的趋势可知,萃取时间对响应值的影响较大,通过等高线变化趋势,萃取时间和加水量之间交互作用不明显。

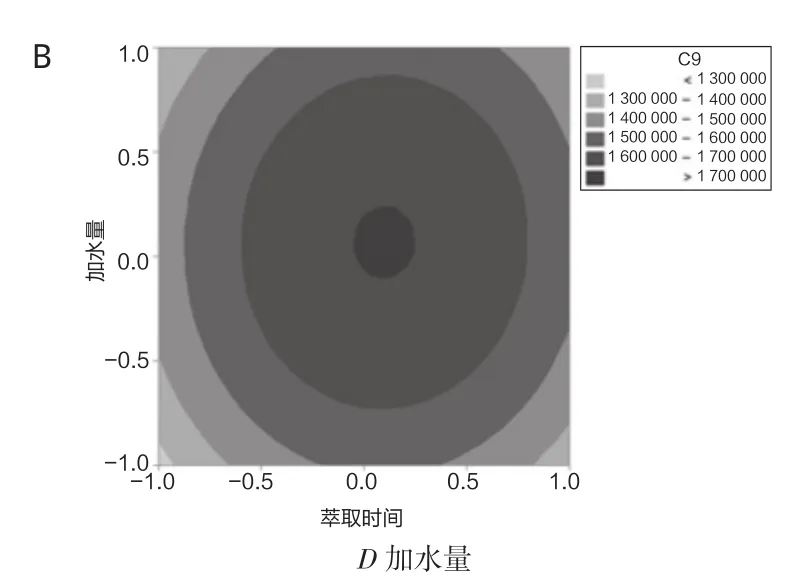
图6 萃取时间和加水量对85 μm PA萃取检测响应值影响的响应面(A)和等高线(B)图
2.3.2 PDMS/DVB萃取头影响因素响应面 在回归模型分析的基础上,利用Mintab软件,将影响65 μm PDMS/DVB萃取的3个因素中的其中1个因素固定在中心水平,绘制2个因素相应的曲面图和等高线图,结果如7至图9所示。
试验固定萃取时间,绘制响应曲面和等高线图如图7所示,随着萃取温度和盐添加量的增加,65 μm PDMS/DVB萃取头萃取检测峰面积均呈现先增加后降低的趋势,从曲面变化的趋势可知,萃取温度对响应值的影响较大,通过等高线变化趋势,萃取温度和盐添加量之间交互作用不明显。

图7 萃取温度和盐添加量对65 μm PDMS/DVB萃取检测响应值影响的响应面(A)和等高线(B)图
试验固定盐添加量,绘制响应曲面和等高线图如图8所示,随着萃取温度和萃取时间的增加,65 μm PDMS/DVB萃取头萃取检测峰面积均呈现先增加后降低的趋势,从曲面变化的趋势可知,萃取温度对响应值的影响较大,通过等高线变化趋势,萃取温度和萃取时间之间交互作用不明显。
试验固定萃取温度,绘制响应曲面和等高线图如图9所示,随着盐添加量和萃取时间的增加,65 μm PDMS/DVB萃取头萃取检测峰面积均呈现先增加后降低的趋势,从曲面变化的趋势可知,盐添加量对响应值的影响较大,通过等高线变化趋势,盐添加量和萃取时间之间交互作用不明显。

图9 萃取时间和盐添加量对65 μm PDMS/DVB萃取检测响应值影响的响应面(A)和等高线(B)图
3 结 论
分别对2个回归模型求解,得到85 μm PA萃取头4个影响因素的最优值分别为:萃取温度95℃、盐添加量1.65 g、萃取时间66 min、加水量 4 mL;65 μm PDMS/DVB萃取头3个影响因素的最优值分别为:萃取温度64 ℃、盐添加量1.19 g、萃取时间 62 min。结合单因素对其他因素的考察结果,在最优条件确定的基础上,响应面试验进程3次萃取试验验证,结果显示,优化检测方法可靠,可应用于萃取与检测。

