自发性椎管内硬膜外血肿的影像学及临床特征
刘 欢,白 萌,杨龙飞,鞠 刚,李海俊,刘红光,卞 健,黄爱兵
1.大连医科大学研究生院,大连 116044 2.泰州市人民医院脊柱外科,泰州 225300
自发性椎管内硬膜外血肿(SSEH)是一种临床少见的、病因不明的疾病,起病急,早期临床表现缺乏特异性,多以颈肩部或胸腰背部疼痛急性发作为首发症状,短时间内出现不同程度的神经根或脊髓受压症状,表现为神经根分布区的放射性疼痛、麻木无力,甚至发展为截瘫或四肢瘫痪[1]。国外学者报道该病的年发生率为1/1 000 000,男女比约为1.4∶1[2]。早期识别并及时治疗是降低其致残率及病死率的关键。本研究回顾性分析2008年6月—2018年9月泰州市人民医院脊柱外科收治的12例SSEH患者临床资料,总结SSEH的影像学特征及临床转归。
1 资料与方法
1.1 临床资料
SSEH患者12例,其中男8例、女4例;年龄25~74岁,中位年龄64.5岁。8例直接就诊于脊柱外科,2例首诊神经内科,1例首诊心内科,1例由急诊转入重症监护室后由脊柱外科会诊后确诊。所有患者均行脊髓MRI检查,5例同时行CT检查。实验室检查包括血常规、肝肾功能及凝血时间。采用硬膜外脊髓压迫(ESCC)分级系统[3]评估硬膜外占位对硬膜囊及脊髓的压迫程度,美国脊髓损伤协会(ASIA)分级[4]评估神经功能,疼痛视觉模拟量表(VAS)评分[5]评估疼痛情况。
1.2 治疗方法
所有患者确诊后根据临床表现、影像学资料及实验室检查结果,与患者及家属沟通后确定治疗方案。7例接受手术治疗,5例接受非手术治疗。
1.3 统计学处理
采用SPSS 17.0软件对数据进行统计学分析,计量资料以范围和中位数表示;计数资料和等级资料均以例数表示。采用Spearman相关分析探讨ESCC分级与ASIA分级之间的相关性;以P<0.05为差异有统计学意义。
2 结 果
2.1 基本资料
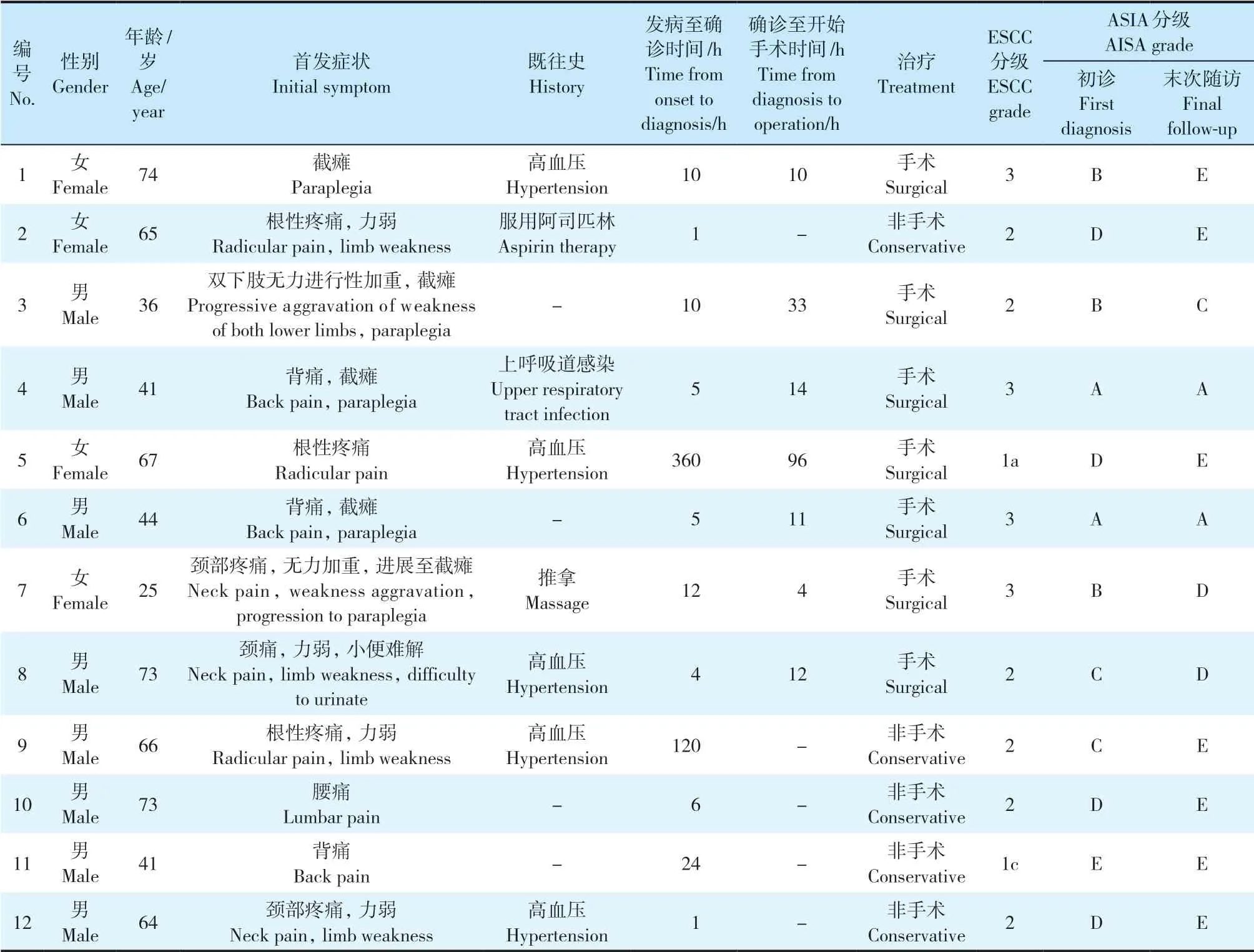
表1 患者临床资料Tab. 1 Clinical data of patients
12例患者临床资料见表1。发病至确诊时间为1 h~15 d,中位确诊时间8 h。24 h内确诊者10例,1例患者发病5 d后确诊,1例患者发病15 d后确诊。5例患者表现为截瘫;1例肢体无力合并小便排解困难;1例表现为根性疼痛;3例右上肢肌力4级,较左侧稍弱;2例患者分别表现为单纯腰痛和背痛。5例有高血压病史,1例长期服用阿司匹林,1例发病前1周有上呼吸道感染病史,1例发病于推拿按摩时,余无特殊病史。临床确诊至开始手术中位间隔时间为12 h(4~96 h)。12例患者术后均获得随访,中位随访时间18.5个月(3个月~ 8年)。
2.2 神经功能及治疗方案
依据ESCC分级系统(评估硬膜外占位对硬膜囊及脊髓压迫程度),12例患者中1例ESCC分级为1a,其初诊时神经功能ASIA分级为D级,末次随访时为E级;1例ESCC分级为1c,初诊时ASIA分级E级,末次随访时为E级;6例ESCC分级2级,初诊时ASIA分级分别为D、B、C、C、D、D级,末次随访时分别为E、C、D、E、E、E级;4例患者脊髓压迫最重,ESCC分级为3级,初诊时ASIA分级分别为B、A、A、B级,末次随访时分别为E、A、A、D级。Spearman相关分析显示,SSEH患者初诊时神经功能ASIA分级与ESCC分级具有相关性(r=0.85,P<0.01),而神经功能改善状况与ESCC分级无相关性(r=0.15,P>0.05)。
对于初诊时神经功能损伤严重(ASIA分级A、B及C级)或观察期间神经功能进展加重的患者,选择手术治疗。本组病例行手术治疗7例,初次就诊时神经功能ASIA分级A级2例、B级3例、C级1例、D级1例。其中1例D级患者(病例5),在药物治疗过程中根性疼痛无法缓解且逐渐加重,行走困难,4 d后选择了手术治疗。本组病例均采用脊柱后正中入路行椎板切除减压、血肿清除术(图1)。根据椎板切除范围选择内固定与否,3个以上节段椎板切除多采用椎弓根螺钉内固定(图2)。末次随访神经功能ASIA分级:2例A级患者仍为A级;3例B级患者,1例恢复至E级,1例恢复至D级,1例恢复至C级;1例C级患者恢复至D级;1例D级患者恢复至E级。

图1 行血肿清除术治疗患者影像学资料Fig. 1 Imaging data of a typical case treated by hematoma evacuation

图 2 行椎弓根螺钉内固定术治疗患者影像学资料Fig. 2 Imaging data of a typical case treated by pedicle screw fixation
对于初诊时神经功能损伤较轻/无神经症状(如ASIA分级D、E级)或观察期间神经功能已有较明显恢复的患者,首选非手术治疗。本组共5例患者进行非手术治疗,初诊时ASIA分级C级1例、D级3例、E级1例。其中1例C级患者(病例9)就诊后24 h内神经功能损伤明显好转,予以密切观察。治疗方案包括适当制动、卧床休息,给予甘露醇、糖皮质激素及营养神经药物,疼痛患者予以非甾体抗炎药止痛治疗,并定期对患者临床症状及神经功能进行评判(图3)。所有患者末次随访神经功能均为E级,VAS评分均显著改善。其中1例患者(病例2)就诊时肩背部及上肢疼痛VAS评分9分,非手术治疗10 d后VAS评分1分,3个月随访再次出现一侧上肢麻木,建议行MRI检查,患者拒绝,经非手术治疗1周后麻木感消失;1例患者(病例9)就诊时VAS评分7分,ASIA分级C级,治疗8 d后VAS评分1分,末次随访时ASIA分级E级;1例患者(病例10)治疗第2天VAS评分由就诊时的8分降至2分,1个月后疼痛完全消失;1例患者(病例12)于第7天VAS评分由就诊时的8分降至1分;1例患者(病例11)神经功能无损伤,仅背部疼痛(VAS评分6分),非手术治疗4 d后VAS评分降至0分,1周后复查MRI示椎管占位病变体积明显缩小。

图 3 行非手术治疗患者影像学资料Fig. 3 Imaging data of a typical case undergoing conservative treatment
2.3 影像学表现
SSEH患者MRI及CT表现见表2。MRI(图4)示硬膜外血肿矢状面上大多呈梭形或椭圆形,T2WI MRI示9例血肿与脊髓之间常可由一低信号线分隔(病例2、5、9无低信号线分隔影)。其中1例患者腰椎MRI未能明确诊断,进一步行神经根成像检查提示L5右侧神经根肩上部圆形致压物,部分强化,术中证实为血肿。8例患者发病至MRI检查间隔时间<24 h,在T1WI MRI上7例呈等信号、1例呈稍高信号,T2WI MRI上5例呈高信号、1例呈高/混杂信号、2例呈混杂信号;3例患者发病至MRI检查间隔时间为24~336 h(1~14 d),T1WI MRI上1例呈高信号、1例呈稍高信号、1例呈等/高信号;T2WI MRI上1例呈高信号、1例呈高/混杂信号、1例呈低信号;有1例患者发病至MRI间隔时间>336 h(14 d),其T1WI、T2WI MRI均呈低信号。SSEH位于颈段4例、颈胸段4例、胸段2例、胸腰段1例、腰段1例;累及1~4个节段,平均2.6个节段;1例位于脊髓腹侧,11例位于脊髓背侧。5例患者同时行CT检查,4例显示椎管内稍高密度影,1例无异常发现。
3 讨 论
SSEH确切病因未明,发生机制也尚缺乏定论。文献报道的主要诱发因素有动静脉畸形、抗凝药的使用、椎体血管瘤、血液系统疾病、妊娠、高血压、轻微外伤等,但仍有40%~50%的患者无任何诱因[2,6]。多个研究证实了高血压与SSEH的相关性。Muñoz González等[7]报道的病例中,62%(8/13)具有高血压病史。Zhong等[8]报道的7例患者中,6例合并有高血压。本组患者中,5例合并高血压,1例患者发病前有上呼吸道感染病史,1例患者长期服用阿司匹林,1例患者推拿按摩后发病。因SSEH持续进展会引起灾难性后果,对于突发颈部或背部疼痛、神经功能损伤持续加重或伴有潜在高危因素的患者,临床上需提高警惕,尽早采用合适诊断措施,避免误诊[9-10]。
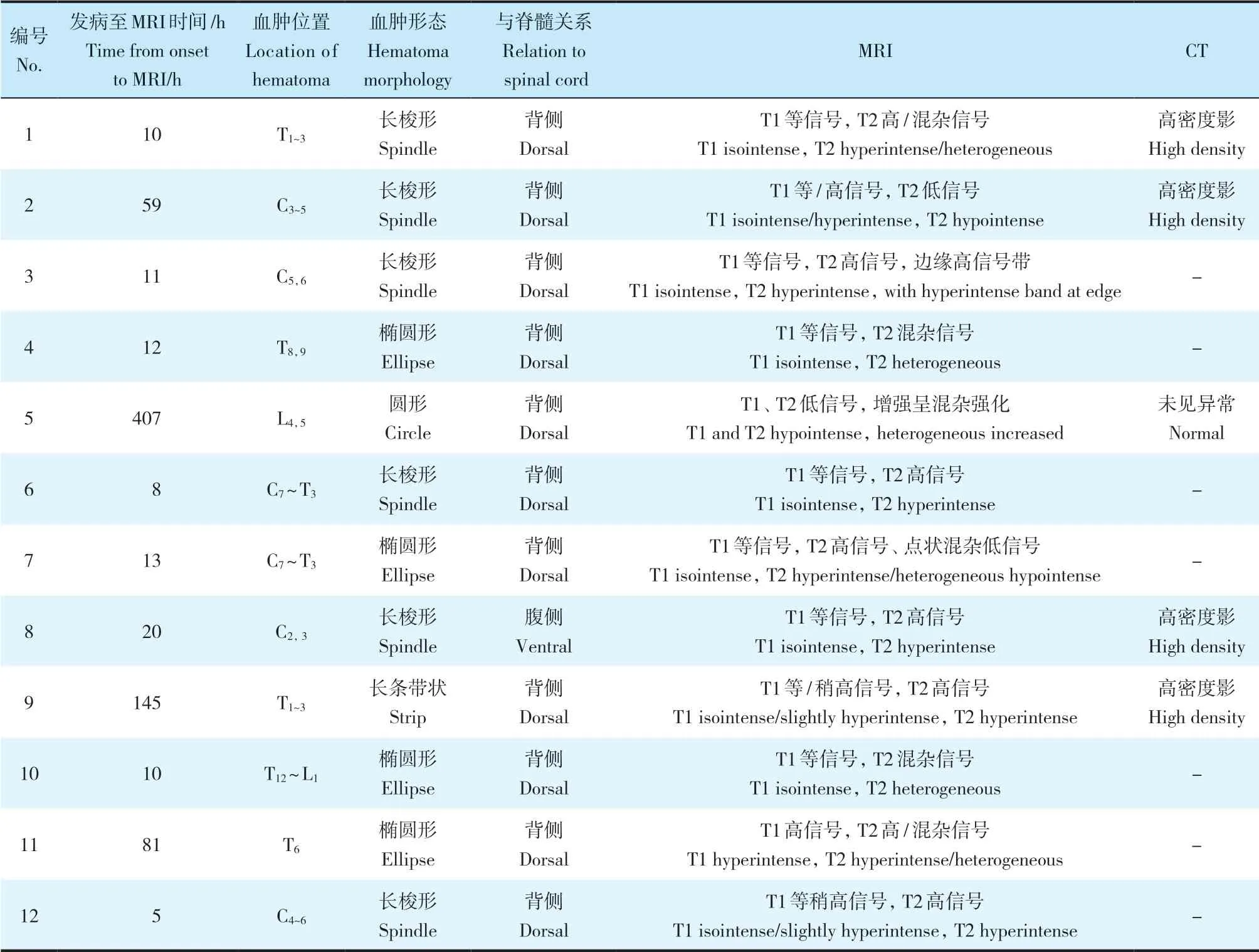
表2 患者影像学表现Tab. 2 Radiological characteristics of patients
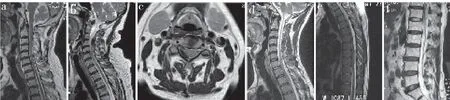
图4 SSEH患者MRI表现Fig. 4 MRI of SSEH patients
早期识别及正确诊断是临床上避免贻误最佳治疗时机的关键所在[10]。有学者报道SSEH初诊时误诊率高达28%[11]。SSEH的早期诊断主要依据临床特征及MRI。典型症状为咳嗽或用力后(部分患者无明显诱因)突发颈、背、腰部疼痛,伴神经根或脊髓压迫症状,部分患者有明显的进行性神经功能损伤加重表现[6-9]。本组患者发病至确诊时间为1 h~15 d,尽管2例患者确诊时间> 24 h,但本组患者的24 h确诊率达83.3%(10/12),这得益于近年来MRI的普及。MRI可以准确地显示病变的范围、节段、严重程度,是诊断椎管内占位性病变的金标准[1,12]。对于疑似SSEH患者,应尽早行MRI检查。SSEH的MRI形态学表现对诊断具有极大的参考价值。硬膜外血肿矢状面上呈梭形,大多位于脊髓背侧,横断面上呈新月形,血肿与脊髓之间常由1条低信号线分隔,为该病的特征性表现。本组12例患者仅1例血肿位于脊髓腹侧,其余均位于脊髓背侧。10例血肿在MRI矢状面上表现为长梭形或椭圆形,9例可见血肿与脊髓之间低信号线。血肿MRI的信号变化与出血时间密切相关[13]:24 h内,T1WI呈等信号,T2WI呈高信号;超过24 h,T1/T2WI均呈高信号;慢性期T1/T2WI均呈低信号。本研究中12例患者的MRI影像学特征也基本符合此规律。此外,SSEH需注意与硬膜外脓肿鉴别诊断,后者常伴有全身感染症状,T1WI MRI呈低信号、T2WI MRI呈高信号。
尽管CT在显示椎管内占位性病变方面较MRI稍显逊色,但CT能够清晰显示周围骨性结构改变,对该病的病因诊断具有一定的意义。钱邦平等[14]报道的9例SSEH患者,4例行CT检查,2例示椎板溶骨性破坏,术后证实为成骨细胞瘤;2例伴有血管瘤改变。本组患者5例行CT检查,4例提示椎管内高密度影,1例无异常发现。结合文献报道及本研究结果,对于术前MRI证实为SSEH,条件许可下行CT检查是必要的,以便发现可能的潜在病因[9]。
SSEH确诊后,则需根据患者病情决定治疗策略。既往文献建议对脊髓压迫症状严重或脊髓压迫症状进行性加重的患者尽早实行手术治疗[12]。首选方法是手术清除血肿,解除脊髓致压因素,为脊髓或神经的恢复创造条件[9,15]。Raasck等[15]复习了来自12个研究的65例患者的治疗结果,认为SSEH患者就诊时神经功能状态是影响预后的独立相关因素。Kim等[16]的研究得出了相同的结论。手术时机、年龄、伴随疾病等多种因素与患者预后的相关性具有不确定性。尽管目前缺乏高等级研究证据支持手术时机对预后的影响,临床实践仍强调尽早手术的重要性[16-17]。众多学者推荐对不完全脊髓损伤的患者尽量在48 h内行手术减压,对完全性脊髓损伤的患者手术应在36 h内完成。本组7例症状较重患者均采取手术治疗,临床确诊至开始手术中位时间为12 h(4~96 h),手术方案为后路椎板切除减压、血肿清除术。2例术前ASIA分级A级患者术后神经功能未见明显改善,3例术后神经功能较术前改善1级,1例改善2级,1例改善3级。近年来,有学者报道将微创手术应用于该疾病的治疗,取得了较好的临床疗效[18]。综合既往及本次研究经验,对于神经功能损伤较重(ASIA分级A、B、C级)或病情恶化的患者,积极行手术治疗有利于患者神经功能恢复。
对于初诊时神经功能损伤较轻或病程进展中神经功能逐渐恢复者,亦有文献报道非手术治疗是可行的[16,19-20]。给予糖皮质激素、神经营养药物等治疗,同时病程中密切观察神经功能变化。Duffill等[19]采用糖皮质激素治疗4例SSEH,1周后4例患者神经功能均有所恢复,均可下床行走,作者认为,早期出现神经功能恢复迹象,行非手术治疗是安全的。Kingery等[20]报道1例37岁男性L1,2水平SSEH患者,仅有一侧根性症状,经卧床休息、止痛治疗4周后恢复日常生活。本组5例症状较轻患者采取非手术治疗,治疗前3例神经功能ASIA分级为D级、1例为C级、1例为E级,经非手术治疗后短期内临床症状均消失,末次随访时未留有神经损伤症状(E级)。本研究临床观察中发现,对于非手术治疗患者,治疗周期内伴随着临床症状逐渐改善,影像学上病灶的占位效应也均在短时间内(2周)较发病时明显减轻。Nagata等[21]报道10例颈椎SSEH患者行非手术治疗,结果显示,10 d内血肿均可吸收;Salehpour等[22]报道2例患者,在发病21 d内神经功能得到改善,影像学上血肿也均消失。因此,结合上述研究证据及本研究经验,对于神经损伤较轻(ASIA分级D、E级)或者在临床观察中神经功能逐渐恢复的患者,非手术治疗也是稳妥的。
本研究的局限性:①为回顾性研究且病例数较少,存在一定的选择性偏倚;②基于伦理学方面考虑,未设计对照组,比较分析手术组及非手术组的疗效差异。
总之,SSEH是一类临床少见急性病,早期诊断较困难。对于怀疑SSEH的患者,早期行MRI检查是诊断和鉴别的最佳方法,CT检查对于寻找潜在病因具有一定意义。临床治疗决策可根据患者神经功能损伤及疾病发展情况,灵活选择手术或非手术治疗。

