血管紧张素转换酶2对人胰腺癌细胞BxPC3体外增殖及成瘤性的效应研究
周 琳,彭孝倩,刘 源,史成章,张连峰
郑州大学第一附属医院消化科,河南 郑州 450052
胰腺癌是恶性程度很高的消化系统肿瘤,发病隐匿、缺乏理想的治疗手段,预后极差,5年生存率低于5%[1]。阐明胰腺癌的发病机制及改善预后依然是医学领域中的一道难题。血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)是与血管紧张素转换酶(angiotensin-converting enzyme,ACE)具有同源性的Ⅰ型跨膜金属羧肽酶,在肾素-血管紧张素系统(renin-angiotensin system,RAS)中发挥关键作用。最近,因其作为SARS及新型冠状病毒(SARS-CoV-2)的宿主细胞受体再次受到关注[2]。本课题组前期研究发现,与正常胰腺组织相比,ACE2在胰腺癌组织中表达明显降低[3],提示ACE2表达及功能缺失可能在胰腺癌发病中起到促进作用。本研究通过建立稳定过表达ACE2的胰腺癌细胞株BxPC3,通过观察ACE2在体外对胰腺癌细胞增殖及成瘤性的影响,探讨相关机制,以期为胰腺癌的治疗和研究探索新途径。
1 材料与方法
1.1 主要材料和试剂本研究选用的人胰腺导管癌细胞株BxPC3(ATCC:CRL-1687)购自美国模式生物中心(American Type Culture Collection,ATCC,USA),由课题组培养传代;DMEM培养基和胎牛血清购自美国Gibco公司。RNA抽提试剂盒和逆转录试剂盒分别购自美国Invitrogen和Promega公司。ACE2多克隆抗体购自美国Santa Cruz公司,Caspase-3、β-actin单克隆抗体购自美国Sigma公司。Envision免疫组化试剂盒购自法国DAKO公司。
1.2 细胞培养及质粒转染将人胰腺癌细胞BxPC3培养于含质量浓度为100 g/L胎牛血清的DMEM培养基中,在37 ℃、体积分数为5%的CO2饱和湿度条件下传代培养,每天换液保证细胞浓度维持在2×105~4×105的最佳生长状态,台盼兰检测细胞活力>90%,选用对数生长期细胞进行实验。ACE2表达质粒(pReceiver-M02-ACE2)与空白对照质粒(pReceiver-M02-GFP)由本课题组前期构建。转染过程:将3×105细胞接种到6孔板中,培养24 h,转染时将ACE2质粒和对照质粒DNA各0.4 μg/孔和10 μl Polifect转染试剂(美国Qiagen公司)混合,加入500 μl/孔无血清培养液,共同孵育4 h后换为完全培养液,细胞在37 ℃、体积分数为5%的CO2的条件下培养。
1.3 建立稳定高表达ACE2的BxPC3细胞株于转染24 h后更换细胞培养液,48 h 后加入400 μg/ml G418;4周后,待稳定转染ACE2及GFP对照质粒的BxPC3细胞克隆形成后,挑取克隆(分别命名为BxPC3/ACE2和BxPC3/GFP),培养在含200 μg/ml G418的培养液中维持生长和传代。
1.4 Western blotting检测细胞离心沉淀后加入裂解液,RC-DC法进行蛋白定量,取30 μg蛋白进行SDS-PAGE电泳,转移至硝酸纤维膜(Bio-Rad公司)。取30 μg蛋白加样于12%的SDS-聚丙烯酰胺凝胶,待电泳结束,将蛋白转移至硝酸纤维素膜,100 V电压下转膜80 min;将质量浓度为50 g/L脱脂牛奶室温封闭1 h后,先后与特异性抗ACE2多克隆抗体、Caspase-3多克隆抗体在4 ℃孵育过夜,用辣根过氧化物酶连接的二抗孵育,X光片曝光和洗片。
1.5 MTT法检测细胞增殖情况使用CCK-8试剂盒(日本Dojindo公司),通过检测WST-8的剪切水平观察各处理细胞的增殖情况。具体方法如下:将BxPC3/ACE2(实验组)、BxPC3/GFP(阴性对照组)和BxPC3(空白对照组)三组样本,以每组5×103细胞接种于96孔板,分别培养24、48、72 h后,每孔加入10 μl CCK-8试剂,继续孵育4 h,酶标仪测定溶液在450 nm处的吸光度值(OD450)。
1.6 克隆形成实验配制终浓度约0.3%的琼脂,将细胞(2 000个细胞、体积为1 ml)在37 ℃、体积分数为5%的CO2及饱和温度湿度环境下培养2周;取出6孔板,每孔加入70%乙醇3 ml固定60 min;吸出乙醇,加入质量浓度为2 g/L的结晶紫染色30 min;70%乙醇脱色,倒置显微镜计数含50个细胞以上的克隆,并计算克隆形成率。
1.7 胰腺癌细胞的凋亡检测
1.7.1 流式细胞仪:收集实验组、空白对照组及阴性对照组细胞各1×106个。70%冰乙醇固定,100 μg碘化丙啶(PI,250 μg/ml,美国Sigma公司)染色,4 ℃避光30 min,流式细胞仪(EPICS XL,Coulter)检测24、48、72 h三个时间点的细胞周期。本实验重复3次。
1.7.2 Capase-3蛋白检测:详见1.4 Western blotting检测。
1.8 统计学处理采用SPSS 13.0软件进行统计学分析。多组间均数比较采用单因素方差分析(one-way ANOVA),多组间均值的两两比较采用SNK法。P<0.05为差异有统计学意义。
2 结果
2.1 ACE2在各组胰腺癌细胞中的表达Western blotting显示,实验组BxPC3/ACE2细胞中ACE2蛋白的表达水平明显高于阴性对照组和空白对照组细胞,两对照组间的ACE2蛋白水平低且差异无统计学意义,说明稳定过表达ACE2的胰腺癌细胞株BxPC3/ACE2构建成功。
2.2 MTT法检测细胞增殖情况分别在细胞培养24、48、72 h后检测细胞增殖情况。结果提示:在48 h和72 h两个时间点,实验组的OD值与阴性对照组和空白对照组相比均有下降,差异均有统计学意义(P<0.05),提示ACE2基因过表达后,BxPC3细胞的增殖能力明显受到抑制(见表1)。
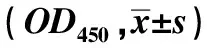
表1 不同处理组细胞的增殖能力
2.3 ACE2过表达对胰腺癌细胞体外成瘤性的影响
克隆形成实验结果显示,细胞培养于软琼脂16 d后,实验组、阴性对照组和空白对照组三组细胞的克隆形成率分别为(7.3±1.2)%、(17.2±3.5)%和(15.3±3.1)%,差异有统计学意义(P<0.05)。与两对照组相比,实验组不仅形成的克隆数目少,且克隆的体积也相对较小(见图1)。
图1 各组克隆形成情况
2.4 胰腺癌细胞凋亡检测
2.4.1 ACE2过表达对胰腺癌细胞周期的影响:为了分析ACE2在体外抑制胰腺癌细胞BxPC3增殖的原因,我们检测了24、48、72 h三个时间点不同处理组的细胞周期变化情况(见表2)。结果显示,与阴性对照组和空白对照组细胞相比,实验组细胞的周期分布发生明显改变:其处于G1调控点的细胞比例增加,而S期细胞比例减少,与两对照组相比,差异有统计学意义(P<0.05)。
表2 培养72 h后不同处理组细胞的细胞周期分布
2.4.2 ACE2对血清撤除诱导的细胞凋亡的影响:本研究采用撤除血清作为诱导细胞凋亡的诱因。Caspase-3的免疫印迹显示,从血清撤除后24 h开始,实验组即出现典型的Caspase-3条带,提示 ACE2基因促进了胰腺癌细胞BxPC3细胞在血清撤除后的凋亡(见图2)。
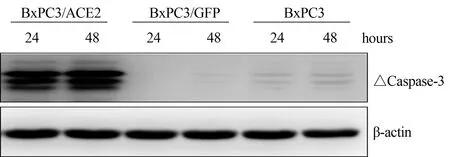
图2 各组细胞在血清撤除24、48 h的Caspase-3检测
3 讨论
RAS系统是人体重要的激素系统之一,主要包括肾素、ACE、血管紧张素原和血管紧张素Ⅱ,用于协调血压及细胞外液量的平衡。除全身性RAS系统外,在心血管等器官组织中还存在相对独立的局部RAS系统,通过旁分泌和(或)自分泌方式参与机体的生理活动[4]。近年来研究[5]发现,人胰腺组织局部同样具备独立作用的RAS系统,其整体功能失调可能参与了部分胰腺疾病的发病过程。
ACE2作为RAS家族的新成员,是与ACE具有同源性的Ⅰ型跨膜金属羧肽酶,在RAS中发挥关键作用。最近,因ACE2作为SARS或SARS-CoV-2感染人体的关键分子,再次受到研究人员的关注[2]。ACE2在心脏、肺、肾脏和胃肠道都有表达,因此通过该靶点进行感染的病毒不仅会在呼吸道中引发病变,也会引起一系列消化道症状。近期初步研究也认为,SARS-CoV-2引起的重症患者多脏器功能衰竭与ACE2的病毒受体功能有密切关联。ACE2通过水解AngⅠ羧基端脯氨酸与苯丙氨酸之间的肽键,生成Ang-(1-7),Ang-(1-7)通过其特异性Mas受体及与激肽系统的交互作用发挥其拮抗AngⅡ的作用。近年来研究发现,RAS系统中的不同成员在肿瘤发病中可能起到了不同生物学效应[6-9]。譬如,本课题组既往研究[3]发现,胰腺导管癌组织中ACE2蛋白表达与癌旁正常胰腺组织相比,明显下降,提示胰腺组织局部ACE2表达缺失可能在胰腺癌的发病过程中起了一定的促进作用。
本研究中,我们首先建立稳定高表达ACE2基因的BxPC3细胞,观察ACE2基因对BxPC3细胞在体外增殖及成瘤性的影响。结果显示,细胞培养48 h以后,稳定高表达ACE2的胰腺癌细胞株增殖速度明显减慢,与空白对照组及阴性对照组相比差异有统计学意义。接下来,我们采用克隆形成实验观察各组细胞在体外的成瘤性。结果显示,与两对照组相比,BxPC3/ACE2组不仅形成的克隆数目少,而且克隆的体积也相对较小,进一步证实ACE2在体外具有抑制胰腺癌细胞BxPC3增殖及成瘤的能力。为了探讨相关机制,我们通过流式双染AnnexinⅤ/PI法和Caspase-3蛋白检测探讨各组细胞在血清撤除后的自然凋亡情况。细胞凋亡是细胞为维持内环境稳定,更好地适应生存环境而主动形成的一种自我死亡过程,它涉及一系列基因的激活、表达、调控等作用。流式细胞仪分析细胞周期显示,ACE2基因对胰腺癌细胞的有丝分裂起到抑制作用,当细胞换代培养至72 h,稳定高表达ACE2的胰腺癌细胞的凋亡率与空白及阴性对照组相比,差异均有统计学意义。Caspase-3是细胞凋亡过程中最主要的终末剪切酶,也是位于哺乳动物细胞凋亡通路下游关键的死亡蛋白酶。胞质中的Caspase-3在正常情况下以无活性的酶原形存在,细胞凋亡信号出现后可导致Caspase-3裂解、活化,活化的Caspase-3进一步导致蛋白酶级联切割放大,最终使细胞走向死亡[10]。本研究中,我们采用了撤除血清诱导凋亡的方法,避免了相关药物诱导的细胞毒性作用。结果显示,与对照组相比,实验组自血清撤除的24 h开始,即显示出典型的Caspase-3剪切片段,提示ACE2基因促进了胰腺癌细胞在体外的凋亡过程。以上实验结果表明,ACE2在体外作用于BxPC3细胞,无论在抑制细胞的增殖方面,还是诱导凋亡方面,均有明显促进作用。
综上所述,本研究显示,ACE2蛋白可通过促进胰腺癌细胞BxPC3的凋亡过程,进而抑制胰腺癌细胞BxPC3在体外的增殖及成瘤能力。ACE2基因作为RAS系统新成员,在越来越多的疾病中受到人们关注,也有望成为胰腺癌治疗的新靶点。进一步深入探讨ACE2在胰腺癌发病学中的生物学功能是必要的。

