lncRNA NEAT1调控肝癌干细胞扩增及自我更新的机制研究
刘 晨,季 丹,孙立娜,孙雪珊,孟庆彩
保定市第一医院检验科,河北 保定 071000
肝癌是世界范围内最常见的恶性肿瘤之一,具有较高的发病率和死亡率[1-2],而我国肝癌发病率和病死率位居前列。目前,由于诊断肝癌的特异性指标灵敏性低,发现时已处于晚期,治疗后出现复发、转移和耐药现象,患者的生存率仍然很低。因此,我们亟需寻找新的肝癌诊断标志物及治疗靶点。随着研究的深入,发现肿瘤细胞中存在一小部分具有干细胞特性的肿瘤细胞即肿瘤干细胞(cancer stem cells,CSCs)。CSCs具有自我更新能力和多向分化潜能[3-4],是肿瘤发生发展、侵袭转移及复发耐药的根源所在。长链非编码RNA(long non-coding RNA,lncRNA)是一类转录本长度>200 nt、无蛋白质编码功能、缺少开放阅读框(open reading frame,ORF)的功能性RNA分子,与CSCs的干性特征、扩增、自我更新及分化有一定的关系。lncRNA NEAT1在2007年由Hutchinson等[5]首次发现,其主要位于细胞核内,是亚细胞结构核旁斑的重要组成部分,参与形成和维持核旁斑。lncRNA NEAT1表达与细胞的分化程度有关,在调控CSCs生物学功能中发挥重要作用。肝癌干细胞(liver cancer stem cells,LCSCs)同样存在于肝癌中,参与了肝癌的发生发展和复发耐药[6]。因此,本研究分析lncRNA NEAT1在LCSCs的表达,探讨其作为肝癌诊断及预后判定标志物的可行性;并探究过表达lncRNA NEAT1对LCSCs扩增及自我更新的调控及其机制;旨在为LCSCs的调控机制提供新的理论基础,为肝癌的诊疗提供新靶标和策略。
1 材料与方法
1.1 试验材料肝癌细胞培养:人肝癌细胞系HCCLM3细胞购自中国科学院上海细胞典藏库,用含质量浓度为100 g/L FBS的DMEM完全培养基(Hyclone),置于37 ℃体积分数为5% CO2浓度的培养箱中进行培养。待细胞汇合度为80%左右时,进行传代培养。
LCSCs获得:取对数生长期HCCLM3细胞,以5 000个/孔接种于6孔低黏附培养板中,用不含FBS的DMEM/F12培养,同时辅以B27(1∶50)(Invitrogen)、20 ng/ml EGF(Peprotech)、10 ng/ml bFGF(Invitrogen)和4 mg/ml胰岛素(Sigma),置于37 ℃、体积分数为5% CO2孵箱中培养7 d,当细胞球直径为50 μm时,添加质量浓度为2.5 g/L的胰酶将细胞球消化,得到LCSCs。
1.2 细胞转染以pCDH-CMV质粒为载体,构建NEAT1过表达慢病毒质粒(pCDH-CMV-NEAT1)及阴性对照质粒(pCDH-CMV-NC),用三质粒系统进行NEAT1过表达慢病毒包装。LCSCs细胞密度调整为2×105ml-1,接种于6孔板中,DMEM完全培养基培养,用10个感染复数病毒感染细胞,建立稳定表达NEAT1的肝癌细胞系及对照细胞系,48 h后采用qRT-PCR检测不同病毒的感染效率。
1.3 总RNA的提取及荧光定量PCR收集细胞,采用Trizol试剂(Life Technologies)提取总RNA,微量分光光度计检测总RNA纯度和浓度。以总RNA为模板,用反转录试剂盒(Promega)反转录为cDNA,ABI 7500荧光定量PCR仪上进行qRT-PCR检测各组细胞lncRNA NEAT1相对表达量。qRT-PCR反应体系为:1 μl cDNA,1 μl上游/下游引物混合物(5 μmol/L),5 μl 2×SYRB Green Master,3 μl Milli Q水,总体积10 μl。lncRNA NEAT1上游引物序列为5′-GGGTGGTCTGAGGAGTGATG-3′,下游引物序列为5′-CCTGGAAAATAAAGCGTTGGT-3′,内参照GAPDH上游引物为5′-TGAACGGGAAGCTCACTGG-3′,下游引物为5′-TCCACCACCCTGTTGCTGTA-3′,经生物信息库查找由Invitrogen公司设计合成。qRT-PCR反应条件为:95 ℃预变性10 min;扩增循环:95 ℃变性15 s、60 ℃退火30 s、72 ℃延伸35 s,进行40个循环;72 ℃终末延伸10 min。以GAPDH作为内参,采用公式2-ΔΔCT定量分析lncRNA NEAT1的相对表达量,△Ct=Ct(目的基因)-Ct(内参),△△Ct =△Ct(处理组)-△Ct(对照)。
1.4 流式细胞仪检测LCSCs扩增收集细胞,以2×105/孔接种于6孔板中,24 h后用胰蛋白酶消化细胞,以1 000 r/min离心3 min,用PBS重悬后,以1 000 r/min离心3 min,收集细胞沉淀。按1∶50比例用PBS稀释流式抗体(EpCAM抗体及CD133抗体)(Mitenyi Biotec)及其对照抗体,总体积100 μl加入细胞沉淀中,轻弹混匀,4 ℃孵育30 min,每5 min间隔轻弹混匀;用PBS重悬离心洗2遍后,加入200 μl PBS重悬,用尼龙网过滤至流式检测管中,流式细胞仪检测并分析EpCAM+和CD133+细胞亚群比例。
1.5 细胞克隆形成能力的检测收集细胞,按50个/孔接种于24孔板,用含质量浓度为100 g/L FBS的DMEM完全培养基(Hyclone)培养,置于37 ℃,体积分数为5% CO2的培养箱中进行培养,每3~4 d更换1次新鲜培养液。根据不同细胞的生长状况,7 d后对克隆进行染色。弃去培养基,甲醇(国药集团化学试剂有限集团)室温固定10 min,弃去甲醇,水洗,超净台中吹干,质量浓度为5 g/L的结晶紫溶液染色120 min,弃去结晶紫溶液,水洗,风干。拍照记录细胞克隆情况,计算克隆形成率(以50个细胞以上的群体为1个克隆),克隆形成率=(平均克隆形成个数/接种细胞数)×100%。
1.6 细胞成球生长能力的检测收集细胞,按20个/孔接种于低黏附的96孔板中,用含质量浓度为5 g/L FBS的成球培养基DMEM/F12培养,同时辅以B27(1∶50)(Invitrogen)、20 ng/ml EGF(Peprotech)、10 ng/ml bFGF(Invitrogen)和4 μg/ml胰岛素(Sigma),置于37 ℃、体积分数为5% CO2孵箱中培养,每3~4 d补加1次新鲜培养液。根据细胞生长状况,7 d后在显微镜下观察统计细胞成球数量(直径>75 μm)和体积,计算细胞成球率,成球率=(平均细胞球数/接种细胞数)×100%。
1.7 蛋白印迹实验收集细胞,蛋白裂解液裂解细胞,提取总蛋白,BCA检测试剂盒(Pierce)测定总蛋白浓度。配制质量浓度为100 g/L的分离胶,取20 μg总蛋白进行SDS-PAGE,经质量浓度为100 g/L的分离胶分离蛋白后,转于PVDF膜上,质量浓度为50 g/L的脱脂牛奶室温封闭1 h,添加一抗孵育,辣根过氧化物酶(HRP)标记抗体,抗体p-LATS1、p-YAP按1∶1 000稀释,GAPDH抗体按1∶5 000稀释,4 ℃孵育过夜,TBST洗膜3次,加入HRP标记的羊抗鼠/兔二抗(1∶5 000),室温孵育2 h,TBST洗膜3次。加入ECL显色,暗室中曝光成像,以GAPDH作为内参,使用Gene Tools图像分析系统对目的蛋白的灰度值进行分析。

2 结果
2.1 lncRNA NEAT1在LCSCs中高表达利用qRT-PCR检测从肝癌细胞HCCLM3中富集的LCSCs与肝癌细胞HCCLM3中NEAT1表达差异,结果显示,与HCCLM3细胞相比,NEAT1在LCSCs中的表达水平显著升高(P<0.05,见图1),提示NEAT1可能与LCSCs的“干性”有关。
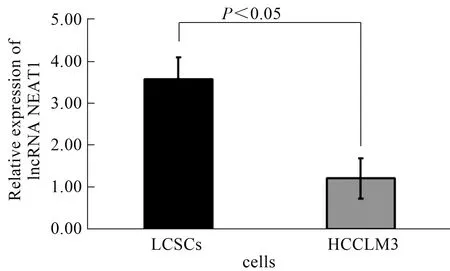
图1 LCSCs与肝癌细胞HCCLM3中NEAT1表达情况
2.2 lncRNA NEAT1过表达细胞模型的建立分别用过表达lncRNA NEAT1的慢病毒及对照慢病毒感染LCSCs,建立稳定过表达lncRNA NEAT1的LCSCs系及对照细胞系,qRT-PCR检测慢病毒的感染效率,结果显示,感染过表达lncRNA NEAT1慢病毒的LCSCs中lncRNA NEAT1的相对表达量显著高于对照感染(P<0.001,见图2),表明过表达lncRNA NEAT1的慢病毒的感染效率高,可作为稳定的过表达细胞模型进行后续实验。
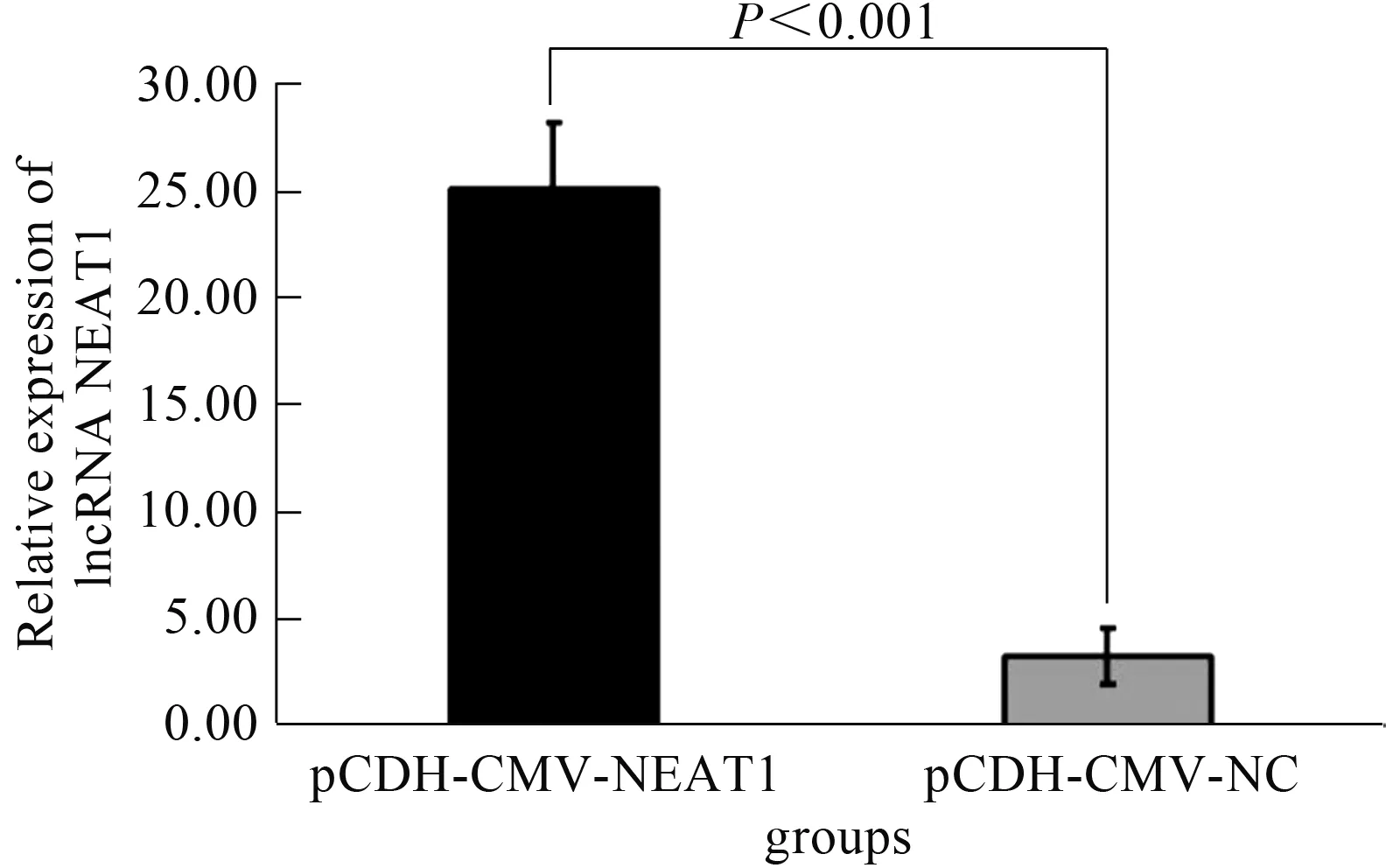
图2 慢病毒过表达lncRNA NEAT1表达水平效率验证
2.3 过表达lncRNA NEAT1促进LCSCs的扩增流式细胞术检测过表达lncRNA NEAT1细胞及其对照细胞中LCSCs的比例变化,结果显示,与对照组相比,lncRNA NEAT1过表达组肝癌细胞中EpCAM+和CD133+的LCSCs细胞亚群比例明显增多(P<0.05,见图3),提示过表达lncRNA NEAT1可以促进LCSCs的扩增。
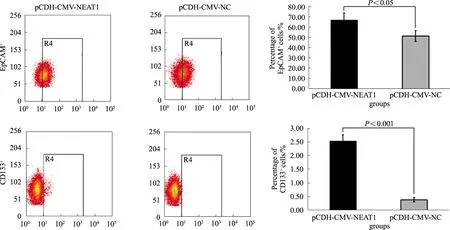
图3 过表达lncRNA NEAT1对肝癌细胞中LCSCs比例的影响
2.4 过表达lncRNA NEAT1促进LCSCs的自我更新克隆形成实验和细胞成球实验检测过表达lncRNA NEAT1对肝癌细胞自我更新能力的影响,细胞成球实验发现,与对照组细胞相比,过表达lncRNA NEAT1后,细胞成球率显著升高(P<0.001,见图4),且成球体积增大;克隆形成实验显示,过表达lncRNA NEAT1的细胞,其单细胞克隆形成率明显增强(P<0.05,见图5)。以上结果提示,过表达lncRNA NEAT1能够促进LCSCs的自我更新。

图4 过表达lncRNA NEAT1对LCSCs成球能力的影响(放大200倍)

图5 过表达lncRNA NEAT1对LCSCs克隆形成能力的影响(放大200倍)
2.5 过表达lncRNA NEAT1活化Hippo信号通路Western blotting检测过表达lncRNA NEAT1对Hippo信号通路中关键蛋白LATS1和YAP蛋白磷酸化水平的影响,结果显示,与对照细胞相比,过表达lncRNA NEAT1后,YAP及其上游分子LATS1的磷酸化水平明显减弱(P<0.05,见图6)。YAP磷酸化后会滞留于细胞质中或被降解,去磷酸化后的YAP才能从细胞质中转移到细胞核内发挥转录调控作用,YAP磷酸化水平的减弱表明lncRNA NEAT1的过表达缓解YAP滞留于细胞质,促进其核转位活化,活化Hippo信号通路。
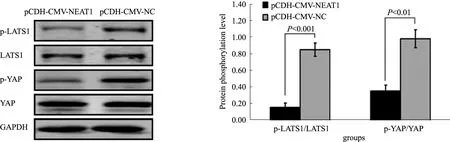
图6 过表达lncRNA NEAT1促进Hippo信号通路活化
3 讨论
近年来,越来越多的研究在众多实体瘤中均发现了CSCs的存在,其具有干细胞自我更新及分化等特点,且具备更强的侵袭性及耐药性,是癌症复发、转移的重要因素之一[7]。目前,传统的手术切除、放化疗及分子靶向治疗是肝癌治疗的主要方式,然而这些传统治疗手段往往不能彻底根除LCSCs。LCSCs是肝癌肿瘤细胞中存在的小部分亚群细胞,对肝癌的发生发展起至关重要的作用。因此,探索LCSCs的分子机制,发现可能的针对性治疗靶点对肝癌的治疗非常重要。
LCSCs具有更强的侵袭性和耐药能力,是导致肝癌复发、转移、根治困难的重要原因之一[8]。Phi等[9]研究发现,抗肿瘤药物的施加使肿瘤细胞置于药物胁迫之下,肿瘤细胞突变从而产生耐药现象,而这种耐药突变很可能源于CSCs,且在向成熟肿瘤细胞分化过程中维持耐药性。越来越多的证据表明,lncRNAs会根据细胞不同的分化状态及细胞类型特异性表达[10-11],lncRNAs的异常表达在肿瘤的CSCs生物学过程中发挥着重要的调节作用[12-13]。lncRNA NEAT1由11号染色体转录而来,是亚细胞结构核旁斑的一个重要组成部分,参与形成及维持核旁斑[14]。研究表明,lncRNA NEAT1的表达与细胞的分化程度有关,其在胚胎干细胞、肌细胞、神经细胞分化过程中随分化进展逐渐上调[15]。CSCs往往处于低分化状态,向成熟肿瘤细胞状态分化,提示NEAT1在CSCs与肿瘤细胞中的表达水平可能存在差异,且可能发挥不同的作用。本研究通过对HCCLM3细胞低黏附成球培养富集LCSCs,qRT-PCR检测LCSCs和HCCLM3细胞中lncRNA NEAT1的表达差异,结果显示,NEAT1在LCSCs中表达显著上调,且LCSCs被认为是肝癌的起源,提示lncRNA NEAT1在肝癌发生的早期可能发挥作用,为lncRNA NEAT1作为肝癌早期诊断标志物提供了可能性。
报道指出,lncRNA NEAT1可以调控干性细胞的相关生物学功能,控制肿瘤的起始发生与进展。Yang等[16]研究发现,lncRNA NEAT1在CD133+的胶质瘤细胞中高表达,敲低lncRNA NEAT1表达抑制CD133+胶质瘤细胞的软琼脂克隆形成能力。Jiang等[17]发现,干扰lncRNA NEAT1的表达,非小细胞肺癌形成的干细胞球中干性相关转录因子的表达下降。Wang等[18]研究发现,lnc-DILC在LCSCs中低表达,可以通过结合于IL-6的启动子区,调控IL-6/STAT3自分泌信号通路来抑制LCSCs的自我更新。本研究通过转染慢病毒建立lncRNA NEAT1过表达细胞模型,通过流式细胞仪检测、克隆形成实验和细胞成球实验检测证实lncRNA NEAT1的过表达可以促进LCSCs的扩增及自我更新功能,表明lncRNA NEAT1在LCSCs中高表达不仅仅是一种生物学现象,而且对于LCSCs的扩增及自我更新的维持具有重要调控作用。
Hippo信号通路是近年来备受关注的一条信号通路,在癌症环境中可以调控干性或前体细胞的命运转化和分化影响癌症的发生、发展[19]。Hippo信号通路中,LATS1蛋白被上游信号激活磷酸化后与MOB1形成复合物,进而使转录共激活因子YAP磷酸化,磷酸化后的YAP会被酪氨酸3-加单氧酶/色氨酸5-加单氧酶激活蛋白(14-3-3蛋白)滞留于细胞质中,从而发生泛素化降解,使YAP无法进入细胞核发挥转录激活作用[20-21]。Qu等[22]研究发现,lncARSR通过与LATS竞争性结合YAP来促使YAP发生核转位,促进肾癌CSCs的扩增。本研究利用Western blotting检测了过表达lncRNA NEAT1对YAP及其上游调控蛋白LATS1的磷酸化水平的影响,结果显示,过表达lncRNA NEAT1后抑制LATS1、YAP的磷酸化,使YAP去磷酸化,促进其核转位活化,进而活化Hippo信号通路。本研究结果显示,NEAT1可能通过调控Hippo信号通路关键蛋白磷酸化来实现对LCSCs的扩增及自我更新功能,为肝癌的诊治提供了新的理论依据。然而LCSCs调控过程复杂且包含多种信号通路,Hippo/YAP通路对CSCs特异性的调控机制尚处于起步阶段,且目前有关LCSCs中lncRNAs调控Hippo通路的研究较少,因此本研究还需进一步探究证实。此外,lncRNAs较长的核酸长度往往易形成二级结构,通过与多种蛋白质、DNA或RNA结合调控基因表达[23]。研究[24]表明,NEAT1可通过与多种蛋白质结合参与形成核旁斑。既往相关研究[18]发现,lnc-DILC可直接结合IL-6启动子,通过抑制IL-6/STAT3自分泌信号通路调控LCSCs的扩增。基于此我们推测NEAT1可能也通过结合某种特定蛋白调控Hippo通路。而有研究[25]又表明,蛋白激酶A(PKA)可引起Hippo通路关键蛋白LATS1/2及YAP磷酸化,激活Hippo通路,调节细胞增殖、分化。是否又可猜测NEAT1与PKA间可能存在某种必然联系调控Hippo信号通路参与LCSCs的扩增及更新。以上推测此前尚未见有较多研究报道,NEAT1通过怎样的结合路径调控Hippo通路影响LCSCs的扩增及自我更新功能还需后期继续深入探究,也是后期研究的方向及展望。再者近年来既往大量研究已证明CSCs对众多疾病的进展、转移、复发及治疗耐药性存在影响且得到一致认可,并证实部分lncRNAs、miroRNAs及蛋白等通过Wnt/β-catenin、TGF-β、Notch及Hedgehog等信号通路调控参与LCSCs的扩增及自我更新,促进EMT及干细胞表型的获得,且已鉴定出多种LCSCs表面标志物。现有研究仍不能通过独立的一种分子标志物将LCSCs高纯度分离,干细胞多种分子调控机制尚未完全清楚,关于LCSCs的研究也大都基于体外实验获得,缺乏体内微环境,将所得成果直接用于临床是否能够获得同样成效目前也尚不得知,预示肝癌的治疗仍需经历漫长的实践探索路程。
综上所述,lncRNA NEAT1在LCSCs中显著高表达,过表达NEAT1促进LCSCs的扩增及自我更新能力,可能通过活化Hippo信号通路来实现,初步阐明了NEAT1对LCSCs扩增及自我更新的调控作用机制,为肝癌的诊断治疗提供了新的理论依据。

