非小细胞肺癌中靶向RET、FGFR融合基因的研究进展
钟炜祥 韦晰凤
1赣南医学院第一附属医院心胸外科(江西赣州341000);2赣州市妇幼保健院(江西赣州341000)
肺癌已成为我国癌症相关发病率和病死率第1 的恶性肿瘤,80%~85%的肺癌属于非小细胞肺癌(non-small cell lung cancer,NSCLC),后者主要包括肺腺癌(lung adenocarinoma,LADC)和肺鳞状细胞 癌(lung squamous cell carcinoma,LSQCC)。NSCLC 的治疗目前已跨入个体化靶向精准治疗的时代,以表皮生长因子受体(EGFR)和间变性淋巴瘤激酶(ALK)、C-ros 原癌基因1-受体酪氨酸激酶(ROS1)融合基因作为分子靶点的靶向药物(如吉非替尼[1]、厄洛替尼[2]、克唑替尼[3]等)针对性强、疗效可靠、不良反应轻,极大地改善了患者的预后。融合基因变异也因此成为了当前肺癌分子靶向治疗研究的热点。
转染时发生重排(rearranged during transfection,RET)融合基因是在NSCLC 患者中继EGFR、ALK等基因之后发现的新型突变基因,研究[4]表明RET 融合基因可能是EGFR、ALK、ROS1 均未突变肺癌患者的主要发病途径,抑或是此类NSCLC患者致病的新靶点。目前,高选择性RET 抑制剂BLU-667 和LOXO-292 均取得了重大突破,值得期待。
表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKIs)的出现使LADC 的靶向治疗成为现实。但由于LSQCC 的EGFR 突变和ALK、ROS1 重排率低,除了传统的手术、化疗、放疗外,目前仍缺乏有效的靶向治疗。因此,积极致力于LSQCC 的相关驱动基因的研究,找寻潜在的治疗靶点,以实现LSQCC 患者的个体化靶向精准治疗。成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)作为LSQCC 中突变频率最高的酪氨酸激酶家族基因[5],FGFR 基因融合后,细胞的FGFR 激酶区活性增强[6],进而诱发肿瘤的产生和发展。研究[7]亦表明,FGFR 抑制剂可以抑制FGFR3-TACC3融合基因的酪氨酸激酶活性。因此,FGFR 融合基因,特别是FGFR3-TACC3 已成为LSQCC 切实可行的治疗靶点,有望LSQCC 靶向治疗的新方向。
2019年ASCO年会上公布了高选择性RET 抑制剂BLU-667 的最新研究成果和FGFR-TACC 融合基因图谱,受到广泛关注。本文围绕RET、FGFR基因的生物学特性,NSCLC 中RET、FGFR 基因融合的临床病理特征和RET、FGFR 抑制剂在NSCLC靶向治疗中的应用前景进行综述。
1 RET 融合基因
1.1 RET 基因的生物学特性RET 基因是在NSCLC 患者中继EGFR、ALK 等基因之后发现的新型突变基因,位于第10 号染色体(10q 11.2),长约60 kb,含21 个外显子,编码RET 蛋白,后者是由1 143 个跨膜氨基酸残基构成的蛋白聚合体,属于酪氨酸激酶(TK)受体。作为RET 蛋白的配体,胶质细胞衍生的神经营养因子家族(包括GDNF、NINneuturin、ART artimin、PSP persephin)通过糖基化的磷脂酰锚定蛋白与RET 蛋白结合,使后者的酪氨酸激酶区出现磷酸化,进而激活下游包括磷脂酶C、磷脂酰肌醇3-激酶和RAS/有丝分裂原激活蛋白激酶途径等多条信号转导通路[8],最终调节细胞生存和诱导细胞增生。
RET 基因的融合突变是通过第10 号染色体上的臂间倒位并致RET 基因断裂,结合其他基因发生重组,最终形成新的融合基因,后者可直接导致酪氨酸酶自身活化,自发向细胞内传递信息,最终诱使细胞增殖过度并生成肿瘤。
1.2 NSCLC 中RET 基因融合的临床病理特征RET 融合基因于2012年在NSCLC 中首次发现,发生概率维持在1%~2%[9-11]。CONG 等[9]通过检索The PubMed,SpringerLink 等数据库入组了13 篇论文,纳入8 859 个病例,检测出169例RET 融合基因,阳性表达率为1.91%,其中121例为KIF5BRET,后者多为女性且相对年轻(<60 岁)。同时指出RET 基因融合在非吸烟LADC 患者中常见。自发现以来,RET 融合基因被认为与其他突变基因相互排斥,但越来越多研究[12-13]证实RET 融合基因可与EGFR、MAP2K1、CTNNB1、AKT1、TP53、SETD2 及MET 扩增等基因变异共存,LU 等[13]还指出合并TP53 突变的RET 基因融合NSCLC 患者OS更短。此外,有研究表明RET 基因融合可能是导致一代EGFR-TIKs[14]和Osimertinib[15](三代EGFRTIKs)获得性耐药的机制之一。
RET 基因在NSCLC 能与多种异源上游伴侣基因发生融合[16],其中KIF5B-RET 型最常见,其次为CCDC6-,其余为RET少见融合类型。目前在NSCLC中至少发现了23 种少见的RET 融合类型[17-27]。
1.3 RET 抑制剂在NSCLC 靶向治疗中的应用前景目前尚无特异性的RET 抑制剂上市,但一些多靶点抑制剂(MKIs)可以覆盖RET 基因融合靶向治疗。根据MKIs 的作用机制不同分为:可与活化的RET 激酶结合的Ⅰ型抑制剂(vandetanib 和sunitinib)和与非活化的RET 激酶结合的Ⅱ型抑制剂(cabozantinib、sorafenib、ponatinib 等)。
表1列出了单一MKI 在晚期预处理的RET 基因融合NSCLC 中的Ⅱ期单臂临床试验,Sorafenib研究中入组3例患者,其中1例稳定(SD),2例进展(PD),没有表现出明显的疗效;Cabozantinib、Vandetanib、Lenvatinib 在RET 基因融合晚期NSCLC患者中的客观缓解率(ORR)为16%~53%,中位无进展生存期(mPFS)为(4.5~7.3)个月,均劣于针对EGFR/ALK/ROS1 驱动基因抑制剂(在EGFR/ALK/ROS1 阳性的NSCLC 患者中[28-30],其对应抑制剂治疗的ORR分别为56%~85%、65%~90%、65%~85%,mPFS 分别为(9.2~13.7)、(8~11)、(9.3~19.3)个月。其中,Vandetanib 的两个Ⅱ期临床试验来自日本和韩国,发现CCCD6-RET 病例接受Vandetanib 治疗可获得比KIF5B-RET 更高的ORR。2017年,一项全球多中心的回顾性研究[16]分析了RET 基因融合晚期NSCLC 患者接受多种MKIs 治疗的效果,结果显示Cabozantinib、Vandetanib、Sunitinib 治疗组的ORR 分别为37%、18%及22%,mPFS分别为3.6、2.9、2.2 个月,mOS 分别为4.9、10.2、6.8 个月;而在Sorafenib、Alectinib、Ponatinib、Regorafenib 治疗组均未见完全或部分缓解的病例。这些研究结果表明目前常见的靶向RET 基因的MKIs 疗效有限,考虑可能同时存在MDM2 扩增[31]或RET S904F 突变[32]或守门突变V804M/L[33]等因素,进而导致MKIs 获得性耐药,有待进一步考证。此外,Alectinib(NCT03131206 和UMIN000020628),sunitinib(NCT01829217)、ponatinib(NCT01813734)及Apatinib(NCT02540824)等MKIs 正在进行Ⅰ~Ⅱ期临床试验,期待它们最终的研究结果。
新型高选择性RET 抑制剂BLU-667 和LOXO-292 应运而生并取得了重大突破。目前针对BLU-667 和LOXO-292 正在进行两个Ⅰ期临床试验:ARROW(NCT03037385)和LIBRETTO-001(NCT03 157128),2018年研究者分别在ASCO 和AACR年会上公布了前期结果:LOXO-292 的ORR 为68%,BLU-667 的ORR 为50%[38-39]。在2019 ASCO年会上,研究者更新了ARROW 研究中BLU-667 治疗RET 融合阳性NSCLC 患者的进一步研究[40]结果,在48例有可测量病灶且至少进行过一次随访评估的患者中,ORR 为58%(1例完全缓解(CR),27例部分缓解(PR),18例SD,2例PD,疾病控制率(DCR)为96%(46/48);在既往接受过铂类化疗的35例患者中,其ORR 高达60%(1例CR,20例PR,14例SD),DCR 为100%。Ⅰ期临床试验结果显示,LOXO-292和BLU-667在RET 融合阳性晚期NSCLC患者中具有强效、持久和广泛的抗肿瘤活性,除了常见的KIF5B-RET,对各种潜在的RET 耐药变异如CCDC6-RET 融合、RET 点突变C634W、M918T、V804L/M等均有很好的抑制[39,41]。二者入脑能力很强,对颅脑转移瘤有效,而且耐受性良好,均获得FDA“突破性疗法”认定,是目前精准靶向治疗的选择。
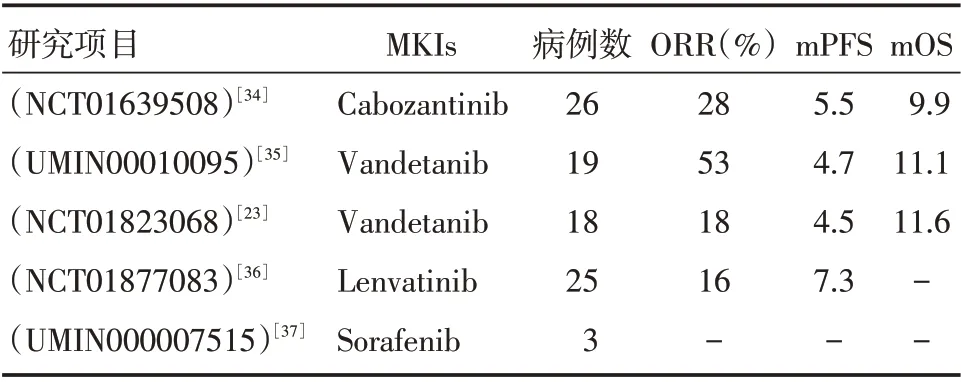
表1 晚期预处理的RET 重排的NSCLC 中单一MKI 的Ⅱ期临床试验Tab.1 Ⅱphase clinical trials of single MKI in advanced RET-positive NSCLC pre-treated
2 FGFR 融合基因
2.1 FGFR 基因的生物学特性FGFR 属于一类跨膜酪氨酸激酶受体家族(由胞外区,跨膜区及具有TK 的胞内区构成),为单链糖蛋白分子[相对分子质量为(1.1~1.5)×105],一共包括FGFR1、FGFR2、FGFR3、FGFR4 及FGFRL1(其中,FGFR1-4 具有酪氨酸激酶区域,FGFRL1 无蛋白酪氨酸激酶区域)。成纤维细胞生长因子(FGFs)是FGFRs 的配体,目前已发现23 个FGFs(FGF1-FGF23)。FGFRs依赖于细胞表面的核心结合位点HSPG 结合FGFs形成二聚体,FGFR 胞内区TK 残基接着发生磷酸化,进而激活Ras-Raf-Mapk、P13K-Akt、Stats 和PLCr 四条主要下游信号通路产生生物学效应[42],导致肿瘤的发生和转移瘤的增长。
2.2 NSCLC 中FGFR 融合基因的临床病理特征纵览近5年有关NSCLC 中FGFR 基因融合的相关文献[43-46],FGFR1-4 基因融合在NSCLC 中的发生概率维持在0.1%~1.3%,至少发现20 种不同的FGFR 融合形式,其中FGFR3-TACC3 是最常见的融合类型。蔡修宇教授在2019年ASCO年会上报道了一项亚洲人群NSCLC 中FGFR-TACC 融合基因融合谱的研究,在2 743例NSCLC 中发现FGFRTACC 融合16例(0.58%),其中1例FGFR1-TACC1,3例FGFR2-TACC2,12例FGFR3-TACC3 融合。蔡修宇教授认为FGFR-TACC融合作为NSCLC 的一个亚型,可能对FGFR 抑制剂(如AZD4547 等)具有潜在的临床获益可能。此外,王磊等[45]指出,FGFR融合基因在LSQCC 组阳性率高达3.4%,好发于肿瘤最大径>3 cm 的男性吸烟患者。此与以往靶基因突变多好发于不吸烟女性LADC 患者不同,为LSQCC 的靶向治疗带来了新的思路。
2.3 FGFR 抑制剂在NSCLC 靶向治疗中的应用前景目前亦无选择性的FGFR 抑制剂上市,针对FGFR 基因为靶点正处在试验研究的的药物主要包括3 类:选择性FGFR 抑制剂、FGF-FGFR 结合抑制剂(FP-1039/GSK3052230)和非选择性多靶点FGFR 抑制剂(Nintedanib、Dovitinib 等),其中选择性FGFR 抑制剂主要包括AZD4547(FGFR1-3 抑制剂)、BGJ398(FGFR1-3 抑制剂,对FGFR1 的抑制活性最强)、LY2874455(FGFR1-4 抑制剂)和JNJ-42756493(即Erdafitinib,针对FGFR1-4 的多靶点TKI)。
表2列出了FGFR 抑制剂在晚期NSCLC 中进行的Ⅰ~Ⅲ期临床试验,研究结果表明AZD4547、BJG398、Nintedanib 及Divotinib 均对FGFR 变异(特别是FGFR1 扩增)NSCLC(特别是LSQCC)表现出一定的抗肿瘤活性,ORR 维持在8%~11.5%。其中,在针对Nintedanib 治疗晚期NSCLC 多中心随机对照Ⅲ期临床试验LUME-lung1 中,一线治疗后9 个月内的LADC 患者采用Nintedanib 联合多西他赛治疗方案的OS 明显比对照组更长,研究者指出Nintedanib 联合多西他赛治疗方案可作为含铂双药一线化疗后进展的晚期NSCLC,特别是LADC患者的一个行之有效的二线治疗方案选择。此外,针对FGFR 抑制剂的临床试验如(AZD454,Ⅱ~Ⅲ期)NCT02154490、(BGJ398,Ⅰ期)NCT01697605、(Erdafitinib,Ⅱ期)NCT02699606、(FP-1039,Ⅰ期)NCT01604863;(FP-1039,Ib 期)NCT01868022)、(Dovitinib,Ⅱ期)NCT01676714 等正在进行中,结果值得期待。
作为FGFR基因常见的变异类型,FGFR基因融合后,细胞的FGFR激酶区活性增强[6],HARSHNIRA等[51]对比了FGFR 抑制剂AZD4547 和JNJ42756493对NIH3T3 细胞系中FGFR-TACC3 融合基因的治疗效果,发现1 000 nmol/L的JNJ42756493对于这种细胞的增殖具有较强的抑制作用;CAPELLETTI 等[52]利用浓度递增的BGJ398、Ponatinib 处理含有FGFRTACC3融合的Ba/F3细胞,均能有效抑制后者生长;PERERA 等[53]发现Erdafitinib 在体内的抗肿瘤活性在FGFR 基因融合模型中最突出,高于FGFR 基因扩增模型。目前对于FGFR基因融合的靶向研究绝大多数处在临床前试验阶段,现有的研究表明FGFR 抑制剂可以抑制FGFR3-TACC3 融合基因的酪氨酸激酶活性[7]。因此,FGFR 融合基因,特别是FGFR3-TACC3 融合类型确实是可行的治疗靶标,且可能相较其他FGFR 突变具有更灵敏的FGFR 靶向治疗位点。

表2 针对FGFR 抑制剂治疗NSCLC 的Ⅰ~Ⅲ期临床试验Tab.2 Ⅰ~Ⅲphase clinical trials of FGFR inhibitors in NSCLC
3 NSCLC 中融合基因的检测方法
迄今为止,尚未发现检测融合基因的特异性方法,常用的检测方法包括荧光原位杂交(FISH)、免疫组化(IHC)、逆转录聚合酶链反应(RT-PCR),其中FISH 已获FDA 批准用于在NSCLC 患者中检测ALK 融合。表3列举了基因融合或融合蛋白的常用分子诊断各种方法的优缺点。
此外,二代测序(next generation sequencing,NGS)对于近年来NSCLC 的分子诊断具有革命性的意义,具有高通量、自动化、低成本的特征,能够一次性同时检测EGFR、ALK、ROS1、RET 及FGFR等多个基因变异,同时鉴别出已知和未知的突变类型,检测敏感性高于一代测序,可以检测基因1%的低频突变。

表3 免疫组织化学、荧光原位杂交和即时荧光定量PCR(RT-PCR)检测方法的比较Tab.3 Comparison of detection methods in immunohistochemistry,fluorescence in situ hybridization and real-time fluorescence quantitative PCR(RT-PCR)
以上检测方法,特别是NGS 为临床试验研究提供技术保障。但由于NGS 技术的复杂性,NGS质量体系的标准化、规范化成为目前NGS 在临床常规开展的瓶颈,而且NGS 的收费还比较高,暂不推荐临床常规使用NGS 检测肺癌各靶向基因。
针对EGFR、ALK、ROS1 均未突变NSCLC 患者的靶向治疗是目前临床亟待解决的重点问题,深入研究RET、FGFR 等少见突变基因在NSCLC 中的靶向作用机制,是未来RET、FGFR 等少见突变基因变异的NSCLC 患者靶向治疗的新思路,有利于EGFR、ALK 基因抑制剂耐药后再次靶向治疗的靶位寻找。随着个体化精准治疗模式的广泛应用和NGS 技术的快速发展,对NSCLC 患者进行驱动基因检测是精准药物治疗的基础,常规检测RET、FGFR 等少见突变基因在NSCLC 的诊治中或将成为临床诊断共识,指导肺癌的分子靶向治疗,筛选出获益的靶向治疗人群,实现个体化精准治疗。期待L0XO-292 和BLU-667Ⅰ期临床试验的最终结果,尽快进行Ⅱ、Ⅲ期临床试验并最终获批应用于临床,给RET 重排NSCLC 患者带来积极的生存获益,弥补RET 融合变异NSCLC 现存治疗的空白;期待随着对FGFR 融合基因靶向作用机制的深入研究并开发出更多高选择性FGFR 抑制剂,从而使LSDCC 的靶向治疗也能像LADC 一样占据着举足轻重的作用,真正地为NSCLC 患者的个体化靶向治疗带来福音。

