美洲大蠊提取物对博来霉素致大鼠肺纤维化的影响
杨永寿,何正春,肖培云
(1.大理大学药学与化学学院,云南大理 671000;2.云南省昆虫生物医药研发重点实验室,云南大理 671000)
肺纤维化(pulmonary fibrosis,PF)一直是困扰人类的顽疾,症状主要表现为运动性呼吸困难、干咳等,是以弥漫性的肺泡炎、肺间质炎症和间质纤维化为组织学特点的一组疾病群,至今尚无可逆转肺纤维化的药物〔1〕。目前临床上多选用肾上腺皮质激素、干扰素、秋水仙碱等药物进行长期治疗,但这些药物副作用大,且不能有效阻止肺纤维化的进一步发展〔2〕,一旦染上,终身不愈,最终导致肺部功能丧失,活活憋死,给患者和家属造成极大的身心困扰和经济负担〔3-4〕。因此,寻找能更好治疗、延缓肺纤维化病程的药物和治疗方法,最大限度减轻病人痛苦和经济负担,提高其生活质量是目前医药工作者急需研究的课题。
美洲大蠊(Periplaneta americana)为昆虫纲有翅亚纲蜚蠊目蜚蠊科大蠊属干燥虫体,始载于《神农本草经》〔5〕,研究表明美洲大蠊提取物具有清除自由基和抑制脂质过氧化的作用〔6-7〕,过氧化反应能促进纤维化性疾病的发展,故美洲大蠊有望通过抑制机体过氧化反应达到抑制肺纤维化的目的。前期体外实验研究发现,美洲大蠊抗肺纤维化活性提取物(ML-HB)能显著抑制人胚肺成纤维细胞(HEL)生长〔8-9〕。本实验拟在前期研究的基础上,通过博来霉素(BLM)复制大鼠肺纤维化模型,研究ML-HB对BLM致大鼠肺纤维化的干预作用,为美洲大蠊抗肺纤维化的研究打下基础。
1 材料
1.1动物清洁级SD大鼠,雄性,体质量180~200 g(购于湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2013-0004,批号:20160911),自由采食和饮水,饲养环境符合GB 14952—2010《实验动物环境及设施》有关无特定病原体级的要求。
1.2试剂注射用盐酸博来霉素(以效价计15 mg∕支,Bleomycin,BLM,日本化药株式会社产品,批号:Y50512);ELISA试剂盒(大鼠肿瘤坏死因子-α(TNF-α),欣博盛生物科技有限公司,批号:R160729-102a;大鼠转化生长因子-β1(TGF-β1),欣博盛生物科技有限公司,批号:R160831-107a);鼠抗α-平滑肌肌动蛋白(α-SMA)单克隆抗体(英国abcam公司);兔抗Ⅰ型胶原蛋白(ColⅠ)多克隆抗体(英国abcam公司);戊巴比妥钠(德国 Sigma公司);ML-HB(实验室自制,冻干粉)。
1.3仪器RHYⅢ组织切片机(江苏常州中威电子仪器有限公司);BMJ-Ⅲ组织包埋机(江苏常州中威电子仪器有限公司);PHY-Ⅲ病理组织漂烘仪(江苏常州中威电子仪器有限公司);ASP-300S自动脱水机(德国Leica公司);CKX41SF倒置显微镜(日本OLYMPUS公司);SN255939型连续波长酶标仪(美国BioTek公司)。
2 方法
2.1分组与给药随机将SD大鼠分为模型组、ML-HB组、正常对照组,每组40只,造模24 h后腹腔注射给药,ML-HB组腹腔注射60 mg∕kg的ML-HB溶液,1次∕d(给药计量参考前期预实验),模型组给等体积的0.9%氯化钠溶液,正常对照组正常饲养。
2.2模型制备腹腔注射2%戊巴比妥钠溶液麻醉大鼠(0.2 mL∕100 g),仰卧手术台,固定大鼠头部及四肢,于颈部正中脱去毛发,常规消毒后,用手术剪剪开颈部皮肤,手术刀颈正中切口,分离颈部两侧肌肉,暴露出气管,用1 mL注射器刺入大鼠气管软骨环间隙,迅速注入博来霉素溶液(5 mg∕kg)。正常对照组大鼠相同条件下注入等体积0.9%氯化钠溶液。药物注入后立即将大鼠直立,有频率地轻揉大鼠胸部,使药液充分扩散,缝合、消毒,将大鼠以仰卧位放置于笼中,保持呼吸顺畅,清醒后于清洁级动物房常规饲养〔10〕。
2.3取材及肺指数计算连续给药第30、45、60、75天时各处死10只大鼠,取肺用0.9%氯化钠溶液洗净,吸水纸吸干并称重。按下式计算肺指数,取左肺固定于10%中性甲醛溶液中,精密称取右肺0.4 g,制成10%肺组织匀浆液,离心取上清,-80℃保存备用。ELISA法检测匀浆液中的TNF-α和TGF-β1含量,按试剂盒说明书操作测定。
2.4病理标本制备将左肺组织从10%中性甲醛溶液中取出,取相同部位用石蜡包埋,制作厚度5 m切片,免疫组化染色观察肺组织中α-SMA与ColⅠ的表达。
2.5统计学分析用SPSS 17.0软件进行统计分析,结果以()表示,数据采用单因素方差分析,以P<0.05为差异有统计学意义。
3 结果
3.1 ML-HB对肺指数的影响给药4个时间点各组大鼠肺指数测定结果见表1。与正常对照组相比,模型组肺指数均升高,差异具有统计学意义(P<0.01)。与模型组相比,ML-HB组肺指数均降低,差异具有统计学意义(P<0.05)。
表1 ML-HB对大鼠肺指数的影响(,n=10)
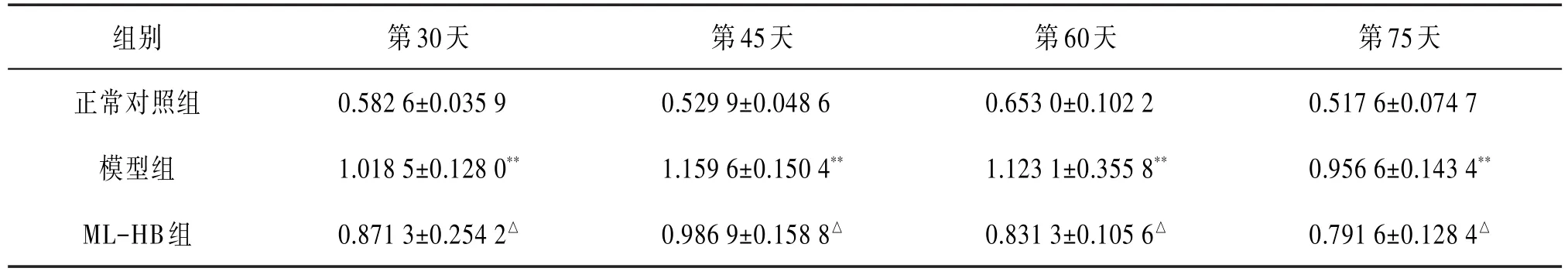
表1 ML-HB对大鼠肺指数的影响(,n=10)
注:与正常对照组相比**P<0.01;与模型组相比△P<0.05。
组别正常对照组模型组ML-HB组第30天0.582 6±0.035 9 1.018 5±0.128 0**0.871 3±0.254 2△第45天0.529 9±0.048 6 1.159 6±0.150 4**0.986 9±0.158 8△第60天0.653 0±0.102 2 1.123 1±0.355 8**0.831 3±0.105 6△第75天0.517 6±0.074 7 0.956 6±0.143 4**0.791 6±0.128 4△
3.2 ML-HB对TNF-α的影响给药4个时间点,与正常对照组相比,模型组肺组织中TNF-α含量显著升高,差异具有统计学意义(P<0.01)。与模型组相比,给药第30、45天时,ML-HB组肺组织中TNF-α含量显著降低,差异具有统计学意义(P<0.01),第60、75天时,ML-HB组肺组织中TNF-α含量亦降低,差异具有统计学意义(P<0.05)。见表2。
3.3 ML-HB对TGF-β1的影响给药4个时间点,模型组较正常对照组大鼠肺组织中TGF-β1含量显著升高,差异具有统计学意义(P<0.01);ML-HB组TGF-β1含量显著低于模型组,差异具有统计学意义(P<0.01)。见表3。
表2 ML-HB对大鼠肺组织中TNF-α的影响(,n=10,ng∕mL)
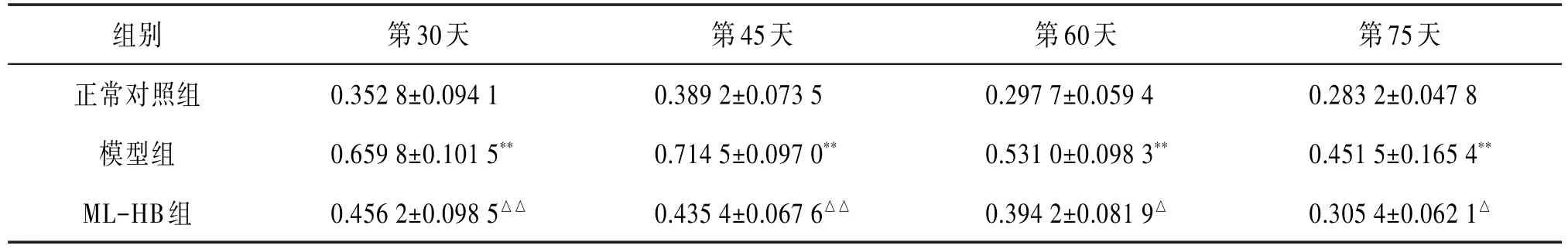
表2 ML-HB对大鼠肺组织中TNF-α的影响(,n=10,ng∕mL)
注:与正常对照组相比**P<0.01;与模型组相比△P<0.05,△△P<0.01。
第75天0.283 2±0.047 8 0.451 5±0.165 4**0.305 4±0.062 1△组别正常对照组模型组ML-HB组第30天0.352 8±0.094 1 0.659 8±0.101 5**0.456 2±0.098 5△△第45天0.389 2±0.073 5 0.714 5±0.097 0**0.435 4±0.067 6△△第60天0.297 7±0.059 4 0.531 0±0.098 3**0.394 2±0.081 9△
表3 ML-HB对大鼠肺组织中TGF-β1的影响(,n=10,ng∕mL)
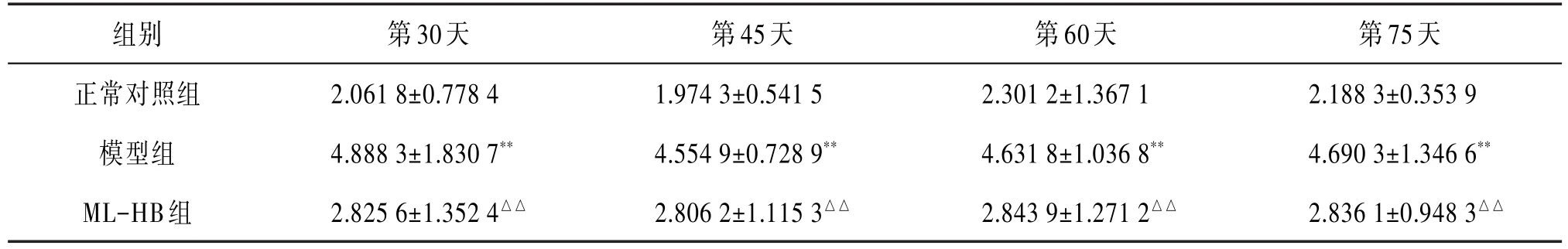
表3 ML-HB对大鼠肺组织中TGF-β1的影响(,n=10,ng∕mL)
注:与正常对照组相比**P<0.01;与模型组相比△△P<0.01。
组别正常对照组模型组ML-HB组第30天2.061 8±0.778 4 4.888 3±1.830 7**2.825 6±1.352 4△△第45天1.974 3±0.541 5 4.554 9±0.728 9**2.806 2±1.115 3△△第60天2.301 2±1.367 1 4.631 8±1.036 8**2.843 9±1.271 2△△第75天2.188 3±0.353 9 4.690 3±1.346 6**2.836 1±0.948 3△△
3.4免疫组化染色法观察ML-HB对大鼠肺组织α-SMA和ColⅠ的影响
3.4.1 ML-HB对α-SMA的影响 给药4个时间点,正常对照组肺泡结构正常,随时间的延长有少量α-SMA表达。模型组第30、45天时支气管周围、血管周围及肺泡间隔有大量的呈棕黄色强阳表达,表明有大量的肌成纤维化细胞存在,肺纤维化严重,第60天时有大量肺间质细胞增生迁移,形成的纤维细胞灶引起肺纤维化,细胞外基质(extracellular matrix,ECM)大量沉积,造成α-SMA呈强阳性表达,第75天时α-SMA聚集成团,呈强阳性表达,肺纤维化更加严重。ML-HB组第30天时棕黄色颜色较少较浅,未见细胞间隙液有明显的α-SMA阳性表达,第45天时细胞间隙液有较弱的α-SMA阳性表达,第60、75天时α-SMA的表达部位主要集中在气管或支气管周围,未见ECM有强阳性表达,与模型组相比,ML-HB组4个时间点肺组织中的阳性表达明显较低。见图1。
3.4.2 ML-HB对ColⅠ的影响 正常对照组在用药期内肺泡结构正常,只有少量的ColⅠ表达。模型组第30、45天时肺间质及ECM中可见呈蓝色ColⅠ的阳性表达,第60天时几乎没有正常的肺泡组织,肺实变严重,有大量纤维细胞灶,ColⅠ呈强阳性表达,第75天时有聚集成团的纤维性细胞,肺实变严重,ColⅠ也呈强阳性表达。与模型组相比,第30天时在ML-HB组肺组织的ECM未见ColⅠ大量沉积,蓝色染色较浅较少,第45、60、75天时ColⅠ在ML-HB组肺组织中的表达明显低于模型组。见图2。
4 讨论
肺纤维化的形成是机体过度修复的结果,当致病因素作用于机体导致肺组织受损伤时,肺组织内的成纤维细胞在炎症细胞和炎症因子的作用下会出现表型转化,转化为肌成纤维细胞,肌成纤维细胞可通过分泌胶原、纤维连接蛋白等物质,使病灶局部形成疤痕,从而维持肺泡结构和功能的完整〔11〕。当致病因子持续作用于机体引起肺泡上皮细胞持续损伤,分泌TNF-α、TGF-β1等细胞因子,这些细胞因子可以促进肺泡上皮细胞间质转化,形成成纤维细胞及肌成纤维细胞,导致胶原纤维大量沉积〔12〕。
由表1可知,在用药期间模型组大鼠肺指数显著高于正常对照组,表明肺水肿较严重,经ML-HB治疗后肺指数降低。由表2可知,各时间点ML-HB组中TNF-α的含量低于模型组,差异具有统计学意义(P<0.05),表明ML-HB对肺组织中TNF-α的表达有较强的干预作用。TNF-α是一种前炎症细胞因子,能刺激中性粒细胞及嗜酸性细胞产生超氧化物,释放溶酶体酶,对于周围细胞产生毒性作用〔13〕,同时介导其他细胞因子和炎症因子的表达,增强损伤肺炎症细胞浸润,介导肺泡炎症反应,并刺激成纤维细胞增殖,促进胶原合成〔14〕。实验结果表明,ML-HB具有抑制TNF-α表达,从而抑制炎症进一步发展的作用。
大量研究证实TGF-β1可诱导肺成纤维细胞增殖、并向肌成纤维细胞转化,刺激成纤维细胞合成大量I、III型胶原,同时可抑制胶原酶和纤溶酶的合成,导致胶原降解减少,ECM在肺间质中大量形成,导致纤维化〔15-16〕。由表3可知,ML-HB具有抑制肺纤维化模型大鼠肺组织中TGF-β1的表达,从而起到延缓肺纤维化进一步发展的作用。
α-SMA是肺成纤维细胞转化成肌成纤维细胞的标志,肌成纤维细胞可持续分泌纤连蛋白、蛋白多糖、层黏连蛋白和胶原等ECM〔17〕,分泌各种生长因子、炎症介质、趋化因子〔18〕,还能通过分泌基质金属蛋白酶和金属蛋白酶组织抑制因子调控胶原的合成和代谢〔19〕,因此肌成纤维细胞转化是导致肺纤维化最为重要和关键的步骤。在正常的肺组织中,ECM的合成与分解代谢处于动态平衡,有助于维持肺组织的正常结构与呼吸功能。α-SMA和ColⅠ是ECM的主要成分,是由肺成纤维细胞和转型后的肌纤维母细胞合成和分泌,其过度蓄积是PF的特征性病理改变〔20〕。本实验用免疫组化法检测α-SMA、ColⅠ在大鼠肺组织中的表达,直观地观察ML-HB对纤维化大鼠肺组织中肌成纤维细胞的影响,结果显示随着造模时间的延长,α-SMA、ColⅠ在模型组肺组织中的表达逐渐增多,肺纤维化初期就呈强阳性表达。与模型组相比,随着给药时间的延长,ML-HB组α-SMA、ColⅠ的表达明显降低,表明ML-HB可能通过调控α-SMA、ColⅠ在肺组织中的表达,抑制肌成纤维细胞的活化增殖、ECM沉积,从而达到干扰肺纤维化的作用。
研究结果表明,ML-HB能抑制TNF-α、TGF-β1、α-SMA、ColⅠ的表达,其作用机制可能是抑制了炎症细胞浸润及巨噬细胞在肺泡附近的增殖和聚集,降低肌成纤维细胞的增殖及ECM沉积,从而达到减缓肺纤维化的作用。肺纤维化的形成是一个复杂的过程,其对TNF-α、TGF-β1、α-SMA、ColⅠ等相关因子的调控作用有待进一步研究。

