微生物与重金属相互作用过程与机制研究进展
劳昌玲, 罗立强*,沈亚婷,朱 帅
1.国家地质实验测试中心, 北京 100037 2.中国地质大学(北京), 北京 100083
随着社会经济的发展,矿山开采和重金属的冶炼活动导致大量重金属进入生态系统. 重金属污染对土壤、水和植物等产生了严重影响,并通过生物链危害人体健康. 大部分重金属在达到一定浓度时会对生物体产生毒害作用. 如汞、镉和铅会破坏细胞膜的结构,取代必需元素的结合位点,扰乱酶的功能,损害细胞功能,改变蛋白质结构,破坏组织器官和神经系统,甚至引起生物体死亡[1]. 环境中重金属污染的修复研究具有重要意义.
传统的物理化学方法,如开挖填埋、土壤淋洗法、逆向渗透、离子交换、电化学处理法、膜处理技术、热液提取和蒸发回收等,已广泛应用于环境中重金属污染的修复研究. 但这些方法所需成本较高,工作量大,土壤性质不可逆,且有的化学处理方法还会引起二次污染[2]. 生物修复具有简单、易操作、成本低、不引起二次污染以及可应用于现场的原位修复等优势而受到了广泛关注[3].
微生物在自然界中广泛存在,几乎参与自然界中所有的生物化学反应,对重金属的溶解释放、迁移转换和富集沉淀均具有重要作用. 部分微生物在新陈代谢过程中产生铵盐[4]、硫代硫酸盐[5]、氰化物[6]、碘化物[7]及有机酸[8],该过程可以提供大量的阴离子络合基团,增加对重金属的螯合能力. 同时,微生物可通过胞外沉淀、细胞内积累和氧化还原等机制将毒性重金属离子转化为毒性较低的形态[9].
该文综述了微生物在重金属的生物地球化学循环过程中的作用,主要包括微生物对重金属元素的溶解迁移过程以及微生物对重金属元素的吸收富集与形态转化机制,并探讨了微生物在修复重金属污染方面的应用前景.
1 微生物与重金属相互作用过程与机制
1.1 重金属对微生物生长过程的影响
微生物在元素的生物地球化学循环过程中扮演着重要角色,元素的生物地球化学循环过程会影响微生物的生长[10]. 例如,一些金属元素(如K、Na、Ca、Mg、Fe、Cu和Zn)是微生物生长的必需营养元素[11],另一些金属离子(如As3+/As5+、Fe2+/Fe3+、Mn2+/Mn4+、V4+/V5+、Se4+/Se6+和U4+/U6+)的氧化还原反应过程可为微生物提供新陈代谢所需的能量[12],还有一些重金属离子(如Ag+、Hg2+、Cd2+、Co2+、CrO42+和Pb2+)通过置换作用取代原本结合位点上的必需金属离子进而对微生物造成毒害[13-14].
从宏观上来说,重金属含量会影响微生物的生物量及其多样性[10]. 韩桂琪等[15]发现,低含量的Cd(7.5 mg/kg)、Cu(75 mg/kg)、Zn(150 mg/kg)和Pb(150 mg/kg)复合污染会促进细菌、真菌和放线菌生物量的增加,增幅分别为14.9%、12.4%和58.5%,但随着这些重金属含量的增加,重金属对微生物的作用由刺激转变为毒害作用,细菌、真菌和放线菌的生物量显著下降.
从微观上来说,高浓度的重金属会损坏细胞膜结构,改变酶的特异性,损害细胞功能,改变蛋白质结构,破坏DNA甚至引起细胞死亡. 毒性重金属离子(如Ag+、Hg2+、Pb2+、Cd2+、Co2+、CrO42+和Ni2+等)的氧化电位比必需金属元素高,对巯基具有更强的亲和能力,可通过置换作用取代原本结合位点上的必需金属元素[16]. 在重金属的胁迫下,微生物会产生过多的氧化应激产物(如过氧化氢、活性氧和超氧化物歧化酶等),当这些产物超过微生物的抗氧化能力时就会导致细胞死亡[17]. Das等[18]研究发现,低浓度(<130 μmol/L)的AuCl4-会刺激米根菌(Rhizopusoryzae)分泌还原蛋白进行生物解毒,但当AuCl4-浓度高于130 μmol/L时,细胞的超微结构受到破坏,菌的生长受到明显抑制. ZHOU等[19]对从生活排放污水中分离出的细菌进行实验室培养后发现,当ρ(As3+)为0.05 mg/L,ρ(Hg2+)为0.2 mg/L,ρ(Cd2+)、ρ(Cr3+)和ρ(Cu2+)均为0.5 mg/L,ρ(Pb2+)和ρ(Zn2+)均为1 mg/L 时,细菌的DNA结构会受到破坏.
长期生活在重金属污染环境中的部分微生物会通过吸附、积累和生物转化等过程改变重金属的毒性,甚至通过改变自身的遗传物质,逐渐适应环境并存活下来形成优势菌种,这些优势菌种对重金属的耐受性也会有所增加[10]. 噬金属的微生物〔如β变形菌属贪铜菌(Cupriavidusmetallidurans)〕体内含有多种重金属的抗性基因簇,细胞可通过络合作用、外排作用或还原沉淀等作用进行解毒,使其可在矿渣岩石堆,重金属加工厂附近的河流以及矿化区等环境中得以生存繁衍[20].
1.2 微生物作用下重金属的生物地球化学循环过程及机理
1.2.1微生物作用下重金属元素的溶解迁移
微生物自身生长的过程中可以产生大量蛋白质、多肽、羧酸、核酸和氨基酸,部分微生物还会分泌氰化物和硫代硫酸盐等代谢产物,这些过程可以提供大量的阴离子络合基团与重金属螯合,提高重金属的生物有效性[13,21]. Faramarzi等[22]发现,假单胞菌(Pseudomonasplecoglossicida)在生长早期分泌大量的HCN,HCN与重金属形成络合物促进重金属的溶解迁移. Reith等[8]发现,金矿区土壤中的原生微生物在生长过程中分泌大量游离的氨基酸(浓度高达64.2 μmol/L),土壤中80%的金会发生溶解并以有机结合态形式存在,但在培养50 d后,这些氨基酸配体被大量消耗,游离氨基酸浓度仅为8 μmol/L,此时金在溶液中不稳定,会重新吸附到土壤表面上.
化学自养型细菌可通过氧化还原难溶矿石中的硫化物或碘化物来获取新陈代谢所需的能量,释放矿石中的重金属元素. 在含氧环境中,铁和硫的氧化细菌通过将Fe2+氧化为Fe3+或将S0氧化为H2SO4来获取能量,该过程可导致黄铁矿(Fe2S)和磁黄铁矿(Fe1-xS)溶解[23]. 在厌氧环境中,硫杆菌(Thiobacillus)可将S0氧化为SO42-,该过程降低了环境的pH,促进了重金属的溶解[24]. 假单胞菌(Pseudomonas)可将IO3-还原为I-,进而使金发生溶解[7,25],相关反应过程如下:
4Fe2++O2+4H+→ 4Fe3++2H2O (含氧环境)
(1)
2S0+3O2+2H2O→ 2H2SO4(含氧环境)
(2)
S0+6Fe3++4H2O→ SO42-+6Fe2++
8H+(厌氧环境)
(3)
2Au+3I3-→ 2AuI4-+I-或2Au+I-+I3-→ 2AuI2-
(4)
化能异养型的微生物利用有机物作为电子供体,将金属氧化物中的高价金属离子作为电子受体从而将金属进行异化还原[26]. 铁的异化还原对吸附于铁(氢)氧化物表面的重金属元素的生物地球化学循环过程起着重要作用. 在枯草芽孢杆菌(Bacillussubtilis)中加入Fe3+后,在胞外聚合物作用下细胞表面形成无定型铁(氢)氧化物纳米粒子,细胞对As5+的吸附能力至少提高了11倍[27]. Toshihiko等[28]从稻田土壤中分离出异化还原菌株Geobactersp. OR-1,该菌株培养4周可溶解土壤中70%的砷,其对砷的溶解释放过程如图1所示.Geobactersp. OR-1既可以As5+作为电子受体将砷还原为As3+,又可以Fe3+作为电子受体将铁还原为Fe2+使水铁矿发生溶解,此时吸附于水铁矿的As3+释放到溶液中被农作物吸收,通过食物链威胁人体健康.
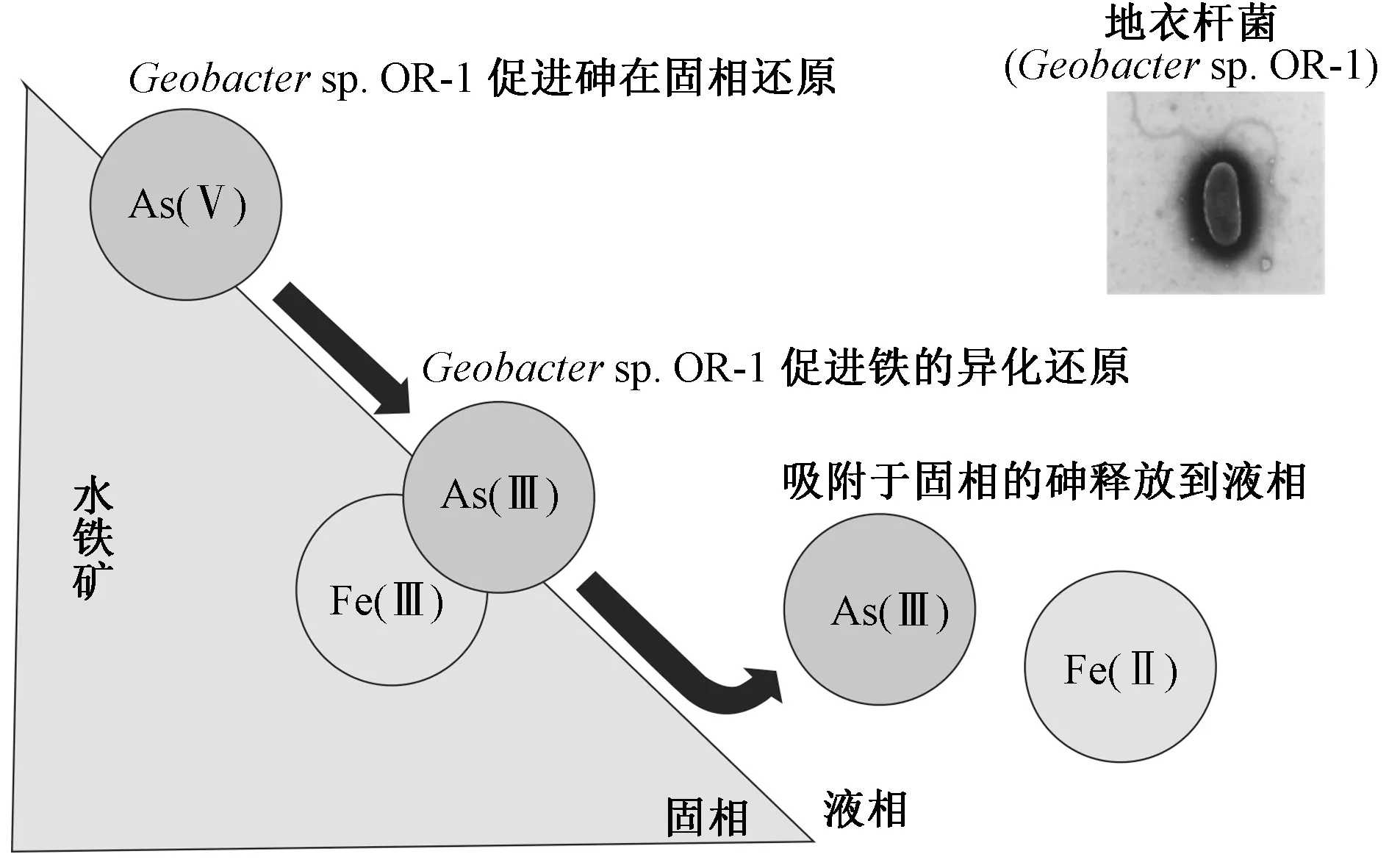
图1 砷的异化还原菌Geobacter sp. OR-1将砷从水铁矿中释放的过程[28]Fig.1 Arsenic released from ferrihydrite by arsenate-reducing bacterium Geobacter sp. OR-1[28]
1.2.2微生物对重金属的吸附和富集
微生物细胞膜外存在大量胞外聚合物(EPS),该聚合物中含有羧基、羟基、巯基、氨基、酰胺基和磷酸基等活性基团,这些基团中的N、O、P和S等提供孤对电子重金属离子结合,从而使溶液中的重金属离子被吸附[29]. Kasimani等[30]研究发现,在ρ(Cr2+)为25 mg/L的溶液中,蓝藻菌(Cyanobacteria)对Cr的吸附能力最高可达75.63%,FTIR结果显示,对Cr吸附起作用的官能团主要是氨基、羟基和羧基. SHEN等[31]发现,在ρ(Cd2+)为0.5 mg/L的溶液中,胞藻(Synechocystissp. PCC6803)可吸附86%的Cd2+,吸附效率的增加与EPS的增加同步,胞藻通过分泌EPS将Cd吸附于细胞外,防止其对细胞的毒害. González等[32]利用同步辐射X射线吸收近边结构(X-ray absorption near edge structure,XANES)测定了含EPS和不含EPS的根际假单胞菌(Pseudomonasaureofaciens)对Fe3+的吸附过程,发现两种情况下与羧基结合的铁分别为78%和40%,说明EPS可促进细胞表面Fe—O—Fe高聚物的形成.
不同微生物对金属离子的吸附能力有所差异. 革兰氏阴性菌细胞表面缺乏有机磷酸基,对金属离子的吸附作用比革兰氏阳性菌差[33]. 相同微生物细胞在不同环境下的吸附能力也有区别. 在0.1 mmol/L的Au3+溶液中,形成生物膜的细胞由于胞外聚合物对Au3+的吸附作用强,进入细胞内的Au3+也较少,导致其存活率比浮游细胞的存活率高4个数量级[34].
微生物对元素的表面吸附过程受pH的影响显著. Giri等[35]发现,当pH在2.5~7.5范围内时,蜡样芽胞杆菌对砷的吸收效率随着pH的升高而增加;但随着pH继续升高,吸收效率反而降低. 原因在于表面吸附主要包括吸附和解吸两个过程(见图2):①当 pH较低时,细胞表面高度质子化,解吸过程起主要作用,因此pH升高会引起解吸作用降低,吸附增强;②当pH超过7.5后,吸附起主要影响作用,随着pH的继续升高,细胞表面电负性增强,对砷的吸附作用也随之减弱. 因此,在实际的环境修复应用中,pH也是一个重要的考察因素.

图2 蜡样芽胞杆菌表面对AsO33-的吸附和解吸过程[35]Fig.2 Biosorption and regeneration process of AsO33- by living B. cereus[35]
与简单的表面吸收不同的是,富集作用是重金属离子从活细胞外侧通过细胞膜运输进入细胞质,该过程是主动运输的过程[36]. 重金属进入细胞后,与体内氨基酸或者蛋白质结合生成无毒或低毒的络合物并富集在细胞内. 从印度某工业废水处理厂中分离出的芽孢杆菌(Bacillus)可富集高达9.8 mg/g的砷,其中80%的砷富集在细胞质中,天冬氨酸、谷氨酸和半光氨酸参与砷的解毒过程[37],该特异性菌株在实际环境中砷污染的修复中可能具有潜在的应用前景.
1.3 微生物对重金属元素形态的转变
微生物通过氧化还原、生物矿化、甲基化和去甲基化等作用改变重金属的形态,从而实现对重金属的解毒. 通常情况下,微生物可通过多种解毒机制共同作用,使其在重金属污染的环境中存活下来. 例如,在高浓度Fe3+胁迫下,蓝藻菌可通过以下多种途径降低铁对细胞的毒害:①胞外蛋白质将Fe3+矿化为赤铁矿和磁铁矿,减少其进入细胞的量;②细胞内的磷酸盐与Fe3+鳌合,减少游离的Fe3+对细胞的毒害;③超氧化物歧化酶、过氧化氢酶、脯氨酸和类胡萝卜素等可降低Fe3+引起的氧化应激压力;④蓝藻菌合成的脂多糖、脂肪酸、叶绿素和糖类等物质与Fe3+络合降低铁的毒害[38].
1.3.1微生物对重金属元素的氧化和还原
元素的价态是影响其毒性的重要原因,微生物对毒性元素的氧化还原过程是重要的解毒机制之一. 从制革废水中分离出的蜡样芽胞杆菌(Bacilluscereus)可将Cr6+还原为Cr3+,降低Cr的毒性,当Cr6+浓度分别为60和70 mg/L时还原率分别达到96.7%和72.1%,该过程中,还原型辅酶Ⅰ和Ⅱ可作为重要的电子供体[39]. 在有氧环境中,栖热菌属(Thermus)利用无机As3+作为电子供体,将As3+氧化为毒性较弱的As5+[40].
游离态的金对生物体具有很强的毒性,因为其一旦进入细胞内,就容易与谷胱甘肽结合,形成的化合物会与氧分子反应生成氧化谷胱甘肽和过氧化氢,并抑制活性酶的功能[20,41]. 而惰性的单质Au对微生物几乎没有毒性[42-43]. 不同的微生物对Au离子的还原解毒机制不同. 微生物可通过胞外分泌物,细胞膜上的还原蛋白或者胞内还原酶等将毒性的金离子进行还原解毒(见图3)[18]. 在100 μmol/L的AuCl3溶液中,正常生长的代尔夫特食酸菌(Delftiaacidovorans)可通过分泌次级代谢产物将Au3+在体外还原解毒. 而基因突变后不能正常分泌次级代谢产物的菌对Au3+的毒性敏感程度增加了102.8倍,菌的生长受到明显抑制[42]. 很多革兰氏阴性菌的膜囊可作为抵御环境中有毒物质的防护盾. 当蓝藻菌暴露于Au(S2O3)23-溶液中,蓝藻菌会释放膜囊包裹住细胞,防止金离子对细胞的毒害,并通过膜囊组分中的P、S或者N等配体与Au离子反应生成金纳米颗粒[44-45]. 在50 μmol/L的HAuCl4溶液中,贪铜菌吸附的金进入细胞质内被还原形成Au(I)-S中间体,最终被还原为纳米金,并通过P型ATP酶外排通道将金排出体外[20].
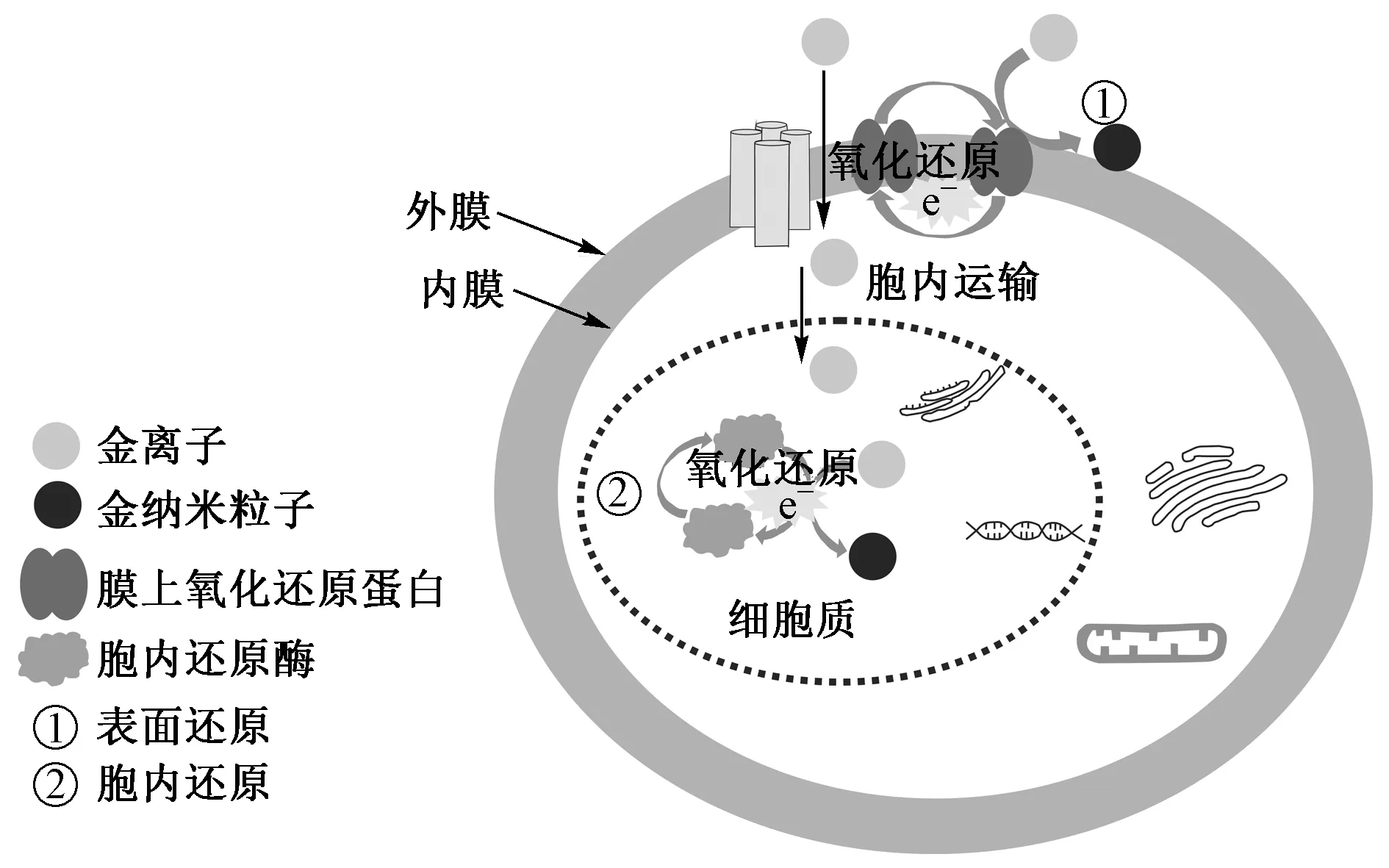
图3 微生物对金离子的还原解毒机制[18]Fig.3 Reduction and detoxification mechanism of gold ions by cells[18]
同步辐射XRF和XANES技术可原位获得重金属元素在细胞体内外的分布及其形态特征,是探究微生物对重金属解毒机制的重要途径. Kenneth等[46]利用空间分辨率为150 nm的XRF和XANES技术分析了在K2Cr2O7溶液中暴露6 h后,荧光假单胞菌的浮游和附着在固体表面的两种不同状态细胞中元素的分布和化学形态,得到以下结论:①浮游状态的细胞中P、S、Ca、Fe和Zn等元素大量丢失,细胞内富集了大量的毒性元素Cr,而附着状态的细胞表面含有大量的Ca和P元素,在细胞表面形成大量的磷灰石沉淀,并将Cr区隔在细胞外;②附着细胞中Cr6+被还原为Cr3+并与细胞外的磷酰基官能团结合,防止Cr对附着状态的细胞的毒害. 同步辐射是一种先进的分析技术,但目前受光斑大小的限制,难以对数微米的微生物进行准确的定位分析,这也是目前研究中急需解决的问题之一.
1.3.2微生物对重金属的矿化作用
重金属离子在微生物体内外的生物矿化可使重金属发生沉淀. 生物矿化主要包括磷酸盐矿化、碳酸盐矿化和硫化物矿化等,具体的方程式[47]如下:
HPO42-+M2+→MHPO4
(5)
CO32-+M2+→MCO3
(6)
H2S+M2+→MS+H2
(7)
硫酸盐还原菌(Sulfatereducingbacteria,SRB)可利用硫酸盐作为电子受体将硫酸盐转化为硫化物,产生的H2S与重金属发生反应形成硫化物沉淀[48-49]. 在重金属污染的土壤中,芽孢杆菌(Bacillus)和八叠球菌属(Sporosarcina)分泌的脲酶增加,从而促进土壤中的尿素水解生成碳酸盐,碳酸盐与Ni、Cu、Pb、Co、Zn和Ca等矿化形成沉淀,矿化率为88%~99%[50]. 酿酒酵母(Saccharomycescerevisiae)通过释放磷酸盐将U6+矿化为氢铀云母〔H2(UO2)2(PO4)2·8H2O〕,降低了U6+对细胞毒害[51]. 从尾矿分离出的芽孢杆菌(Bacillus)可将溶液中的Pb(NO3)2转化为溶解性较差的PbS和PbSiO3,将该菌添加到矿区土壤中,土壤中可交换态的Pb减少了26%,与碳酸盐结合的Pb增加了36%[52]. 微生物对重金属的生物矿化作用可降低重金属的迁移能力和生物有效性,是其可应用于重金属污染修复的重要原因之一.
1.3.3微生物对毒性元素的甲基化和去甲基化
微生物对砷形态的转化主要包括氧化、还原、甲基化和去甲基化. 不同形态的砷迁移能力变现为methyl As(Ⅲ)>>methyl As(Ⅴ)>As(Ⅲ)>As(Ⅴ)[53],而砷的毒性大小顺序为methyl As(Ⅲ)>As(Ⅲ)>As(Ⅴ)>methyl As(Ⅴ)[54]. 微生物将无机砷甲基化生成可挥发性有机砷并排出体外的过程是微生物重要的解毒机制. 一甲基砷渗透性差,仅作为胞内甲基化的中间体无法渗出体外,而二甲基砷和三甲基砷具有较高的渗透性(比一甲基砷至少高出10倍),能穿过细胞膜释放到环境中[36]. 稻田土壤中添加4%的秸秆时,由于秸秆分解过程中产甲烷细菌增加,水稻根际土壤中砷的甲基化程度增加了2个数量级[55]. 由于砷的去甲基化过程降低了其迁移能力,不适合应用于污染土壤的修复,因而受到的关注较少. 气态的甲基砷经过快速的氧化降解可形成无机砷,但目前该过程中微生物起何种作用仍不清楚[56].
2 微生物在修复重金属污染中的应用
生物修复已经成为目前修复环境中重金属污染的一项重要技术手段,其原理是使重金属形成更稳定的化合物. 研究[57]表明,重金属化合物的稳定性顺序为酸溶性部分<可还原部分<可氧化的部分<残渣部分.
微生物可通过生物吸附作用、还原沉淀、生物矿化等作用将重金属固定[58]. SRB广泛存在于稻田土壤、海水、温泉、油田和沉积物中,是最常见的应用于生物修复的微生物[59-60]. 在缺氧条件下,SRB对含水层沉积物中重金属的矿化起着重要作用,其主要机制:SRB将硫酸盐转化为H2S,胞外EPS将重金属吸附到细胞表面,H2S与重金属发生反应形成金属硫化物沉淀[48-49]. 虽然SRB应用于重金属修复得到了实验室的证实,但其在实际环境中的应用受到了限制,原因在于微生物生长需要适宜的环境和电子供体. 近年来,有研究者针对这一问题开展了实际环境中微生物用于修复重金属污染的研究. 例如,ZHANG等[61]通过添加不同的营养物质解决了尾矿修复中噬酸菌和SRB的竞争问题,发现酵母提取物和胰蛋白胨可促进SRB的生长,抑制噬酸菌的生长,从而提高SRB在实际尾矿环境中的重金属修复效率. 有研究[62-63]表明,零价铁(Fe0)可作为SRB生长过程中重要的补充物质; Fe0与重金属氧化物之间发生电子传递将重金属还原,被还原的重金属与铁的氧化物发生表面吸附和共沉淀作用,此外Fe0与水反应产生的H2同样可作为SRB的电子供体促进其生长. XIN等[64]研究表明,在同时含有Fe0和SRB的体系中,Cu、Cd、Zn和Pb的浸出率分别达100%、98.5%、90.69%、100%,X射线衍射(X-ray diffraction,XRD)和X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)分析结果显示,Cu、Cd、Zn和Pb主要形成了PbCd、PbZn、ZnS、Zn、CdO、CuZn和CuS等更稳定的矿物.
微生物对重金属的修复效果与重金属的存在形态有关. 从下水道污泥中分离出的伯克霍尔德氏菌(Burkholderiasp.)Z-90对Mn、Zn、Cd、Pb、As和Cu的修复效率分别为52.2%、44.0%、37.7%、32.5%、31.6%和24.1%,修复前后的BCR分步提取结果显示,重金属中酸溶态的组分比残渣态更易于被微生物吸附吸收[65]. 在实际应用中可先利用菌株将重金属元素转化为易于被微生物吸附的形态,再利用特异性菌株进行修复.
微生物应用于土壤和灌溉水的重金属修复,可降低重金属对作物的毒害,增加产量. Fawzy等[66]发现,蓝藻菌对灌溉污水中Fe、Pb、Cd、Zn、Cu和Mn的去除率分别为62.0%、83.1%、88.5%、68.8%、55.2%和42.4%,降低了污水灌溉的甜菜体内重金属、过氧化氢和脂质过氧化反应产物的含量,说明蓝藻菌可有效减少灌溉污水中重金属对甜菜的氧化应激压力[66]. 稻田土壤中施加粉煤灰可为水稻提供K、Na、P、Zn和Fe等营养元素,也会引入Pb、Cr和Cd等毒性重金属元素,在施肥的同时加入1.0 kg/m3的固氮蓝藻菌可显著提高水稻的固氮能力,同时蓝藻菌对重金属元素的吸附作用可减少毒性重金属元素进入水稻中[67].
根际微生物对植物吸收重金属起重要的调控作用[68]. 超富集植物可大量吸收重金属,但大部分植物由于生物量低、生长缓慢和对重金属具有选择性等原因不适用于大规模地应用于修复重金属污染[69]. 一些有益的微生物可直接或间接地溶解营养元素(氮、磷、钾和铁等),分泌植物激素和促生酶(如1-氨基环丙烷-1-羧基脱氨酶)等物质,从而促进植物的生长[70]. 在大麻的根际土壤中接种丛枝菌根真菌,大麻的生物量增加64.2%,根际有效态Cd含量增加46.3%,Cd的吸收量增加107.8%[71]. 从尾矿区花叶芒的根际土壤中分离出的假单胞菌(Pseudomonaskoreensis)接种在矿区的土壤中,花叶芒的生物量、叶绿素和蛋白质含量均分别增加54%、27%和28%,根中重金属的增加量分别为23%(As)、31%(Cd)、7%(Cu)、18%(Pb)和15%(Zn),茎中重金属的增加量分别为31%(As)、71%(Cd)、61%(Cu)、22%(Pb)和21%(Zn),超氧化物歧化酶和过氧化氢酶活性分别增加42%和33%,羟基自由基减少,说明接种该菌可提高花叶芒的抗氧化应激压力的能力[9]. 微生物还可通过酸化、沉淀、络合和氧化还原等作用改变重金属的生物有效性,降低重金属的毒性,诱导植物对重金属的抵御机制. 根际微生物可改变重金属的形态,影响其生物有效性,其机制如下:①真菌(如黄曲霉)可通过新陈代谢活动产生的有机酸、氨基酸及其他代谢产物溶解重金属,增强重金属的生物有效性;②部分特异性丛枝菌根可以通过对重金属的鳌合作用,增加重金属的有机结合态,从而影响植物对重金属的吸收富集[47]. Baum等[72]从重金属污染的植物根部分离出真菌淡黄曲霉菌接种到污染土壤中,重金属Cd、Cu、Pb和Zn的硝酸铵提取态含量增加了11%~33%,其中Cd的生物有效性提高了22%. 与非超富集植物相比,硒的超富集植物根际的微生物种类更为丰富. 超富集植物利用硫酸盐转运蛋白吸收土壤中的硒酸盐,并将其转化为硒半胱氨酸(SeCys)和硒甲硫氨酸(SeMet)[73]. 从硒的超富集植物碎米芥根际分离出一种氧化微杆菌属(Microbacteriumoxydans)可耐受高达15 mg/L的亚硒酸盐. 将其暴露于1.5 mg/L的亚硒酸盐中,可检测到大量的SeCys2,该机制可能是超富集植物能富集大量硒的重要原因[74].
3 结论
a) 微生物可通过自身生长的过程中产生的蛋白质、多肽、羧酸、核酸和氨基酸等物质与重金属络合,氧化还原难溶矿石中的硫化物或碘化物,或直接对重金属进行异化还原等过程促进重金属的溶解迁移.
b) 微生物细胞外EPS的活性基团中N、O、P和S等提供的孤对电子可对重金属离子进行吸附,被吸附的重金属离子从活细胞外侧通过细胞膜运输进入细胞质,从而富集在细胞内.
c) 微生物可通过氧化还原、生物矿化、甲基化和去甲基化等过程改变重金属的毒性,从而影响重金属在环境中的生物地球化学循环.
4 展望
微生物应用于重金属污染环境中的生物修复越来越受到关注. 目前有关微生物对重金属的解毒和耐受机制以及微生物在实际的环境修复应用中仍存在以下问题有待进一步深入研究.
a) 在重金属污染地区,特异性菌株对于重金属的解毒和耐受性的机制仍需要进一步研究. XRF和XANES技术虽然可原位获得重金属元素在细胞体内外的分布及其形态特征,但由于仪器机时的限制,难以展开大量的研究工作. 同时,由于微生物细胞个体小,仅为数微米,受光斑大小的限制,难以分辨出元素在细胞内外的准确位置. 在今后的研究中可以采用相应的分离和提取技术,分别获取细胞的胞外聚合物、细胞上的结合蛋白和胞内蛋白质与重金属相互作用,探究其解毒过程中起主要作用的物质及其解毒机制.
b) 微生物对重金属的修复效果与重金属的存在形态有关. 在实际应用过程中可以考虑利用一些特定的微生物促进重金属元素的溶解释放后,再利用对重金属具有耐受性的特异性菌株进行生物修复. 目前对于混合菌株应用于修复重金属污染这方面的研究工作较少.
c) 植物根际-微生物-重金属之间的相互作用是一个复杂的过程,目前植物根系分泌物和微生物的新陈代谢产物对重金属形态及生物有效性的协同拮抗作用以及植物与微生物相互作用微观的界面过程尚未明晰. 加强相关机理的研究可为微生物修复环境中重金属污染的应用提供重要依据.

