基于花生四烯酸类代谢物的重症脓毒症患者血浆代谢组学分析
关 鑫,杜 超,李东华,翁 欣,曾宪民,涂正伟,张 一,吴 腾,王宇歆,刘洪斌,
脓毒症是感染引起的全身炎症反应综合征,是感染、烧伤、严重创伤、外科大手术后的常见并发症。如不经有效治疗,会发展为并发急性器官功能障碍的重症脓毒症,甚至进一步发展为脓毒症休克,两者的致死率高达25%、50%[1-2]。关于脓毒症发病机制一直是研究热点[3-5],但是其发病机制复杂,因此一些研究转为对疾病生物标志物的寻找[6-8]。临床上对脓毒症的诊断存在多种标志物,如常用的生化标志物C反应蛋白、白细胞介素6、降钙素原等对诊断脓毒症有辅助作用[7],但尚没有一种能够成为理想的预测指标。花生四烯酸是生物体内分布最广泛而且具有重要生物功能的一种多不饱和脂肪酸,其与严重炎症反应及脓毒症的病理过程密切相关[9-11]。目前还缺乏与脓毒症相关的花生四烯酸类物质代谢组学研究。
1 资料与方法
1.1 一般资料 选取2013年7月—2014年9月天津市南开医院收治的重症脓毒症患者8例,其中原发疾病为急性腹膜炎3例,肠梗阻3例,急性胆囊炎胆石症2例。男5例,女3例;年龄40~65岁,平均51.38岁。均有不同程度发热、腹痛症状,无背景疾病如高血压、高血脂、糖尿病及肝肾疾病等。均符合中国严重脓毒症/脓毒性休克治疗指南(2014)定义标准[12]。从感染灶标本中共分离鉴定出细菌12株,其中大肠杆菌5株,铜绿假单胞菌4株,不动杆菌3株。同时收集7例健康成人血样作为对照组。
1.2 试剂 固相萃取柱Cleanert S C18-SPE,购自天津博纳艾杰尔科技有限公司;月桂酸标准品(纯度>99%),购自中国药品生物制品检定所;甲醇、乙腈均为色谱纯,购自Merck公司;甲酸为分析纯。
1.3 仪器 KJL512型氮气吹干仪;DIONEX U3000高效液相色谱系统,包括在线脱气机,二元输液泵,自动进样器,柱温箱,紫外检测器;色谱柱Agilent ZORBAX Eclipse XDB-C8(4.6×150 mm I.D., 5 μm);Barnstesd EASYpure II型超纯水机;Bruker micrOTOF-QII飞行时间质谱仪,配置电喷雾离子源,Hystar 3.2(Bruker, America)操作软件及Profile Analysis 2.0(Bruker, America)数据处理软件。
1.4 样品的收集与制备 (1)溶液配制。称取25.0 mg月桂酸标准品,置于25 mL的容量瓶中,加入甲醇溶解,定容至刻度,配制成1 mg/mL的内标储备液。取一定量的月桂酸储备液,用甲醇∶水(50∶50,v/v)稀释至浓度为100 ng/mL,作为内标溶液。(2)样品收集。根据严重脓毒症评价标准,选取至少合并一项脏器功能障碍的患者,与抗生素治疗前用EDTA抗凝管留取全血5 mL,立即于4 ℃下3500 r/min离心10 min,吸取上层血浆,分置于1.5 mL EP管中于-80 ℃冻存。(3)样品制备。血浆室温解冻,吸取200 mL到活化好的SPE小柱中,加入100 mL甲醇水溶液。800 r/min离心5 min,用1 mL去离子水清洗SPE柱,分别用500 mL乙腈洗脱3次,收集乙腈洗脱液,氮气吹干仪吹干上清。用150 mL乙腈水(50∶50,v/v)复溶,涡旋30 s,取上清液进入液质联用仪分析。
1.5 分析方法 (1)液相色谱条件。Dionex Acciaim C18柱(2.1×250 mm I.D.,5 μm粒径)色谱柱,流动相A:水,流动相B:乙腈;梯度洗脱程序:0~3 min:40% B,3~4 min:95% B,4~14 min:95% B,14~15 min:40% B,15~20 min:40% B,流速为0.3 mL/min,柱温箱温度设定为30℃,进样量20 mL。(2)飞行时间质谱条件。离子源为电喷雾离子化源,各项源参数及质谱参数详见表1。

表1 重症脓毒症代谢组学分析质谱参数

图1 全扫描质谱图(Ⅰ)与内标质谱(Ⅱ)
1.6 精密度实验 按照“样品制备”方法,血浆室温解冻,吸取200 mL到活化好的SPE小柱中。加入100 mL内标溶液,800 r/min离心5 min。用1 mL去离子水清洗SPE柱,分别用500 mL乙腈洗脱3次。收集乙腈洗脱液,氮气吹干仪吹干上清,用150 mL乙腈水复溶。涡旋30 s,取上清液进入液质联用连续分析6针。全扫描及内标色谱图见图1。
2 结果
2.1 精密度实验 标准添加样品分别经过质谱连续进样分析,计算内标峰面积相对标准偏差(RSD)小于6%。见表2。
2.2 数据分析 通过LC-Q-TOF分析,得到脓毒症患者组及健康对照组两组的血浆代谢物谱图数据。应用BRUKER软件Profile Analyst 2.0对上述数据进行峰识别、峰提取、峰对齐、归一化降维处理后导出数据;应用SIMCA-P 11.5将数据进行Pareto-scaling预处理后,进行主成分分析(PCA)以及偏最小二乘法分析[13](PLS-DA)。
PCA分析是数据分析中常用的非监督降维方法之一,在数据压缩消除冗余和数据噪音消除等领域都有广泛的应用。其优点是它只需要特征值分解,就可以对数据进行压缩,去噪,计算方法简单,易于实现。本研究通过组学分析,获得了大量数据,应用PCA分析能够简单快速的初步判断代谢物差异;而PLS-DA能够在PCA分析结果的基础上预测组间差异,更有利于差异化合物的辨别,结果分别见图2,图3。

表2 重症脓毒症代谢组学分析方法精密度

图2 PCA(Ⅰ)与PLS-DA(Ⅱ)的3D模型矩阵

图3 PCA(Ⅰ)与PLS-DA(Ⅱ)的模型矩阵
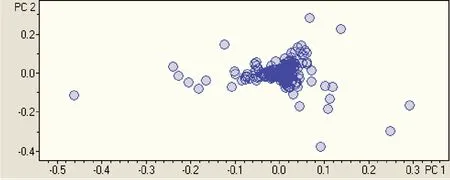
图4 脓毒症患者主要代谢组分散点图
采用Profile Analyst 2.0对患者组和对照组数据进行数据提取,得到两组代谢物组分散点图。见图4。依据散点图离散度提取主要差异物,并对两组差异物峰面积使用SPSS13.0进行T-test分析,有显著差异(P<0.05)的物质进一步在HMDB(http://www.hmdb.ca)、MassBank(https://massbank.eu/MassBank)、METLIN(https://metlin.scripps.edu)等网络数据库检索,结果见表3。
3 讨论
脓毒症的发生发展过程涉及多种信号转导通路,如内毒素介导的细胞信号转导通路、炎症通路的激活和凝血通路的激活等[14],根据其各项生理指标可以分为全身性炎症反应、严重脓毒症和脓毒症休克三个阶段[15]。其中脓毒症早期阶段,临床指标与非感染引起的炎症反应不好区别。而脓毒症休克阶段症状过于严重,已经失去早期判别意义。因此,本文选取重症脓毒症阶段患者血液样本,应用代谢组学的大数据组学分析方法进行研究,通过对重症脓毒症患者血浆代谢物,特别是与炎症反应密切相关的花生四烯酸等脂肪酸类物质进行对比分析,进一步得出在脓毒症发生过程中该类物质的变化规律。

表3 重症脓毒症代谢组学分析差异物
本研究开发了一种适合分析花生四烯酸类脂肪物质的LC-Q-TOF分析方法,方法精密度由标准添加的内标信号强度峰面积计算相对标准偏差得出,结果在允许的范围内。利用本方法进行临床样本分析,数据经过PCA分析与PLS-DA分析,其中PCA分析重点用来判断各样本之间是否存在代谢物差异。图中每一个点代表一个数据降维样本,如图各样本之间离散分布存在一定的差异,但是并不能很好的体现患者组和对照组之间的差异情况。PLS-DA分析为有监督模式判别分析,能够很好地区分患者组与对照组样本并剔除假阳性差异物的出现。如图所示,两组样本得到良好区分。表明两组血浆代谢物之间存在显著差别。应用Profile Analyst 对数据进一步统计分析,选取占数据贡献率80%以上PC1与PC2以点阵形式将数据具象化,每一个点代表一种代谢物组分,患者组与对照组共性组分集中分布,差异组分离散分布,分离度越大的数据点表明该组分在两组之间差异越大。结果进一步表明,患者组与对照组存在代谢物差异。经过数据提取,得到一系列差异物准确分子质量信息。
差异代谢物的发现仅仅是第一步,只有明确代谢物的成分才能够进行深入研究。目前常用的代谢组学数据库主要有HMDB(http://www.hmdb.ca)、MassBank(https://massbank.eu/MassBank)、METLIN(https://metlin.scripps.edu)等,这些数据库涵盖大部分人体代谢物质谱数据,包括分子量信息及多级质谱信息。根据笔者得到的准确分子量,结合脓毒症疾病特点及本研究重点,通过检索上述代谢组学数据库,列出可能的代谢物成分。表格中成分亚油酸、棕榈油酸、花生四烯酸、亚麻酸、生育酸、硬脂酸、溶血磷脂酸和肾上腺素半曲酮在患者组中均有显著的变化,特别是花生四烯酸、亚麻酸和亚油酸等必需脂肪酸含量较正常对照组明显下调。说明患者组体内的脂肪代谢发生了紊乱,具体发生机制还需要进一步研究。
本研究建立了一种可靠的脓毒症患者血浆代谢组学分析方法,并应用该方法发现了重症脓毒症患者血浆中脂肪酸类物质的主要变化成分,为脓毒症脂肪酸代谢紊乱方面的研究提供了研究方向,能够为脓毒症发生及发展机理及临床诊断提供研究基础。

