滩涂禾草镶嵌群落植物斑块与土壤因子的对应分析
陈虹伊, 夏雯雯, 肖孟阳, 徐驰, 刘茂松
滩涂禾草镶嵌群落植物斑块与土壤因子的对应分析
陈虹伊, 夏雯雯, 肖孟阳, 徐驰, 刘茂松*
南京大学生命科学学院, 南京 210023
为研究镶嵌群落植物斑块特征与土壤性质的对应关系, 以江苏省盐城市的江苏大丰麋鹿国家级自然保护区内互花米草()-芦苇()-白茅()-獐茅()镶嵌群落为研究对象, 于2018年4月24日及25日, 分别采集各植物斑块0—10 cm、10—30 cm和30—60 cm深度的土壤样品, 测定土样的盐度、总有机碳含量、全氮含量、全磷含量、容重和平均粒径等理化指标, 并对其与不同植物斑块结构特征的对应关系进行了典范对应分析。研究结果显示:(1)植物斑块类型间土壤特征的主要差异体现在表中层, 其中盐度差异最显著, 其次为全氮、容重、总有机碳、土壤含水率、平均粒径, 全磷在植物斑块类型间、不同土壤层次间差异不显著; (2)土壤因子与植物斑块类型的对应关系随着土壤深度增加而减弱, 显著相关的土壤因子数量也逐渐减少; (3)典范对应分析显示, 与植物斑块特征的对应关系, 不同土层间总有机碳、含水率、容重、盐度具一致性, 而全氮、平均粒径、全磷层次间有较大差异。总体上,各指标在土壤层次间的分布特征往往因植物斑块类型而异,表浅层土壤总有机碳、盐度、容重以及含水率是植物斑块特征的主要影响因子。
镶嵌群落; 土壤深度; 典范对应分析; 互花米草
0 前言
在植物群落内部, 由于微地形变化、土壤湿度和盐渍化程度的差异以及人与动物的活动影响等环境因子的不均匀性, 群落中可形成若干相对均质的植物斑块,植物斑块相间特征明显的群落也可称之为镶嵌群落,灌丛化草原、灌丛化荒漠草原等都是典型的镶嵌群落[1]。镶嵌群落微生境土壤的异质性影响植物斑块的形成, 植物斑块也会影响微生境土壤的理化性质。乌云娜等[2]研究发现, 呼伦贝尔克氏针茅草原退化演替过程伴随着土壤养分在微生境斑块上的富积与迁移; 陈正勇等[3]对盐城滩涂湿地交错区群落研究发现, 与碱蓬()斑块、芦苇()斑块相比, 互花米草()斑块能显著提高其斑块内土壤的含水率并有效降低盐度, 改变土壤理化性质, 而土壤水分、盐度也会影响互花米草与碱蓬、芦苇的竞争关系。
植物群落或植物斑块与微生境土壤特征间往往存在一定的对应关系, 但对应关系可能因层次、指标而异。一般认为, 表层土壤特征与植物群落组成结构关系密切, 对土壤与植物群落特征相关关系的研究也多集中于0—20 cm深度土壤[4-7]; 或对较深层次土壤特征给予较小权重[8-9]; 但也有研究显示, 不同深度土壤特征与植物群落的相关关系存在一定差异。在黄河三角洲河口湿地, 盐地碱蓬多生长在表层盐度较高、深层盐度较低的盐分表聚型土壤中, 而白茅()和芦苇则多生长在深层盐度较高、表层盐度较低的盐分底聚型土壤中[10]。
植物群落的演替过程伴随植物斑块与微生境土壤的相互作用, 在快速淤积的滩涂土壤中, 不同深度土壤性质因沉积过程而存在较大差异, 研究滩涂植物斑块与不同深度土壤因子的相关关系, 有助于分析群落演替的动力学机制。在滩涂湿地, 特别是潮滩交错带, 经常可以发现多种植物斑块在几米到数百米空间尺度上交错分布, 形成较典型的滩涂镶嵌群落。本研究以江苏大丰麋鹿国家级自然保护区内的互花米草-芦苇-白茅-獐茅()镶嵌群落为研究对象, 对植物斑块特征与不同层次土壤因子的对应关系进行了比较研究, 期以(1)辨识不同层次影响植物斑块特征的主要土壤因子, (2)分析土壤理化性质与植物斑块对应关系的层次差异及成因机制。
1 材料与方法
1.1 研究区
研究区位于江苏省盐城市的江苏大丰麋鹿国家级自然保护区(32°56′N—33°36′N, 120°42′E—120°51′E)第III核心区, 为潮沟末尾端的淤泥质盐沼湿地, 地势低平, 为由互花米草、芦苇、白茅、獐茅等植物斑块构成的禾草镶嵌群落, 样地面积为1.37×104m2, 样地总盖度82.78%。研究地属湿润的季风气候, 年平均气温为14.1 ℃, 年降水量为1 068.0 mm, 全年无霜期达217.1 d。研究地湿地类型为淤泥质盐沼, 土壤为粉砂土。
1.2 样品采集及测定
于2018年4月24日及25日, 在对研究区全面调查的基础上, 在江苏大丰麋鹿国家级自然保护区第III核心区的白茅、獐茅、芦苇和互花米草4种斑块中, 分别设置3个1 m×1 m的小样方, 进行植物样方调查和土壤采样。
现场记录每个样方内植物的组成、盖度和株高(表1)。在每个样方, 设置4个采样点, 在每个采样点, 利用土锹分层挖土, 分别采集0—10 cm、10—30 cm和30—60 cm深度的土壤样品, 用塑料袋密封后, 带回实验室。
在实验室中, 将采集的土壤样品分为两部分。其中一部分土样用于测定土壤容重、土壤含水量、土壤平均粒径和土壤中的可溶性盐含量; 另一部分土样经过风干、研磨、过100目筛后, 测定土壤总有机碳、全氮和全磷含量。
采用环刀法[11], 测定土壤容重。采用烘干法[12], 测定土壤含水量。利用BT-9300Z激光粒度分布仪(丹东百特), 测定土壤平均粒径; 利用TZS-ECW-G土壤盐度计(托普云农), 测定土壤盐度(水: 土=5:1)[13]。

表1 各植物斑块的基本特征
表中平均盖度为目测法; 平均株高数值为均值±标准误差(SE); ** 0.01水平显著相关, * 0.05水平显著相关(=4)。
采用碱熔—钼锑抗分光光度法[14], 测定土壤中的全磷含量; 采用重铬酸钾氧化—外加热法[11], 测定土壤中的总有机碳含量; 采用半微量凯氏定氮法[15], 测定土壤中的全氮含量。
1.3 数据分析
综合优势比(Summed Dominance Ratio, SDR)[1]是一种综合数量指标, 包括两因素、三因素、四因素和五因素。本研究选用三因素的综合优势比(3)(即选取盖度、频度和高度), 来计算4种植物斑块在镶嵌群落中的综合优势比, 其计算公式为:
3=(′+′+′)/3×100% (1)
公式(1)中,′为某种植物的盖度与群落中盖度最大植物的盖度比;′为某种植物的频度与群落中频度最大植物的频度比;′为某种植物的高度与群落中高度最大物种的高度之比。
对所有土壤因子进行冗余分析, 筛选并舍去变异膨胀因子大于20、与其它因子有多重共线性的土壤因子。进行去趋势对应分析时, 其第一轴的长度为0.819, 应优先采用冗余分析, 但考虑到物种数据中0值较多, 基于线性模型的冗余分析在这种情况下易产生问题。对于典范对应分析可能存在弓形效应的问题, 在两个或两个以上有明显共线性的环境变量中, 只保留一个, 弓形效应就会消失[16]。因此, 采用典范对应分析方法, 研究镶嵌群落植物斑块结构特征与土壤因子的关系, 并筛选出对植物斑块结构影响较大的土壤因子。在典范对应分析中, 物种矩阵选择白茅、獐茅、芦苇和互花米草4种植物斑块在镶嵌群落中的综合优势比; 环境矩阵由土壤全磷含量、土壤总有机碳含量、土壤全氮含量、土壤盐度、土壤含水量、土壤容重和土壤平均粒径组成。采用蒙特卡罗置换检验, 综合检验7个土壤因子与植物斑块对应关系的显著性, 模拟次数选择999次。利用Canoco 5.0软件, 完成典范对应分析。
利用SPSS 19.0软件, 显著性水平按照a<0.05, 进行统计分析。采用单因素方差分析法, 用最小显著差法(Least-significant difference)进行多重比较, 比较4种植物斑块不同深度土壤的差异。
2 结果与分析
2.1 不同植物斑块的土壤理化性质
比较几类植物斑块主要土壤理化指标在各3个土壤层次中的相对大小发现, 总磷在不同植物斑块间、不同土壤层次间均无显著差异, 其他指标在不同土壤层次间的相对大小多存在差异, 并因植物斑块类型而异(图1)。
在0—10 cm深度土层中, 互花米草斑块中土壤盐度最大(11.92 ‰), 白茅斑块中最小(1.61 ‰); 互花米草斑块中土壤中总有机碳含量、全氮含量和含水量都最大, 分别为19.82 g·kg-1、7.43 g·kg-1和49.40%, 土壤容重和土壤平均粒径都最小, 分别为0.87 g·cm-3和16.47 μm。在10—30 cm深度土层中, 互花米草斑块中土壤盐度最大, 为8.97 ‰, 白茅斑块中最小, 为1.8 ‰; 互花米草斑块中土壤总有机碳、全氮和含水量同样都最大, 分别为7.11 g·kg-1、2.69 g·kg-1和37.40%, 土壤容重最小, 为1.26 g·cm-3, 土壤平均粒径无显著差异。在30—60 cm深度土层中, 互花米斑块中土壤总有机碳含量和含水量都最大, 分别为5.50 g·kg-1和36.42%, 獐茅斑块中土壤含水量最小, 为28.94%, 其它土壤指标无显著差异。
在互花米草斑块中, 随着土壤深度增加, 土壤盐度、土壤总有机碳含量和土壤全氮含量都减小, 土壤容重逐渐增大。在白茅斑块中, 随着土壤深度增加, 土壤盐度和含水量土壤全氮含量在表层最高。在獐茅斑块中, 只有土壤盐度随着土壤深度增加而减小, 其它土壤指标都无显著差异。在芦苇斑块中, 土壤容重在10—30 cm深度最大, 土壤平均粒径在0—10 cm深度最小, 其它土壤指标都无显著差异。
不同植物斑块间, 在0—10 cm土层中, 土壤盐度在互花米草斑块中最高、白茅斑块最低, 总有机碳、总氮、含水率在互花米草斑块中最高, 容重、平均粒径在互花米草斑块最低; 在10—30 cm土层中, 盐度在互花米草斑块中最高、白茅斑块中最低, 总有机碳、总氮、含水率在互花米草斑块最高, 容重在互花米草斑块最低。30—60 cm土层中, 总有机碳在互花米斑块中最高, 含水率在互花米草斑块中最高、獐茅斑块最低, 其余土壤指标无显著差异。
总体上, 在各土壤因子中, 盐度在不同植物斑块间、各斑块不同土壤层次间的差异均较大, 其次为总氮、容重、总有机碳、含水率、平均粒径, 而总磷在各植物斑块间、不同土壤层次间均无显著差异。

DS, 盐度; TOC, 总有机碳; TN, 全氮; TP, 全磷; BD, 容重; SW, 含水率; Mz, 平均粒径。图中数值为均值±标准误差(SE); 不同小写字母表示同一深度不同植物斑块间差异显著(n=3, P<0.05), 不同大写字母表示同类植物斑块不同深度间差异显著(n=3, P<0.05)。
Figure 1 Changes of soil factors in different plant mosaics by layers
2.2 植物斑块与土壤因子的典范对应分析
对0—10 cm、10—30 cm和30—60 cm的土壤因子与植物斑块特征的对应关系进行典范对应分析, 其前两个排序轴的特征值之和分别占总特征值的81.2%、76.7%和60.4%,可仅保留典范对应分析的前两轴(表2)。在0—10 cm深度土层, 同种植物斑块间的距离较小, 不同种植物斑块之间的距离比较大, 即白茅斑块、獐茅斑块、芦苇斑块和互花米草斑块被明显分开(图2)。随着土壤深度增加, 同种植物斑块在排序图上分布逐渐分散。显示土壤因子对镶嵌群落植物斑块结构的影响在表层最大, 随着土壤深度增加, 其影响逐渐减弱。
在0—10 cm深度土层,具有高含量的盐度、总有机碳、全氮、含水率以及低容重、低平均粒径的土壤条件与互花米草的分布对应, 獐茅则与之相反; 白茅和芦苇的分布与土壤盐度、总有机碳含量、全氮含量和土壤含水量呈负相关关系, 与土壤容重和土壤平均粒径呈正相关关系。在10—30 cm深度土层, 具有高含量的总有机碳、全氮、含水率以及低容重、低平均粒径的土壤条件与互花米草的分布对应, 其它3种植物斑块则与之相反, 4种植物对土壤盐度的适宜度依次为互花米草、獐茅、芦苇和白茅。在30—60 cm深度土层, 具有高含量的总有机碳、含水率以及低容重的土壤条件与互花米草的分布对应, 具有高容重以及低含水率的土壤条件与獐茅的分布对应, 具有低含量的总有机碳以及高平均粒径的土壤条件与白茅和芦苇对应。

表2 不同深度土壤与植物斑块的典范对应分析前两轴的特征值、物种—环境相关性和累计百分比方差
单独解释率为单独使用该土壤指标所获得的解释率(R2)。典范对应分析显示,各土壤因子的单独解释率随土壤深度的增加呈下降趋势, 但在不同层次其相对解释率有较大差异(表3)。比较发现, 随土壤深度增加, 土壤盐度、总氮、总重的单独解释率排名呈下降趋势, 而土壤总有机碳、含水率、平均粒径和总磷呈上升趋势。
蒙特卡罗置换检验结果显示, 在土壤0—10 cm层与植物斑块对应关系极显著的有盐度、总有机碳、总氮、含水率以及容重(<0.01), 显著相关的有平均粒径(<0.05); 在土壤10—30 cm层与植物斑块对应关系呈极显著的土壤因子有盐度、总有机碳、总氮以及容重(<0.01), 显著相关的有含水率、平均粒径(<0.05); 在土壤30—60 cm层与植物斑块对应关系显著的有总有机碳、容重和含水率(<0.05)。结果显示,影响植物斑块组成结构的土壤主导因子在层次间有较大差异, 表层的显著相关因子最多, 随土壤深度增加而显著相关因子逐渐减少。
在3个土层土壤总有机碳含量、含水量和容重都显著影响植物斑块组成结构。土壤盐度在3个深度土层与各植物斑块的对应关系相对一致, 其中0—10 cm和10—30 cm深度土层对应关系的显著性较高。土壤全氮含量和平均粒径在0—10 cm和10—30 cm深度土层对各植物斑块的对应关系一致且影响较强。总体上, 土壤总有机碳含量、含水量、容重和盐度对植物斑块结构特征的影响具一致性。
3 讨论
3.1 滩涂镶嵌群落植物斑块不同土壤因子的分布特征
植物群落与土壤条件密切相关, 同时也受温度、湿度、海拔、沉积环境等因素的影响。在面积较小、相对均质的较小空间尺度上, 由于其生境特征相对一致, 更能体现植物—土壤的相互关系[17]; 而由于镶嵌群落在某种程度上具有更强的“动态”特征, 植物斑块与土壤条件的对应关系往往处于非平衡状态, 表征植物群落-土壤因子的互作过程。
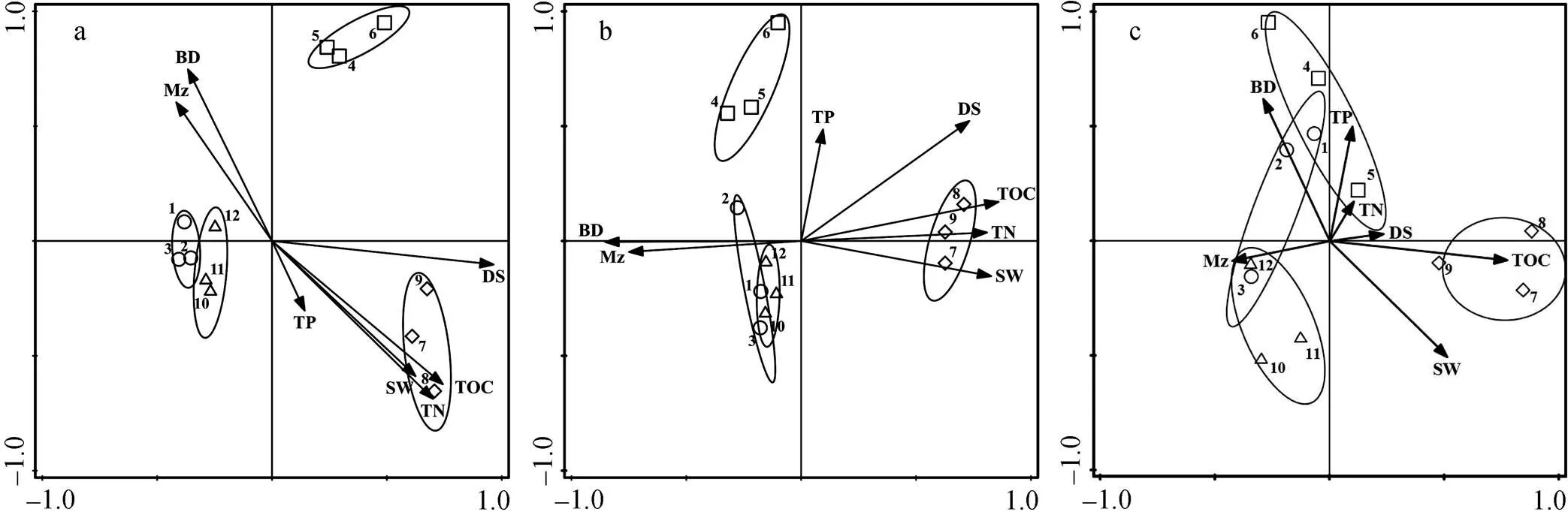
a, 0-10 cm层; b, 10-30 cm层; c, 30-60 cm层。DS, 盐度; TOC, 总有机碳; TN, 全氮; TP, 全磷; BD, 容重; SW, 含水率; Mz, 平均粒径。, 白茅斑块;, 獐茅斑块;, 互花米草斑块;, 芦苇斑块。
Figure 2 Canonical correspondence analysis of plant mosaics with soil factors for different layers

表3 不同深度土壤理化指标的单独解释率
一般认为, 土壤盐度和水分是影响滨海湿地植物生长、繁殖和空间分布的关键影响因子[18]。相关研究发现, 在滨海湿地, 芦苇和白茅多生活在低盐、相对高程高而不易淹水的地方[19-20], 而獐茅在高盐土壤中竞争力强[21], 多生活在盐度较高的地方;互花米草具有很强的水盐耐受性, 使它比其它植物具有更强的种间竞争力[22], 相对高程低、淹水深度大且土壤可溶性盐含量高的生境有利于互花米草的生长和扩张[23], 互花米草群落土壤盐度和有机碳含量也高于白茅群落和芦苇群落[6,20]。
本研究中, 镶嵌群落不同植物斑块之间土壤盐度、总有机碳含量和全氮含量差异较大, 而土壤物理性质平均粒径差异不显著, 其中, 互花米草斑块土壤的盐度、总有机碳含量和全氮含量显著高于芦苇和白茅斑块; 同时, 互花米草斑块土壤盐度、总有机碳含量和全氮含量在0—10 cm深度最大, 呈明显的表聚型分布, 白茅斑块土壤盐度呈底聚型分布, 芦苇斑块土壤盐度分布均匀。与相关研究中与植物斑块对应的植物群落的土壤特征[10,24-25],植物斑块0—30 cm深度土壤特征与相应植物群落的土壤特征有较高的相似性, 土壤中盐分和水分差异在植物斑块间差异也最大; 但本研究结果也显示,0—30 cm土层土壤因子的异质性显著影响滩涂湿地植物斑块的组成特征, 而较深层次土壤条件对植物斑块特征的影响相对较小, 且不同土壤因子间存在较大差异。
不同层次土壤因子在斑块水平和群落水平其与群落特征对应关系的差异性,一定程度可反映不同土壤因子对群落特征的作用性质或相对重要性。对地中海盐沼不同植物群落土壤的研究发现,除了盐度梯度,碱度梯度和土壤质地梯度也显著影响植物的分布[4];而胶州湾滨海互花米草群落主要与0—20 cm深度土层土壤氮、磷含量相关[26]。在本研究中,植物斑块间土壤平均粒径和土壤全磷含量差异较小,显示土壤质地与全磷含量在较小尺度的植物嵌块间影响相对较小,与相关研究结果有所不同,可能由于土壤平均粒径等指标更多反映了沉积环境,直接作用相对较小,而全磷含量则可能因植物群落影响了再分配过程所致。
3.2 不同层次土壤特征与滩涂镶嵌群落植物斑块的对应性
一般地, 随着土壤与植物长期的相互作用, 土壤与植物间可以形成相对稳定的对应关系, 在表层土壤中尤其明显, 在森林和草原生态系统的研究中, 有些研究仅取表层土壤分析植物—土壤关系[27-28]。但在滨海湿地, 由于复杂的近岸水文和沉积过程, 土壤处于频繁快速的冲淤演变过程中[17], 沉积物层层淤积, 不同深度土壤特征既反映了不同时期的成土条件和植被特征, 可能与当时植物斑块结构的对应关系存在较大差异。
在本研究中, 随着土壤深度增加, 与植物斑块组成结构显著相关的土壤因子减少, 同时不同土壤因子在不同深度土层与植物斑块特征的对应关系不同。其中, 土壤总有机碳在3个深度土层都与植物斑块类型显著相关,全氮含量只在表层和中层显著相关,总磷在各层次相关性均极弱,土壤容重和含水量在3个深度土层都显著相关,土壤盐度和平均粒径只在表层和中层显著相关。
土壤总有机碳主要来源于植物地上凋落物的腐解[29]和根际代谢[30], 植物的根系分布影响总有机碳含量的垂直分布[31], 体现了植物生长对土壤的改造作用; 随着入侵时间延长, 互花米草可显著提高土壤中的总有机碳含量[32]。全氮含量与不同层次土壤代谢环境差异相关, 如土壤深层的厌氧环境会抑制反硝化作用[33]; 全磷一般在土壤中迁移速率相对较低[34]。 盐分易随土壤水分的运动而迁移,研究地地势较高易发生盐分表聚作用,其0—10 cm和10—30 cm深度土层对植物斑块影响也较强;容重与植物生长条件及养分状况相关[35-36],一般容重较高的土壤的铁、锰含量也较高,可促进硫化物沉淀并降低根际土壤毒性[37],有利于植物生长[38];而土壤平均粒径较少因植物生长而改变,不同层次平均粒径主要与相应时期的沉积过程相关,应是其在不同土壤层次中与植物斑块对应关系不同的重要原因。
不同层次土壤因子在斑块水平与群落水平其与群落特征对应关系的差异性,一定程度可反映不同土壤因子对群落特征的作用性质或要对重要性。基于各土壤因子与植物斑块的对应关系的差异性,本文研究结果显示,改变表浅层土壤关键土壤因子,如通过微地貌或水文条件改变土壤的盐份、水份状态,应可影响或诱导滩涂湿地植被的演替趋势,促进退化滩涂湿地的生态修复。
4 结论
应用典范对应分析研究植物斑块组成结构与土壤条件层次间的相关关系, 初步揭示了对植物斑块组成结构特征起主导作用的土壤因子。本研究可得到以下几个结论:
(1)盐度、总有机碳、全氮、含水率、粒径、容重在同一土壤层次的不同植物斑块间以及同种植物斑块的不同土壤层次间差异均较大。不同植物斑块的土壤因子在土壤表浅层差异最大, 这种差异随着土壤深度增加而逐渐降低。
(2)通过典范对应分析发现,总有机碳、盐度、容重以及含水率与植物斑块对应关系显著性水平较高,全氮、平均粒径以及全磷较小,不同土壤因子与植物斑块的对应关系存在较大差异;同时,各因子对应关系的显著性水平总体上在土壤表层最大,随土壤深度增加而减弱。
[1] 杨持. 生态学[M]. 第二版,北京:高等教育出版社, 2008: 140, 127–128.
[2] 乌云娜,雒文涛,霍光伟,等.草原群落退化演替过程中微斑块土壤碳氮的空间异质动态[J].生态学报, 2014, 34(19): 5549–5557.
[3] 陈正勇,王国祥,刘金娥,等.苏北潮滩群落交错带互花米草斑块与土著种竞争关系研究[J].生态环境学报, 2011, 20(10): 1436–1442.
[4] MORENO J, TERRONES A, JUAN A, et al. Halophytic plant community patterns in Mediterranean saltmarshes: shedding light on the connection between abiotic factors and the distribution of halophytes[J]. Plant and Soil, 2018, 430(1): 185–204.
[5] HULISZ P, PIERNIK A, MANTILLA-CONTRERAS J, et al. Main Driving Factors for Seacoast Vegetation in the Southern and Eastern Baltic[J]. Wetlands, 2016, 36(5): 909–919.
[6] 张华兵, 刘红玉, 李玉凤, 等.盐城海滨湿地景观演变关键土壤生态因子与阈值研究[J]. 生态学报, 2013, 33(21): 6975–6983.
[7] 贺强, 崔保山, 赵欣胜, 等.黄河河口盐沼植被分布、多样性与土壤化学因子的相关关系[J]. 生态学报, 2009, 29(2): 676–687.
[8] 周李磊, 李华忠, 钟华平, 等. 新疆伊犁地区草地土壤全碳含量空间格局分析[J]. 草业科学, 2016, 33(10): 1963– 1974.
[9] CAMPBELL J, LACEY E, DECKER R, et al. Carbon Storage in Seagrass Beds of Abu Dhabi, United Arab Emirates[J]. Estuaries and Coasts, 2015, 38(1): 242– 251.
[10] WANG Zhuoran, ZHAO Gengxing, GAO Mingxiu, et al. Spatial variability of soil salinity in coastal saline soil at different scales in the Yellow River Delta, China[J]. Environmental Monitoring and Assessment, 2017, 189(2): 80.
[11] 北京林业大学. 土壤理化分析实验指导书[M]. 北京:北京林业大学出版社, 2002: 21–24, 96–98.
[12] 环境保护部. HJ 613-2011, 土壤干物质和水分的测定重量法[S]. 北京:中国环境科学出版社. 2011.
[13] 刘广明, 杨劲松, 姜艳. 江苏典型滩涂区地下水及土壤的盐分特征研究[J]. 土壤, 2005, 37(2): 163–168.
[14] 环境保护部. HJ 632-2011,土壤总磷的测定碱熔-钼锑抗分光光度法[S]. 北京:中国环境科学出版社, 2012.
[15] 鲍士旦. 土壤农化分析[M]. 第三版,北京:中国农业出版社, 2000: 44–49.
[16] BRAAK C, SMILAUER P. CANOCO Reference Manual and CanoDRAW for Windows user’s guide: software for canonical community ordination (v 4.5)[Z]. Microcomputer Power, Ithaca, 2002: 88.
[17] 叶万辉. 物种多样性与植物群落的维持机制[J]. 生物多样性, 2000, (01): 17–24.
[18] 杨桂山. 中国海岸环境变化及其区域响应[M]. 北京: 高等教育出版社, 2002: 12–15, 111–117.
[19] 张华兵,刘红玉, 李玉凤, 等. 自然条件下盐城海滨湿地土壤水分盐度空间分异及其与植被关系研究[J]. 环境科学, 2013, 34(2): 540–546.
[20] 丁文慧, 姜俊彦, 李秀珍, 等. 崇明东滩南部盐沼植被空间分布及影响因素分析[J]. 植物生态学报, 2015, 39(7): 704–716.
[21] MESLEARD F, TAN HAM L, Boy V, et al. Competition between an Introduced and an Indigenous Species: The Case of(Michx) Schribner and(Gouan) in the Camargue (Southern France) [J]. Oecologia, 1993, 94(2): 204–209.
[22] MEDEIROS D, WHITE D, HOWES B. Replacement ofby: The Role of Competition and Salinity[J]. Wetlands, 2013, 33(3): 421–430.
[23] 薛莲,李秀珍, 严中正, 等. 盐度和淹水对长江口潮滩盐沼植物碳储量的影响[J]. 生态学报, 2018, 38(9): 2995– 3003.
[24] 毛志刚, 王国祥, 刘金娥, 等. 盐城海滨湿地盐沼植被对土壤碳氮分布特征的影响[J]. 应用生态学报, 2009, 20(02): 293–297.
[25] 郗敏, 孔范龙, 李悦, 等. 胶州湾滨海湿地土壤的盐渍化特征[J]. 水土保持通报, 2016, 36(6): 288–292.
[26] 苗萍, 谢文霞, 于德爽, 等. 胶州湾互花米草湿地氮、磷元素的垂直分布及季节变化[J]. 应用生态学报, 2017(05): 1533–1540.
[27] 王慧敏, 毕润成, 庞春花. 山西太岳山森林群落分布及其与环境因子的关系[J]. 生态环境学报, 2018, 27(07): 1218–1223.
[28] GILLIAM F, DICK D. Spatial heterogeneity of soil nutrients and plant species in herb-dominated communities of contrasting land use[J]. Plant Ecology, 2010, 209(1): 83–94.
[29] GAO Jianhua, BAI Fenglong, YANG Yang, et al. Influence ofColonization on the Supply and Accumulation of Organic Carbon in Tidal Salt Marshes of Northern Jiangsu Province, China[J]. Journal of Coastal Research, 2012, 28(2): 486–498.
[30] RUMPEL C, KNABNER I. Deep soil organic matter—a key but poorly understood component of terrestrial C cycle[J]. Plant and Soil, 2011, 338(1): 143–158.
[31] JOBBAGY E, JACKSON R. The vertical distribution of soil organic carbon and its relation to climate and vegetation[J]. Ecological Applications, 2000, 10(2): 423–436.
[32] ZHANG Guangliang, BAI Junhong, JIA Jia, et al. Soil Organic Carbon Contents and Stocks in Coastal Salt Marshes withFollowing an Invasion Chronosequence in the Yellow River Delta, China[J]. Chinese Geographical Science, 2018, 28(3): 374–385.
[33] SCARONI A, LINDAU C, NYMAN J. Spatial Variability of Sediment Denitrification Across the Atchafalaya River Basin, Louisiana, USA[J]. Wetlands, 2010, 30(5): 949–955.
[34] VITOUSEK P, PORDER S, HOULTON B, et al. Terrestrial phosphorus limitation: mechanisms, implications, and nitrogen-phosphorus interactions[J]. Ecological Applications, 2010, 20(1): 5–15.
[35] MORRIS J, SUNDBERG K, HOPKINSON C. Salt Marsh Primary Production and Its Responses to Relative Sea Level and Nutrients in Estuaries at Plum Island, Massachusetts, and North Inlet, South Carolina, USA[J]. Oceanography, 2013, 26(3): 78–84.
[36] MATZKE S, ELSEY-QUIRK T.Productivity and Soil Organic Matter Response to Sedimentation and Nutrient Enrichment[J]. Wetlands, 2018, 38(6): 1233–1244.
[37] MENDELSSOHN I, MORRIS J. Eco-physiological constraints on the primary productivity ofLoisel[M]// WEINSTEIN M P, KREEGER D A. Concepts and Controversies of Tidal Marsh Ecology. Dordrecht: Springer, 2000: 59–80.
[38] SCHRIFT A, MENDELSSOHN I, MATERNE M. Salt Marsh Restoration With Sediment-Slurry Amendments Following A Drought-Induced Large-Scale Disturbance[J]. Wetlands, 2008, 28(4): 1071–1085..
Canonical correspondence analysis of plant mosaics and soil features in a tidal Gramineae mosaic community
CHEN Hongyi, XIA Wenwen, XIAO Mengyang, XU Chi, LIU Maosong*
School of Life Sciences, Nanjing University, Nanjing 210023, China
.To investigate the relationship between plant mosaic and soil propertiesdepended on edaphic factors, we investigated the mosaic soil features (salinity, total organic carbon, total nitrogen, total phosphorus, water content, mean grain size and bulk density) in 3 layers (0-10 cm, 10-30 cm and 30-60 cm) in amosaic community in a Yancheng coastal wetland in April 24 and 25, 2018. The relationship between soil factors and plant mosaics was analyzed with canonical correspondence analysis. The results showed that: (1) The main differences in soil characteristics by layer were observed between 0-10 cm and 10-30 cm in depth. The largest difference by layer and mosaics was found for salinity, followed by total nitrogen, bulk density, total organic carbon, water content and mean grain size. Total phosphorus had no significant differences for every plant mosaic and layers. (2) The relationship between soil factors and plant mosaics was weakened and the number of the significant correlative factors was decreased with the increase of soil depth. (3) The correspondence relationship of plant mosaics and soil features at different depths were inconsistent for total nitrogen, mean grain size and total phosphorus, while for the total organic carbon, water content, bulk density, salinity were consistent. Comparatively, soil total organic carbon, salinity, bulk density and water content in 0-30 cm depth had more impacts and might work as the main influential factors for the feature of plant mosaics.
mosaic community; soil layer; canonical correspondence analysis;
10.14108/j.cnki.1008-8873.2020.04.005
陈虹伊, 夏雯雯, 肖孟阳, 等. 滩涂禾草镶嵌群落植物斑块与土壤因子的对应分析[J]. 生态科学, 2020, 39(4): 33–40.
CHEN Hongyi, XIA Wenwen, XIAO Mengyang, et al. Canonical correspondence analysis of plant mosaics and soil features in a tidal Gramineae mosaic community[J]. Ecological Science, 2020, 39(4): 33–40.
Q948.2
A
1008-8873(2020)04-033-08
2019-11-18;
2020-01-04
国家重点研发计划(2017YFC0506200)
陈虹伊(1994—), 女, 中国台湾嘉义人, 硕士, 主要从事湿地生态学研究, E-mail: chygo_2017@163.com
刘茂松, 男, 博士, 副教授, 主要从事湿地生态学研究, E-mail: msliu @nju. edu. cn

