毒死蜱对于隆线和中华薄壳介混合种群的影响*
郑佳豪 李少南 程 攻
(浙江大学农药与环境毒理研究所,浙江 杭州 310029)
浮游动物在水生生态系统的物质循环和能量流动中起着重要作用,其群落结构可以动态反映生态系统对环境胁迫的响应。当受到农药等环境污染胁迫时,不同生态位的浮游动物会有不同的反应,通过观测浮游动物的种群及群落变化,可以对水生生态系统的健康状况进行预测。毒死蜱作为中国乃至全球范围内应用最广泛的有机磷杀虫剂之一,其对水生生物的影响已在室内和室外环境中均有广泛的研究,并得到了相应的效应临界值,如最高无作用浓度(NOEC)和最低有效浓度(LOEC)[1-2],[3]20,[4],[5]25,[6]。在农药的风险评估工作中,效应的临界值是非常重要的信息,过去的研究中通常只获得了NOEC或LOEC的理论浓度,本研究将尝试使用时间加权平均浓度。
隆线溞(Daphniacarinata)是水体中常见的甲壳纲动物[7-9],有着易饲养、繁殖快的优点,是生态毒理学研究的理想受试生物[10],但隆线溞很难单独生长。中华薄壳介(Dolerocyprissinensis)作为一类新兴的实验动物,正逐渐受到人们的关注[11],本研究将其与隆线溞组成混合种群,来研究毒死蜱对于隆线溞和中华薄壳介混合种群的影响。
N-乙酰-β-D-氨基葡萄糖苷酶(NAGase)是几丁质水解酶的一种,其在水中的主要来源是甲壳纲动物在蜕皮时分泌的蜕皮液[12]。NAGase比活力在个体层面与动物的体长、体重等相关,在群体层面与种群生物量相关,故可通过测定NAGase比活力来判断农药对甲壳纲浮游动物的影响[13]。
由于几丁质水解酶来源的多重性[14-17],而且水中的其他化学物质可能会促进或抑制NAGase的酶促反应,因此NAGase比活力的测定结果往往不能够准确反映被暴露种群的生物量。本研究选择了用特异性抗体测定抗原含量的方法来弥补这一缺陷。考虑到几丁质酶(chitinase)也存在于蜕皮液并与NAGase一起随着蜕皮过程的结束而释放到水中[18],本研究以隆线溞该酶基因原核表达蛋白制备抗体,用间接非竞争酶联免疫吸附法(ELISA)检测其游离态几丁质酶免疫可反应蛋白(chitinase-IR)来表征它的chitinase。因此,本研究拟通过种群密度、NAGase比活力和隆线溞chitinase-IR的测量来反映隆线溞和中华薄壳介混合种群在毒死蜱胁迫下的变化。
1 材料与方法
1.1 受试生物
隆线溞和中华薄壳介均采集自浙江大学华家池,在曝气后自来水(pH=7.4±0.1、电导率(178±2) μS、总溶解性盐(126±2) mg/L、溶解氧(8.0±0.3) mg/L)中饲养,环境温度控制为(25±1) ℃,预培养30 d后作为含隆线溞和中华薄壳介的培养液。
1.2 试验设计
取18个圆柱形玻璃水缸,给药前15天,每缸接种含隆线溞和中华薄壳介的培养液各1 L,再加入曝气后自来水至10 L,最终接种密度为:隆线溞506只/L,中华薄壳介378只/L,每3天添加30 mL螺旋藻粉溶液(2.78 g/L),使两种动物自然生长。给药后每天进行16 h光照(光照强度2 000~3 000 lx),8 h黑暗处理,只要动物生物量还处于动态平衡状态,就不再添加螺旋藻粉溶液。
给药方法:先将毒死蜱原药用丙酮配制成1 000、100、10 mg/L 3种母液。加入1 000 mg/L的母液52.5 μL得到毒死蜱质量浓度为5.25 μg/L的试验组;分别加入100 mg/L的母液164.0、51.0 μL得到毒死蜱质量浓度为1.64、0.51 μg/L的试验组;分别加入10 mg/L的母液160.0、50.0 μL得到毒死蜱质量浓度为0.16、0.05 μg/L的试验组;仅添加丙酮得到毒死蜱质量浓度为0 μg/L的试验组作为对照。所有试验组都添加丙酮量至164 μL。每组设立3个重复。
1.3 取 样
参考郎倩萍[19]的取样设计进行取样(见表1),取样后用等量曝气后自来水补充,浮游动物计数完毕后重新送回。
1.4 样品测定
1.4.1 残留毒死蜱
水样过0.22 μm滤膜后参考周艳明等[20]的方法进行固相萃取,固相萃取方法回收率为93.6%~107.8%,相对标准偏差为2.79%~4.89%。
固相萃取后用Agilent 7890b气相色谱仪进行检测,检测器为电子捕获检测器,色谱柱为HP-5毛细管柱(0.32 mm×30 m×0.25 μm)。升温程序为150 ℃保持2 min,以15 ℃/min升温至190 ℃,保持1 min,以5 ℃/min升温至240 ℃;不分流进样,进样体积为1 μL,进样口温度为240 ℃;检测器温度为250 ℃,载气用高纯氮气(纯度99.999%),恒压为103.425 kPa。毒死蜱的保留时间为8.700 min,检出限为0.005 μg/L。
1.4.2 浮游动物种群密度
由于中华薄壳介大多贴缸壁生活,所以计数前先要进行搅动,然后取100 mL水样对隆线溞与中华薄壳介进行肉眼计数,重复10次后取平均数,计算种群密度。
1.4.3 几丁质水解酶
将待测水样通过0.22 μm的微孔滤膜抽滤处理后,测定几丁质水解酶,其中NAGase比活力参考HANSON等[21]的方法测定,检出限为0.003 3 U/L。
利用郎倩萍等[22]研究得到的隆线溞chitinase原核表达蛋白制备多克隆抗体。参考KITTELBERGER等[23]的方法进行间接非竞争ELISA,筛选出抗体的最适反应浓度[24]。在抗体最适反应浓度下,再用间接非竞争ELISA测量隆线溞chitinase-IR,检出限为0.024 1 μg/mL。
参考文献[25],选取5种甲壳纲动物(锯缘真剑水蚤(Eucylopsserrulatus)、中华薄壳介、掌肢新米虾(Neocaridinapalmata)、隆线溞和老年低额溞(Simocephalusvetulus))进行抗体交叉反应性测定,结果表明,隆线溞与隆线溞、老年低额溞的交叉反应率分别为100.00%、10.46%,而与锯缘真剑水蚤、中华薄壳介、掌肢新米虾的交叉反应率均小于0.28%。由此可见,测定的chitinase-IR确实为隆线溞产生的。

表1 取样设计
1.5 数据处理
使用DPS©软件进行方差分析和多重比较分析[26]。使用CANOCO 5软件进行冗余分析(RDA)[27]。
2 结果与分析
由表2可见,残留毒死蜱随时间的延长逐渐降低,这是因为毒死蜱会发生光解[28-30],也存在挥发和缸壁的物理吸附等情况。残留毒死蜱随时间的变化按式(1)进行拟合[31],[32]4,得到表3。各试验组的降解速率均随时间延长逐渐降低,这是由于毒死蜱的降解产物三氯苯酚对酶促反应和微生物有抑制作用[32]5,[33]。总体而言,毒死蜱质量浓度越高的试验组,其平均降解速率越快。
y=ae-bx
(1)
式中:y为残留毒死蜱质量浓度,μg/L;x为时间,d;a、b分别为拟合系数。
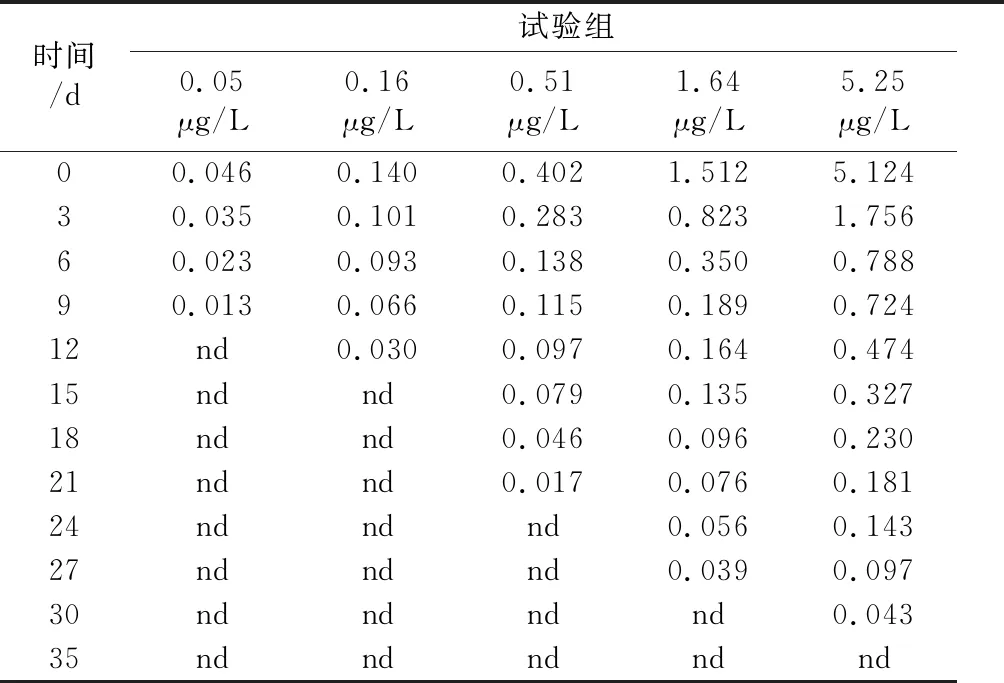
表2 残留毒死蜱质量浓度1)
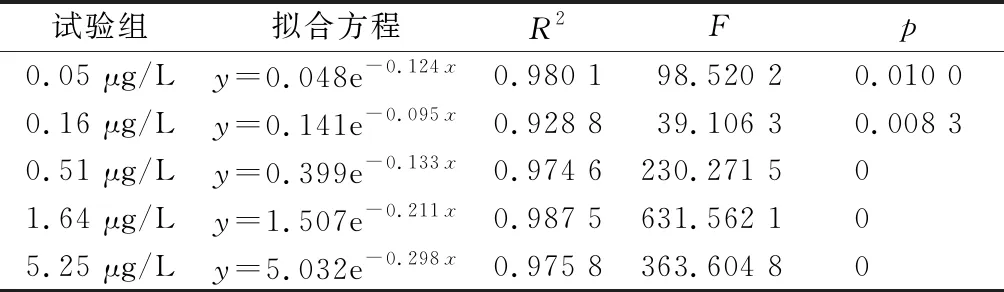
表3 毒死蜱的衰减方程
从图1可以看出,在低质量浓度(0.05 μg/L)毒死蜱作用下,毒死蜱可能对隆线溞及中华薄壳介有一定的刺激作用;但在质量浓度高于0.05 μg/L的毒死蜱作用下,两种生物的种群密度基本均随毒死蜱暴露浓度的升高而降低。不过,在试验后期,随着水中残留的毒死蜱浓度降低,两种生物的种群密度基本不再减少,隆线溞的种群密度甚至还出现了回升。
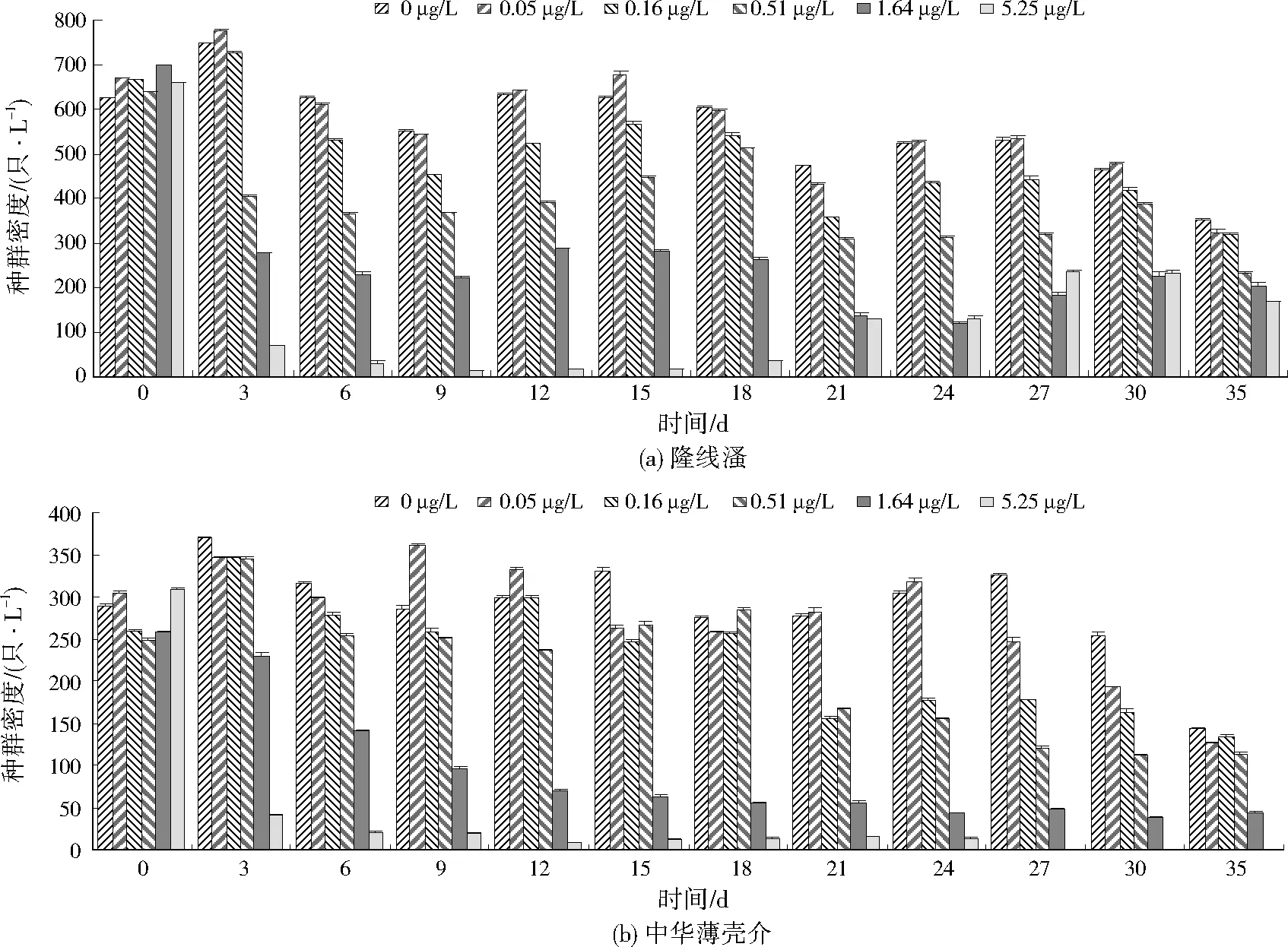
图1 毒死蜱胁迫下的浮游动物种群密度变化Fig.1 Zooplankton population density variation under chlorpyrifos exposure
从图2(a)可以看出,在施药之后,随着时间的延长,毒死蜱逐渐对NAGase比活力产生了抑制作用,特别是0.51、1.64、5.25 μg/L的试验组,但随着水中残留的毒死蜱浓度降低,与浮游植物种群密度变化类似,试验后期NAGase比活力又有所回升。从图2(b)可以看出,隆线溞chitinase-IR变化与NAGase比活力变化基本一致,但由于抗体的特异性,隆线溞chitinase-IR变化与隆线溞种群密度的变化更加一致。
3 讨 论
基于表4的多重比较结果,得到毒死蜱针对各测定参数的NOEC和LOEC理论值(分别记为NOECnominal和LOECnominal),再根据参考文献[34]中推荐的算法算出与NOECnominal或LOECnominal相对应的时间加权平均浓度,分别记为NOECTWA和LOECTWA,结果如表5所示。
由表5可见,毒死蜱对隆线溞种群密度的LOECTWA为0.172 μg/L,明显高于对中华薄壳介种群密度的LOECTWA(0.051 μg/L),说明中华薄壳介对毒死蜱的敏感性要高于隆线溞,这也解释了隆线溞的种群恢复速率比中华薄壳介快。NOECTWA的结果也同样说明这一问题。
RDA表明,隆线溞和中华薄壳介的因变量分值分别为-0.908 1、-1.084 1,表明毒死蜱对中华薄壳介的总体影响比对隆线溞强烈,这与表5中NOECTWA或LOECTWA的表征结论一致。
本研究中涉及两种几丁质水解酶,分别是chitinase和NAGase。在NAGase比活力测定中,胶体几丁质、对硝基苯-N-乙酰-β-D-氨基葡萄糖苷、4-甲基伞形酮-2-乙酰氨基-2-脱氧-β-D-吡喃葡萄糖苷(4-MUF-NAG)均可以作为底物。以胶体几丁质作为底物[35]时,由于胶体几丁质的水解一般会受到chitinase的制约,导致测定结果不能完全作为NAGase活性的判断依据[36],因此本研究以4-MUF-NAG作为底物,使NAGase比活力测定结果更加可靠。

图2 毒死蜱胁迫下NAGase比活力和隆线溞chitinase-IR变化Fig.2 NAGase specific activity and chitinase-IR of Daphnia carinata under chlorpyrifos exposure

表4 各测定参数多重比较结果1)
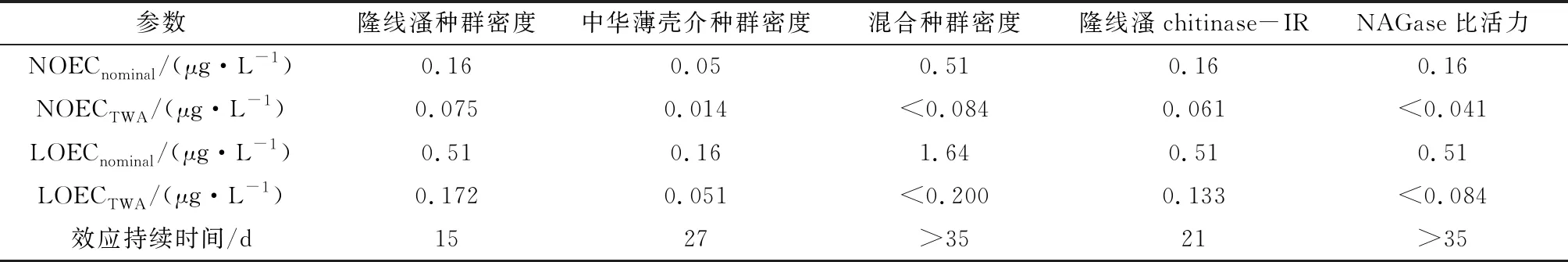
表5 各测定参数的时间加权平均浓度计算结果
对NAGase比活力和隆线溞chitinase-IR进行RDA发现,酶指标对毒死蜱的反应不如种群密度敏感,但隆线溞chitinase-IR的敏感性高于NAGase比活力。
4 结 论
在毒死蜱质量浓度高于0.05 μg/L的条件下,毒死蜱对两种生物会有抑制作用,并且基本随暴露浓度的升高而增强。不过,随着水中残留的毒死蜱浓度降低,抑制作用会减弱。计算毒死蜱对隆线溞和中华薄壳介的NOEC和LOEC发现,中华薄壳介对毒死蜱的敏感性高于隆线溞。在生态风险评估工作中, NOEC或LOEC使用时间加权平均浓度会使评价结果更加准确。
(致谢:隆线溞经过南开大学生命科学学院王新华教授鉴定,中华薄壳介经过华东师范大学生命科学学院禹娜教授鉴定,在此一并表示感谢!)

