米糠渥堆发酵过程中代谢产物和菌群变化研究


摘 要:米糠是很好的发酵饲料原料,但其固态发酵过程中的菌群及其代谢产物变化却少有报道。本文以全脂米糠为单一发酵原料,分别接种发酵乳杆菌MRS8、枯草芽孢杆菌ZLK1或地衣芽孢杆菌BL50,研究发酵过程中乳酸、乙酸、乙醇等代谢产物及其菌群的变化情况。发酵起始时,米糠中乳杆菌科占比在80%以上,随着发酵启动,空白组中肠杆菌科增殖很快,但乳酸含量变化最小。发酵乳杆菌MRS8组乳酸升高最快,两天达到最大值。枯草芽孢杆菌ZLK1组乳酸含量随着发酵时间延长持续升高。研究表明:外加益生菌株发酵可以提高米糠发酵的乳酸含量,并降低有害菌的丰度。
关 键 词:发酵乳杆菌;枯草芽孢杆菌;地衣芽孢杆菌;乳酸
中图分类号:TQ 929 文獻标识码: A 文章编号: 1671-0460(2020)07-1406-04
Study on Metabolites and Microbial Changes in
Rice Bran During Fermentation
LU Zong-mei
(COFCO Biotechnology Co., Ltd., Bengbu Anhui 233010, China)
Abstract: Rice bran is a good raw material for fermented feed, but the changes in the flora and its metabolites during the fermentation process are not well studied. In this paper, the rice bran was inoculated with Lactobacillus fermentum MRS8, Bacillus subtilis ZLK1 or Bacillus licheniformis BL50, respectively. The changes of lactic acid, acetic acid, ethanol and other metabolites and their flora during fermentation were studied. At the beginning of fermentation, the proportion of Lactobacillaceae in rice bran was above 80%. Compared to other three treatment groups, the abundance of Enterobacteriaceae in the blank group proliferated quickly, but the change of lactic acid content was the least. The lactic acid in rice bran treated by the Lactobacillus fermentum MRS8 increased very quickly and reached the maximum in two days. The lactic acid in rice bran treated with Bacillus subtilis ZLK1 continued to increase with the fermentation. The study shows that probiotic strain fermentation can increase the lactic acid of rice bran and reduce the abundance of harmful bacteria Enterobacter.
Key words: Lactobacillus fermentum; Bacillus subtilis; Bacillus licheniformis; Lactic acid
发酵饲料富含益生菌及活性代谢产物,在畜禽养殖中有望替代饲用抗生素而日益受重视[1-2]。米糠是稻谷加工成精米剩余的种皮和胚,是稻谷加工的主要副产物,占稻谷总重5%~8%。2016年我国稻谷产量为20 693.4万t,由此推算每年可产米糠约1 000万t以上。米糠中含有丰富的营养物质及活性功能成分,是非常好的食品、饲料原料 [3-4]。目前,米糠已经被广泛应用于发酵食品以及发酵饲料的生产,但米糠发酵过程中的物理化学变化和菌群的变化研究还比较少。本文就单一米糠发酵过程中的代谢物和菌群变化进行了研究,为米糠的发酵利用提供参考。
1 实验部分
1.1 试验材料
全脂米糠由中粮饲料科技公司提供。发酵菌株发酵乳杆菌MRS8和地衣芽孢杆菌BL50由中粮营养健康研究院分离并提供,枯草芽孢杆菌ZLK1由中粮生物科技股份公司分离保存。MRS培养基、LB培养基购于北京陆桥技术股份有限公司。
1.2 仪器设备
DL-CJ-2ND I型超净台,北京东联哈尔仪器制造有限公司;IMH100-SSS型培养箱,赛默飞世尔科技公司;高效液相色谱仪,安捷伦1260,色谱柱:Bio-RadAminex HPX-87HColumn(300 mm×7.8 mm 8 μm);紫外分光光度计,上海天美科学仪器有限公司。
1.3 试验方法
发酵种子液制备:将发酵乳杆菌MRS8接种到含有100 mL MRS培养基的250 mL摇瓶中,将枯草芽孢杆菌ZLK1和地衣芽孢杆菌BL50分别接种到含有100 mL LB培养基的250 mL摇瓶中,
150 r·min-1,37 ℃培养16 h。培养结束后,取发酵种子液,5 000 r·min-1离心10 min,弃去上清,留下菌泥,加入相应量的无菌水,将3个菌的浓度分别调至OD600 nm为5.63。
渥堆发酵:米糠发酵处理如表1所示。将混合均匀的米糠分别放入10 L敞口塑料桶内,放置在25~30 ℃房间内自然发酵,并监测温度,每天早、晚翻搅一次。每个发酵处理每隔24 h 收集样品100 g,连续收集7天。收集的样品马上放置于-80 ℃冻存,用于有机酸及菌群多样性的检测。
1.4 指标测定
1.4.1 发酵过程中乳酸等代谢产物测定
米糠中的代谢产物测定参照贾铮等[5]液相方法略做修改,以5 mmol·L-1硫酸溶液為流动相,流速0.50 mL·min-1,柱温55 ℃,DAD检测波长为210 nm,以保留时间结合待测物质的紫外特征吸收光谱进行定性分析,结合外标法进行定量。液相样品制作如下:准确称取2.00 g发酵米糠,加入48 mL蒸馏水中,震荡混匀30 min,用手持pH计测定pH并记录数值,然后用漏斗过滤得到粗滤液,粗滤液再经0.45 μm滤膜过滤放入液相瓶中,标记好样品名称,上机检测。
1.4.2 发酵过程中菌群变化分析
将-80 ℃冻存的样品用干冰邮寄至上海派森诺生物科技有限公司进行16S rRNA 的V3-V4区域扩增、测序及数据分析。
2 结果与分析
2.1 发酵过程中理化指标及代谢产物变化
2.1.1 米糠渥堆发酵过程中pH值变化
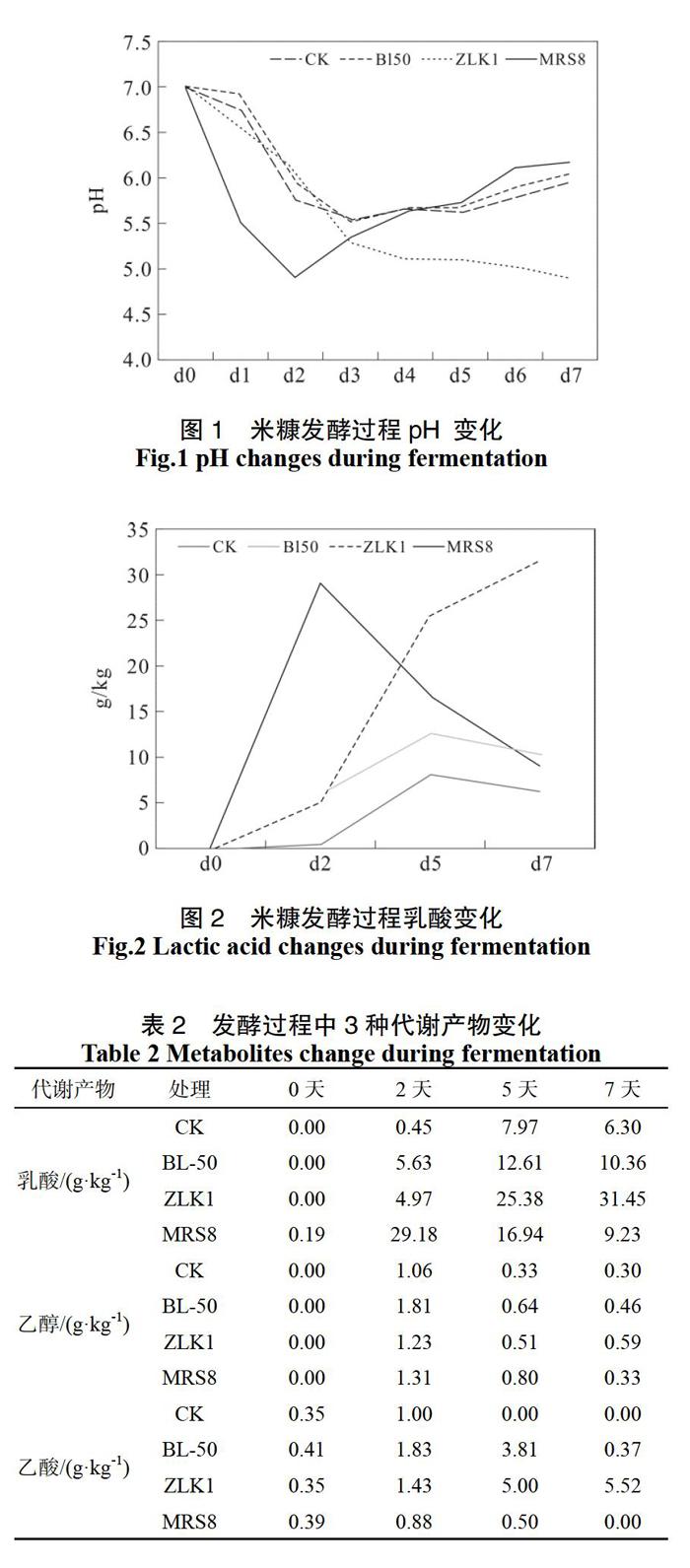
随着发酵时间的增加,除ZLK1处理组一直降低外,其他3组先降低后升高。地衣芽孢杆菌BL50处理组和CK空白组pH的走势比较一致,且pH在第3天降低到最低点后回升。而发酵乳杆菌MRS8组在前24 h pH降低最陡而后变缓,到48 h达到最低之后开始回升(见图1),表明在前24 h,乳酸菌生长代谢很活跃,产生乳酸较多,pH下降较快。
2.1.2 发酵过程中乳酸等代谢产物变化
从液相检测的结果来看,发酵第2天,发酵乳杆菌MRS8组乳酸产量已经达到最高值29.18 g·kg-1,两个芽孢杆菌组还在5 g·kg-1,而空白组中乳酸含量基本没有变化(见图2、 表2)。空白组的乳酸在整个发酵过程中升高最小,而ZLK1组随着时间延长乳酸含量进一步增加,并高于发酵乳杆菌MRS8组,这也是pH随时间延长逐渐降低的原因。整个发酵过程中乙酸、乙醇的变化不明显(见表2)。液相数据中乳酸的积累与pH值的变化相一致。
2.2 发酵过程中菌群变化
从测序结果来看,米糠中乳杆菌科的丰度最高(占比75%~95%),其次是肠杆菌科,两者之和占比将近95%(见图3)。在发酵过程中,各组的菌群变化差异很大,外接菌种作用效果明显。从起始(d0)、2天(d2)、5天(d5 )到7天(d7),空白组CK 中乳杆菌科依次变化为 82.25%、8.43%、26.61%和59.42%,而肠杆菌科依次为8.87%、87.5%、64.65%和34.02%。前48 h,乳杆菌科细菌丰度下降很快而肠菌科上升很快,后3天,乳杆菌科细菌又逐渐增加并成为最优势菌,而肠菌科则大大降低。发酵乳杆菌MRS8组,乳杆菌科细菌的变化依次为96.87%、86.71%、60.24%、86.96%,肠杆菌科依次为0.39%、5.68%、22.57%和3.90%,整个发酵过程中乳杆菌科都是最优势菌群,并且肠菌科细菌的生长被很好地被抑制了。
再看地衣芽孢杆菌BL50组,乳杆菌科细菌的变化依次为90.57%、67.60%、79.74%和88.29%,肠杆菌科细菌的变化依次为4.00%、16.33%、16.72%和8.82%,而芽孢杆菌科依次为0.42%、10.32%、2.15%和1.22%,这与发酵乳杆菌组有点相似,地衣芽孢杆菌在前24 h有较快的生长,且地衣芽孢杆菌BL50和乳杆菌科细菌有很好的协同,这使乳杆菌科在整个发酵过程中始终维持第一优势地位。而枯草芽孢杆菌ZLK1组,乳杆菌科细菌的变化依次为73.83%、15.78%、49.69%和62.80%,肠杆菌科变化依次为22.05%、24.94%、8.34%和5.34%,芽孢杆菌科变化依次为0.90%、56.79%、9.36%和29.35%,表明发酵前24 h,枯草芽孢杆菌增殖很快,并抑制了乳杆菌科细菌的生长,而在发酵的后5天,对乳杆菌科细菌的生长没有抑制。
从科的水平比较细菌变化比较笼统,因此从OTU水平来比较。从表中可以看到,米糠发酵过程中主要优势菌有8种,在发酵起始时,乳杆菌科的OTU1占比最高(61%~96%),随着发酵开始,米糠中乳酸片球菌属(OTU2、OTU3)快速增殖(除MRS8外), 尤其是BL50组,增长非常快,表明BL50有促进乳酸片球菌生长的作用。
空白组(CK) 肠杆菌科(OTU6、 OTU7、 OTU8)在发酵前24 h较快增殖并维持一定比重。而在其他3个接种益生菌株的发酵米糠中,尤其是发酵乳杆菌MRS8组,肠杆菌科细菌生长受到了极大限制,丰度一直极低,两芽孢杆菌组中肠杆菌科细菌丰度稍高,但也随着发酵时间延长而降低(表3)。
3 结 论
从米糠发酵结果来看,菌群变化与乳酸含量及pH值变化息息相关,且乳酸片球菌属在米糠发酵过程中逐渐占据主导地位。发酵乳杆菌MRS8在前48 h生长较快并产生大量乳酸,抑制肠菌科细菌生长。枯草芽孢杆菌ZLK1可以促进乳酸菌的生长,并能抑制利用乳酸作为碳源的细菌生长,从而使乳酸在发酵过程中持续积累。不同的菌株发酵的效果很不一样,不添加外源菌,米糠也能很好地发酵,但肠杆菌科丰度高,而肠杆菌科多数是有害菌,并且发酵产生的乳酸含量低。因此,米糠自菌发酵生产发酵饲料质量会比较差。
参考文献:
[1] 蔡辉益.生物饲料将成为未来发展趋势[J].甘肃畜牧兽医,2017, 47 (3):23.
[2]金渭武,安泰,郑晓卫,等.发酵饲料的应用及其对环境的影响[J].当代化工,2017,46(9):1887-1890.
[3]高佰华.米糠的营养及在饲料生产中的应用[J]. 现代畜牧兽医, 2019(7):33-35.
[4]张艳,陈文丹,张传智,等.米糠发酵食品的研究进展[J].食品安全导刊,2017(18):67.
[5]贾铮,肖志明,李兰,等.基于离子排斥色谱的饲料酸化剂中多种有机酸同步检测[J].农业工程学报,2016,32(12):303-308.
收稿日期:2020-03-09
作者简介:卢宗梅(1970- ),女,安徽蚌埠人,高级工程师,研究方向:微生物发酵工程。E-mail:liulu1996@163.com。

