肌肉蛋白与挥发性风味物质的相互作用机制及影响因素研究进展
殷小钰,刘昊天,邹汶蓉,孔保华,陈 倩
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
风味是衡量肉制品品质特性的主要指标之一,在很大程度上影响着消费者对产品的接受性[1]。人体对风味化合物的感知主要取决于各种挥发性成分的浓度、阈值等,其与挥发性成分的温度、蒸气压和其他食品成分有关[2]。在肉类食品风味形成过程中,肌肉蛋白对风味形成的贡献作用主要表现在两个方面:一是蛋白质的降解作用,在该过程中产生的小肽和游离氨基酸是形成风味化合物的前体物质,这些物质的释放与降解可调节挥发性化合物与非挥发性化合物的组成,进而影响肉制品的整体风味[3],但是这种作用是非常有限的;更多情况下,蛋白质通过物理或者化学方式实现对挥发性成分的吸附,进而改变风味物质的顶空浓度,通过提高挥发性成分的传质阻力而在不同程度上改变风味的整体平衡,对风味的释放产生很大影响[4]。随着人们对肉及肉制品品质需求的提升,了解肉类基质(肌肉蛋白)与风味物质之间的相互作用,不仅有利于挥发性成分在加工及贮藏过程中的保持,而且对生产和改进具有良好风味的产品具有重要意义。
1 肌肉蛋白的组成及结构
根据蛋白质在肌肉组织上位置的不同,肌肉蛋白可以分为肌原纤维蛋白、肌浆蛋白和基质蛋白[5]。肌原纤维蛋白是影响肌肉食品品质的重要结构蛋白,主要包括肌球蛋白、肌动蛋白、原肌球蛋白、肌原蛋白等[5],其中,肌球蛋白(占肌原纤维肉类蛋白总质量的43%)和肌动蛋白(占肌原纤维肉类蛋白总质量的20%)是肉中两种主要的肌原纤维蛋白。肌球蛋白是粗丝的主要成分,每根粗丝含有约400 个肌球蛋白分子,其形状很像“豆芽”,主要由α-螺旋结构构成。肌动蛋白是构成细丝的主要成分,以G-肌动蛋白(球状)和F-肌动蛋白(纤维状)两种形式存在于肌肉蛋白中[5]。肌球蛋白和肌动蛋白共同参与肌肉的收缩过程,结合形成肌动球蛋白,也可以在体外产生,增加溶液的黏度[6]。作为肉中最易提取的水溶性蛋白,肌浆蛋白中含有肌溶蛋白、肌红蛋白、肌浆酶和肌粒蛋白等。可见,肌肉蛋白质是一种复合体系的蛋白质,并且由于其结构的特殊性,关于肌肉蛋白与风味物质相互作用的研究进展较为缓慢。
2 肌肉蛋白与风味物质的相互作用机制
肉及肉制品中原有的和加工过程中发生美拉德反应、脂质氧化降解及其相互作用产生的风味物质主要有含硫化合物、含氧杂环、含氮杂环化合物、醛类、酮类、醇类、酸类、内酯类等。至今在热加工肉制品中已鉴定出1 000多种挥发性化合物。目前,蛋白质与风味物质相互作用机制研究最多的β-乳球蛋白模型,由于肌肉蛋白质的化学结构(如氨基酸侧链、蛋白质末端基团以及疏水区域)较为复杂,而且传质过程又与黏度和蛋白质的凝胶结构有关,因此肌肉蛋白质与风味物质之间的作用机制具有多样性[7]。蛋白质与风味物质的相互作用主要包括物理结合、化学相互作用和传质效应[7]。在肉及肉制品中,疏水相互作用是维持蛋白质与风味物质相互作用的主要作用力。
2.1 物理结合
蛋白质与风味物质之间的物理结合主要包括范德华力和毛细管吸附作用,为可逆结合[8]。一般情况下,风味化合物被物理截留在蛋白质的毛细管和裂隙中以此来影响它们的风味性质[9],这主要与蛋白质和风味物质的组成及性质相关,没有统一的结合机制[10]。
2.2 化学相互作用
化学相互作用包括可逆的弱疏水相互作用、强烈的离子效应和不可逆的强共价键[11]。在肉及肉制品中,疏水相互作用是维持蛋白质与风味物质相互作用的主要作用力(图1),这也是多肽链的特殊折叠及蛋白质结构趋向稳定的一种表现[12]。在液体和高水分食品中,风味物质与蛋白质结合的作用机制主要涉及非极性风味化合物与蛋白质表面的疏水区域或空腔的相互作用。一般而言,表面疏水性较强的蛋白也会在分子表面对风味化合物直接进行吸附[13]。现阶段认为,在蛋白质的结构中具有一些相同的、但又互相独立的结合位点,这些存在于空腔中的位点通常由疏水性残基构成,可以与风味化合物发生相互作用,进而结合风味化合物[9]。对于那些表面疏水性较弱的蛋白质分子,风味物质则会进入到蛋白分子内部与空腔的这些疏水位点发生作用进行结合[14]。此外,含有极性基团(如羟基和羧基)的风味化合物可以通过氢键和离子效应与蛋白质结合[15]。一些低分子质量的羰基类化合物(如醛、酮类化合物)会与蛋白质分子中的疏水性氨基酸残基发生共价结合形成可逆的席夫碱,但分子质量较大的羰基化合物(如醛、酮类化合物)是以不可逆的方式与氨基结合[16]。
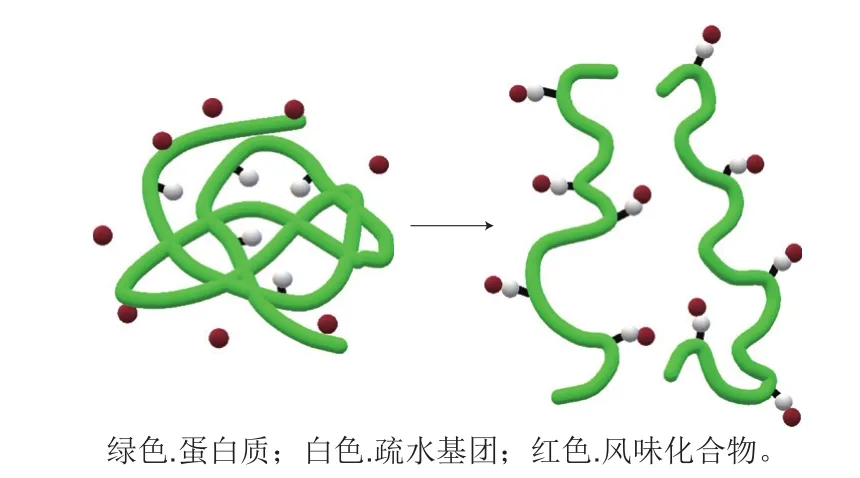
图1 蛋白质(展开)与风味化合物的疏水相互作用模型[10]Fig.1 Hydrophobic interaction models of proteins (unfolding) with flavor compounds[10]
蛋白质与羰基化合物的共价结合主要是通过蛋白质中氨基酸残基(—SH和—NH2)与风味化合物发生作用形成的[14]。半胱氨酸(Cys)和甲硫氨酸(Met)是肉制品中两种主要的含硫氨基酸,其中的巯基可参与蛋白质分子间和分子内的二硫键交联,维持蛋白质结构的稳定。若蛋白质中含硫氨基酸含量较少,则不易与蛋白质中巯基与风味化合物的结合;若蛋白质中含硫氨基酸较多,一部分巯基参与维持蛋白结构稳定的二硫键的形成,尚有一部分有效巯基可与风味化合物发生共价结合,增加蛋白质与其结合程度[14]。另外,蛋白质中赖氨酸(Lys)残基的氨基也会通过共价键作用与风味化合物发生结合,但是与含硫氨基酸残基相比,含氨基的氨基酸残基更容易与风味化合物发生共价结合[17]。
2.3 传质阻力
在食品体系中,蛋白质经常用于提供黏性或发生凝胶化[18]。体系黏度的增大和凝胶结构会阻碍风味化合物的传质过程,影响风味物质的释放。其中,凝胶化作用更为显著,只有当凝胶结构被破坏时,风味物质才能够从食物中释放[19]。肌肉蛋白中,肌原纤维蛋白的热凝胶特性对肉及肉制品的质构特性具有重要影响,其形成热诱导凝胶的能力非常强,质量分数0.5%时就足以使其发生凝胶化[20]。在形成凝胶的过程中,肌球蛋白的作用比较大,而肌动蛋白不具备形成凝胶的能力,但是其比例可以影响所形成凝胶的刚性[21]。
肌肉蛋白是一种结构和流变学性质非常复杂的蛋白,因此,其与风味成分的相互作用机制还有待进一步深入研究,特别是作用位点的确定以及这些作用位点各自倾向于与哪种风味成分结合。
3 肌肉蛋白与风味物质相互作用的影响因素
肌肉蛋白质及挥发性化合物的相互作用与蛋白质性质、风味物质类型、离子强度、pH值、蛋白质氧化和加热温度有关[22],但不存在统一的作用机制。其中蛋白质的浓度、加热温度、pH值以及蛋白质氧化可以诱导蛋白质构象的变化,进而影响蛋白质与风味物质的相互作用[21]。因此,探讨诱导肌肉蛋白质结构发生变化的影响因素以及结构变化是如何影响肌肉蛋白质与风味物质的相互作用对深入研究二者相互作用具有重要的意义。
3.1 肌肉蛋白性质
蛋白质的种类和浓度是影响蛋白质与风味化合物相互作用的重要因素,然而,蛋白质浓度对风味化合物吸附能力的影响机制尚未完全阐明[23]。肌肉蛋白质是一种复合体系的蛋白质,并且由于其结构的特殊性,一般都是在模拟体系中完成。Pérez-Juan等[24]选用了6 种典型的肉中风味化合物,在模拟体系中比较了不同种类肌肉蛋白对风味物质的结合能力,结果表明肌浆蛋白的结合风味化合物的能力高于肌原纤维蛋白,这可能是不同肌肉蛋白间的结合位点间的差异导致。此外,Pérez-Juan等[25]进一步研究了肌动蛋白(F-肌动蛋白和G-肌动蛋白)和肌动球蛋白与风味化合物的相互作用,发现G-肌动蛋白对风味物质基本无吸附作用,而肌动球蛋白和F-肌动蛋白对风味化合物均有明显的吸附作用,吸附能力的大小与蛋白质的浓度密切相关。关于蛋白浓度,周昌瑜等[23]研究了不同浓度肌原纤维蛋白对17 种典型风味化合物结合能力的影响,发现随着蛋白质量浓度的升高(2~6 mg/mL),肌原纤维蛋白对所有风味化合物吸附作用显著增强,这可能是因为较高的蛋白质量浓度改变了风味化合物在气相和液相之间的分配系数;而当蛋白质量浓度由6 mg/mL增加至8 mg/mL时,肌原纤维蛋白对所有风味化合物吸附能力都显著降低,这可能是由于蛋白质量浓度的增加导致了蛋白质与蛋白质之间的作用增强或表面张力降低,从而减弱蛋白质的风味物质结合能力,以上结果与Perez-Juan等[23]的研究结果一致。
3.2 风味物质类型
蛋白质并不是以相同的亲和力与所有风味化合物相结合[24]。许多研究表明,肌原纤维蛋白与不同种类风味化合物的作用强度有显著性差异,这与该化合物的碳链长度、分支程度、官能团等密切相关。目前,肌肉蛋白与醇类、酮类、醛类、酯类、一些含硫化合物以及吡嗪类化合物之间的相互作用已经被研究[25-28]。周昌瑜等[23]建立了肌原纤维蛋白与不同种类风味化合物的模拟体系,证实了风味物质的种类对肌原纤维蛋白的吸附能力有显著影响,相同浓度的蛋白对醇、醛、酮、酯的吸附作用由强到弱依次为醛类>酯类>酮类>醇类;肌原纤维蛋白对低级醇几乎没有吸附作用。这与Kuhn等[17]的研究结果类似,可能是因为醇类的羟基和蛋白质的氨基没有显著相互作用。然而随着碳链长度的增加,醇类的疏水性逐渐增大,肌原纤维蛋白通过疏水相互作用对它们产生了一定的吸附。此外,在各种风味物质中,酮类化合物是肉制品风味中主要的化合物,贡献作用很大[29],因此其与肌肉蛋白的相互作用受到许多学者的关注。Damodaran等[30]研究了羰基化合物与鱼肌动球蛋白的结合,结果表明,随着羰基链长增加,羰基化合物与鱼肌动球蛋白结合能力增强,说明疏水相互作用参与了肌动蛋白与羰基的相互作用,这与吕彤等[31]的研究结果一致。在此基础上,Shen Hui等[32]根据链长、羰基位置、羰基数量和支链选择了7 种典型的酮类化合物,研究了酮类化合物分子结构的差异对其与肌原纤维蛋白相互作用的影响。结果表明,二者之间是通过可逆和不可逆结合相互作用。肌原纤维蛋白与酮的结合会导致蛋白二级结构变化(α-螺旋结构损失),分子的大小、极性和空间位阻效应都是影响酮类物质与肌原纤维蛋白相互作用的主要因素。风味物质的属性在其与肌肉蛋白相互作用机制中起着重要的作用,这些研究结果有助于建立不同分子结构的风味物质对肉制品风味感知的可能贡献模式。
3.3 加热温度
加热对蛋白质的作用及其对风味化合物释放或保留的作用直接影响食品的风味轮廓。加热是肉制品加工过程中最为常见的加工方式,热诱导蛋白聚合是加热过程中改变蛋白质三维空间结构的决定性因素[33]。蛋白质受热后稳定其结构的氢键含量会降低,从而导致多肽链的展开,这种展开会引起许多疏水性风味结合位点暴露[33]。此外,加热后聚合的蛋白质结构不太紧密,促进了其与风味化合物的结合,尤其是与空腔的结合,因为加热后更易使风味化合物从这个空腔进入或出来,从而导致风味化合物包裹于蛋白质分子内部或被再次释放[33-34]。Zhou Feibai等[35]研究发现相比未加热组,37 ℃加热后的肌原纤维蛋白对2-甲基丁醛、壬醛和甲硫基丙醛的吸附能力显著加强,这可能是由于37 ℃加热后肌动球蛋白纤维的展开,增加了疏水结合的位点。为了探究热处理强度对肌肉蛋白吸附风味物质的影响机制,吕彤等[31]以猪肉肌球蛋白为对象,建立了肌球蛋白-风味物质(醛类和酮类)作用模拟体系,分析了不同温度下肌球蛋白结构、表面疏水性及风味结合能力的变化。研究发现,温度升至55 ℃肌球蛋白分子展开,温度升至75 ℃肌球蛋白分子变性;蛋白对4 种醛(3-甲基丁醛、戊醛、庚醛、辛醛)的吸附能力在展开过程中增强,在聚合过程中减弱;蛋白对2-戊酮的吸附能力先降低后升高,对其他3 种酮(2-庚酮、2-辛酮、2-壬酮)的吸附能力呈现先增加后降低再增加的趋势。除了加热温度,加热时间也会显著影响肌原纤维蛋白风味吸附能力,周昌瑜等[36]用80 ℃热处理肌原纤维蛋白0~20 min,结果表明在加热0~5 min期间,肌原纤维蛋白凝胶对戊醇、己醇、2-丁酮、2-庚酮及乙酸乙酯的吸附能力显著增强。
此外,在加热的过程中,肌肉蛋白质本身也是产生香气的一个来源,这些额外产生的风味化合物也应该考虑进去,以此来深入理解改变蛋白质成分引起的风味感知变化。
3.4 pH值
pH值是影响食品蛋白与风味化合物结合能力的重要因素之一。pH值可以通过改变氨基酸残基的微环境、表面疏水性[37]、蛋白质聚集程度[38]、蛋白质的溶解度、蛋白质分子所带电荷量以及诱导蛋白变性来改变蛋白的二级结构[38],从而来改变蛋白质分子与风味物质之间的非共价作用(静电作用和疏水相互作用)[14,28]。关于pH值对二者相互作用的影响,在乳蛋白方面研究地比较多,近年来pH值对肌肉蛋白风味结合能力的影响陆续被报道。Gianelli等[39]通过计算热力学结合参数(结合位数n和结合常数K)证实了pH值处理会影响模型体系中可溶性蛋白与风味化合物结合能力。Yang Qiuli等[37]研究了pH值对鸭肉肌原纤维蛋白与挥发性化合物的吸附作用,发现随着pH值的升高(pH 5.0~8.0),肌原纤维蛋白对醛类和酯类的吸附能力增加,而对酮类的吸附能力下降。同时,Shen Hui等[28]结合荧光猝灭和热力学参数研究了不同pH值诱导肌原纤维蛋白构象变化对其与吡嗪类化合物相互作用机制的影响。结果表明,静电作用和疏水作用是肌原纤维蛋白与2,5-二甲基吡嗪结合的主要作用力。其相互作用受pH值的影响较大,在较低的pH值条件下(pH 4.9),蛋白质与蛋白质之间的相互作用增强,肌原纤维蛋白聚集成更大的颗粒,表面疏水性增加,从而暴露出更多的疏水结合位点。然而,随着表面疏水性的增加,蛋白质之间相互作用(聚集和沉降)增强,产生的空间位阻阻碍了蛋白质与风味物质的结合,蛋白质的风味释放行为增强。此外,建立pH值诱导的肌原纤维蛋白构象变化与风味物质相互作用之间的相关性,对控制具有肉类风味的含有肌原纤维蛋白产品至关重要。
3.5 离子强度
在肉制品加工过程中,腌制是一个重要的工艺环节。腌制的目的已从过去单纯的防腐贮藏,发展到改善肉的色泽、质构以及风味等,其中主要的腌制剂为氯化钠(NaCl)[40]。目前,在模拟体系中已有研究表明,添加不同浓度NaCl会导致介质离子力的改变,发生“盐析效应”,从而增加风味化合物的顶空浓度,促进与蛋白质作用的风味成分释放[41]。除了“盐析效应”,为了阐明NaCl浓度对肌肉蛋白风味吸附特性的影响,许多研究人员研究了不同浓度的NaCl对肌原纤维蛋白风味结合能力的影响,楼宵玮等[42]研究了0.0~1.0 mol/L NaCl溶液对肌原纤维蛋白与几种典型的醇类、醛类、酮类和酯类化合物的相互作用。结果表明,随NaCl浓度升高,肌原纤维蛋白对醇类、酮类和醛类吸附能力总体降低,前期可能是因为蛋白质二级结构发生变化导致席夫碱结合位点被掩盖,后期可能是由于疏水相互作用力下降;对于酯类物质,NaCl浓度0.0~0.4 mol/L时肌原纤维蛋白风味吸附能力趋于下降,在0.4~1.0 mol/L时趋于升高,其作用趋势与疏水性相反,主要是由于其主要结合力为静电相互作用。此外,Damodaran等[30]研究了不同离子强度的NaCl对鱼肌动球蛋白与不良气味物质(2-壬酮)的结合能力,结果发现随着盐浓度的增加,肌动球蛋白结合能力逐渐降低,这与楼宵玮等[42]研究结果一致。
近年来,随着人们健康意识的加强,肉制品企业和消费者越来越多地青睐于低钠盐食品[43]。因此,Pérez-Juan等[27]针对食盐及食盐替代物(KCl、MgCl2和CaCl2)对肌浆蛋白与风味化合物相互作用的影响进行了研究。结果表明,与NaCl的作用相似,KCl可以显著提高体系内某些挥发性化合物的顶空浓度,如支链醛、己醛和甲硫醇,但对辛醛和2-戊酮没有影响。MgCl2和CaCl2对选择的挥发性化合物并没有产生盐析作用,但在高离子强度下,MgCl2对肌浆蛋白与支链醛吸附作用的影响较大。对于其他化合物,即使在高离子强度下,MgCl2和CaCl2对肌浆蛋白与风味吸附作用的影响也很小[27]。因此,在研究其他氯化物部分替代NaCl时,不仅要考虑到它们的盐析作用,还要考虑到它们对蛋白质风味结合能力的影响。
3.6 蛋白质氧化
蛋白质氧化通常是在自由基及其他相关氧化产物的作用下,某些特定的氨基酸残基发生反应引起蛋白质二级和三级结构的变化[44-46]。在肉及肉制品的加工和贮藏过程中,肌肉蛋白不可避免地会受到活性氧基团的氧化攻击,造成氧化损伤,进而诱导蛋白质的结构发生变化[47]。由于蛋白质的结合能力在很大程度上依赖于蛋白质的构象[48],因此建立蛋白氧化程度与两者相互作用的相关性,从蛋白氧化的角度研究其与风味物质相互作用,可为肉制品风味调控提供一定的理论依据。Zhou Feibai等[35]建立了肉制品加工中最普遍存在的羟自由基体系,作用于肌原纤维蛋白,探究氧化诱导的肌原纤维蛋白结构改变对其与风味物质2-甲基丁醛、甲硫基丙醛、2-戊酮、2-庚酮和壬醛结合能力的影响。研究发现,肌原纤维蛋白与所选风味物质的相互作用主要是疏水相互作用,而且其受蛋白质氧化程度影响较大。低氧化剂浓度(0.5~1 mmol/L H2O2)处理组的肌原纤维蛋白发生重新折叠,表面颗粒聚合物增多,减少了与风味化合物的结合位点,降低了蛋白质表面的疏水性,从而降低了蛋白质对风味物质的结合能力。然而,随着氧化剂浓度(大于2.5 mmol/L)的升高,蛋白质内部的疏水性氨基酸逐渐暴露出来,增强了蛋白质表面的疏水性。Cao Jinxuan等[49]建立了H2O2氧化体系,进一步研究了氧化修饰肌动蛋白(G-肌动蛋白)对其与风味化合物(醇类和醛类)的相互作用的影响。结果表明,低氧化程度处理(0~5 mmol/L H2O2)G-肌动蛋白可引起其二级结构的变化,提高羰基含量和表面疏水性,减少巯基基团,通过氢键加强了醇类的结合及醛类的释放。高氧化程度处理(5~20 mmol/L H2O2)G-肌动蛋白后,疏水位点的增加,G-肌动蛋白聚集且变为球形,与醛类物质结合形成蛋白-醛类复合物,提高了其与醛类物质的结合。
此外,某些肽在氧化作用下的裂解也可能促进表面疏水性的增强,从而增强了肌原纤维蛋白与风味物质之间的疏水相互作用。实际上,蛋白质氧化一方面使蛋白质的疏水基团暴露,另一方面改变蛋白质的电荷状态,使蛋白质结构发生部分去折叠,部分去折叠的结构蛋白可通过静电相互作用形成氧化聚集体,从而影响蛋白质凝胶特性[47]。Xiong Youling[50]、Lu Han[51]和胡忠良[52]等认为适度的蛋白氧化可以促进蛋白质结构的伸展,使活性基团适度暴露,有利于蛋白质凝胶特性的增强;过度氧化会导致蛋白结构极度伸展,造成蛋白质过度交联,使蛋白凝胶特性下降。目前已有研究表明,肉品风味与凝胶品质之间存在明显的相关性[36,53],然而蛋白氧化诱导的凝胶性质的变化对其与风味物质结合/释放的影响仍有待进一步探究。
3.7 其他加工工艺条件
目前,各种加工工艺都被证明会影响蛋白质的结合能力。作为一种新型的加工技术,家用微波炉在肌肉食品中的应用越来广泛。Lou Xiaowei等[54]研究了微波辐照对鱼和肉制品风味的影响,结果表明,微波功率对肌动蛋白的结构及其与风味物质的相互作用有明显的影响。低功率(0~300 W)微波范围内,肌动蛋白对酮类的吸附增强,不会导致肉制品风味寡淡;随着功率的增大(300~500 W),酮类的保持能力明显降低。
关于肌肉蛋白与挥发性化合物的相互作用,一些研究人员还考虑到了酶解肌肉蛋白对其结合能力的影响[55]。众所周知,在干腌肉制品风味形成中,内源酶对肌肉蛋白降解产生游离氨基酸和其他低分子质量的化合物作用明显[52]。因此,Lü Tong等[55]建立了肌球蛋白降解与风味结合的关系,发现随着胰蛋白酶含量的增加,蛋白结合醛类和酮类的能力增强,这可能是由于蛋白质疏水性和总巯基含量增加,活性氨基和巯基以及疏水位点暴露导致蛋白质的二级结构展开,从而改变了肌球蛋白的风味结合能力。
随着肉制品产业的发展,研究肌肉蛋白和风味物质相互作用的影响因素,了解肉类加工过程中肌肉蛋白与风味物质的变化,可以用来避免肉及肉制品在生产加工过程中处理不当而造成的肌肉食品的风味损失,对改善肉制品质量和提高肉制品风味具有重要意义。
4 结 语
蛋白质可逆或不可逆地与挥发性物质结合会影响最终产品的风味品质。了解这种相互作用有助于食品生产者获得关键性信息,利用可逆结合(离子键、氢键、疏水相互作用)降低肉制品加工过程的风味损失,利用不可逆结合(共价键结合)除去肉及肉制品的异味,以开发出具有理想风味属性的肌肉产品。然而,肌肉蛋白与风味物质的相互作用机制还有待进一步深入研究,特别是作用位点的确定及相互作用前后蛋白质构象的变化,因此,有必要借助一些目前比较先进和新颖的研究手段(如二维核磁共振光谱技术、脉冲梯度核磁共振技术、荧光光谱技术和等温滴定量热技术等)来测定蛋白质的吸附常数、共价结合位点以及结合比例等,达到有效分析。目前,由于肌肉食品组织结构的复杂性,关于肌肉蛋白与风味物质相互作用的研究,一般都是在模拟体系中完成。肉及肉制品是一个复杂体系,在实际加工过程中,肌肉蛋白结构的变化对其与风味物质相互作用的影响并不简单。因此,在研究单一蛋白的基础上进一步研究复合蛋白体系和多组分食品基质与风味化合物的相互作用是未来研究的发展趋势之一。此外,随着低脂肪肉制品的不断发展,深入研究肌肉蛋白质与风味化合物的作用,了解它们在肉类加工到食用过程中的变化,对制定出种类丰富、可被广泛接受的低脂风味配方以及改善肉品风味具有极大意义。

