不同解冻方法对鹅腿肉理化特性和品质的影响
刘 磊,夏 强,曹锦轩,何 俊,潘道东,汤晓艳,王 颖,
(1.宁波大学食品与药学学院,浙江 宁波 315800;2.农产品质量安全危害因子与风险防控国家重点实验室,浙江 宁波 315211;3.中国农业科学院农业质量标准与检测技术研究所,农业农村部农产品质量安全重点实验室,北京 100081)
2000 年我国鹅屠宰量为4.38亿 只,2014年增加到6.18亿 只,增幅达41.1%[1]。中国鹅肉产量占全球的95%,其次是埃及、匈牙利和波兰,其中匈牙利是最大出口国之一[2]。鹅肉富含蛋白质、维生素及无机盐等,其中蛋白质含量高达22.3%,脂肪含量仅为11%,具有高蛋白、低脂肪的特点[3-4],同时还兼具药用和食疗功能[5]。
解冻是冻结的逆过程,涉及冻结肉冰晶融化成水并被肉吸收而恢复到冻结前的新鲜状态的变化过程,在鹅肉生产和销售过程中广泛应用[6]。研究表明,不恰当的解冻方法不仅破坏肉的理化特性,包括引发汁液损失、肌肉褐变、嫩度变差、脂肪氧化加剧、蒸煮损失增大以及蛋白质变性等,而且造成微生物性腐败[7-9]。为保持冷冻肉在解冻后的加工特性,需要结合肉理化性质选择适当的解冻方法,然而解冻过程鹅肉理化特性及品质变化报道较少。
低温解冻和流水解冻在食品工业中应用广泛,具备操作简便、解冻肉品质量良好等优势[10],但同时,低温解冻耗时较长,设备占地面积大,不利于提高生产效率;而流水解冻存在易发生微生物污染、可溶性物质流失等问题。近年来,微波解冻获得较多关注,该技术基于交变电场作用和微波的穿透能力,可对冻结品进行深层、快速解冻[11-12]。研究发现,在250 W微波功率下解冻的鸡胸肉具有比低温解冻鸡胸肉更低的解冻损失,更好的保水能力、颜色稳定性和质地特性[13]。相反,对于猪背最长肌,微波解冻则显著增加其解冻损失、蒸煮损失率和剪切力值,并影响色差变化[14]。因此,微波解冻受到冻结品理化和操作参数的影响,而微波解冻条件的鹅肉品质变化及影响机制则鲜见报道。
对于冷冻鹅肉,不同解冻方式究竟对鹅肉品质有怎样的影响,以及这些影响是通过哪些理化因素来产生作用,是选择解冻方式和优化相关参数的重要基础问题。流水解冻、低温解冻和微波解冻这3 种解冻方法虽各有优缺点,但都是工业上较常采用的解冻方法,具有代表性[15]。因此,本实验以冷冻后的鹅腿肉为原材料,以解冻后产品的保水性、色泽、剪切力值、高铁肌红蛋白(metmyoglobin,MetMb)含量、蛋白质二级结构、pH值、硫代巴比妥酸反应物(thiobarbituric acid reactive substance,TBARS)值等指标,对上述3 种解冻方法进行比较,旨在为选择解冻方法及操作参数提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
选取宁波市镇海江南家禽育种有限公司草饲的75 日龄、质量约4.5 kg的浙东白鹅28 只,静养12 h后进行集中屠宰,从颈部割断血管,刺杀放血。95 ℃热水烫漂10 min拔除羽毛、去除内脏后进行清洗,随后迅速取出左、右腿。将56 只鹅腿分成4 组,每组14 只作为重复。分好的鹅腿肉真空包装处理,密封在尼龙-聚乙烯复合包装袋中,4 ℃冷却贮藏12 h,后迅速冷冻至-24 ℃且于冷库中冷冻贮藏两周。分组解冻后,每只鹅腿样品分成3 份,其中一份解冻后立即进行指标测定,另外两份则解冻后分别在4 ℃贮藏3 d和6 d后进行测定。
2-硫代巴比妥酸(thibabituric acid,TBA)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、三氯乙酸、氯仿 国药集团化学试剂有限公司;磷酸盐缓冲溶液(phosphate buffered saline,PBS) 生工生物工程(上海)股份有限公司;所有试剂均为分析纯。
1.2 仪器与设备
CR400色差仪 日本美能达公司;UV-480ZH型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;TR-5230温度探针 日本T&D公司;M1-L213B微波炉(变频) 广东美的厨房电器制造有限公司;BCD-530WLDEB型冰箱 青岛海尔股份有限公司;HH-4水浴锅 常州澳华仪器有限公司;5805R离心机德国Eppendorf公司;AL204电子天平、FE20 pH计梅特勒-托利多仪器(上海)有限公司;C-LM3B数显式肌肉嫩度仪 东北农业大学工程学院;TM-9202C数显温度计 广东华福集团有限公司;inVia-Reflex拉曼光谱仪 法国Renishaw公司。
1.3 方法
1.3.1 解冻处理方法
1.3.1.1 流水解冻
从冷库中取出其中14 只鹅腿,每只分成3 份,同时放在室温下用自来水进行流水解冻,插入热电偶动态观察中心温度,直至中心温度达到4 ℃。
1.3.1.2 低温解冻
将另外14 只鹅腿肉样每只分成3 份,一同放置于4 ℃冰箱中进行解冻,同时插入热电偶来动态观察中心温度,直至肉样中心温度达到4 ℃。
1.3.1.3 微波解冻
将余下28 只鹅腿等分为两组,不同的微波解冻条件为:1)1 800 kW的频率解冻鹅腿肉,温度为45 ℃,时间为2 min,标记为微波解冻1鹅腿肉;2)1 800 kW的频率解冻鹅腿肉,温度为45 ℃,时间为6 min,标记为微波解冻2鹅腿肉。解冻过程中插入热电偶动态观察中心温度,直至肉样中心温度达到4 ℃。
1.3.2 理化指标的测定
1.3.2.1 色泽测定
测定方法参考曹锦轩[16]的报道,肉色(L*、a*、b*)测定采用色差仪,肌肉表面切开暴露15 min后,以D65为光源,以标准板标定,测定鲜肉表面肉色。
1.3.2.2 滴水损失率测定
迅速取出解冻后的腿肉,记录样品质量(m1/g)。悬挂在一次性塑料杯中,放入4 ℃冷藏库贮藏约20 h,取出样品,用吸水纸吸干表面水分后再次称质量(m2/g)。滴水损失率按公式(1)进行计算。
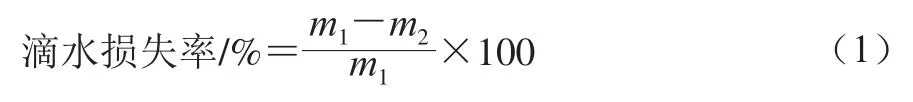
1.3.2.3 蒸煮损失率测定
将一定大小肉样(约2 cm×2 cm×3 cm)在85 ℃水浴锅中蒸煮20 min,插入热电偶动态观察中心温度,直至中心温度达到80 ℃,蒸煮前称质量(m0/g)。蒸煮后冷却到室温,用吸水纸吸干水分,然后再次称质量(m1/g)。蒸煮损失率按公式(2)进行计算。

1.3.2.4 剪切力的测定
参考谢媚等[17]的方法,将测完蒸煮损失率的样品,顺肌纤维方向,切成1 cm×1 cm×3 cm的块状,采用C-LM3肌肉嫩度测定仪测定其剪切力。
1.3.2.5 MetMb含量测定
MetMb含量的测定参考Krzywicki[18]的方法:取5 g肉样于10 mL 0.04 mol/L、pH 6.8的PBS中,匀浆60~90 s,匀浆液在8 000×g离心30 min。得到肌浆蛋白粗溶液测量该溶液在525、572 nm和700 nm波长处的吸光度,MetMb含量按公式(3)进行计算。
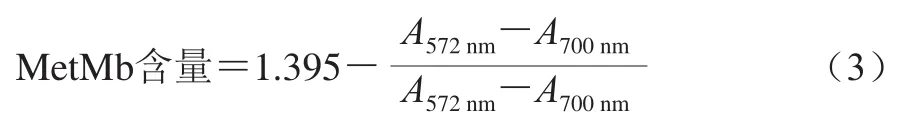
式中:1.395为常数。
1.3.2.6 TBARS值测定
TBARS值的测定参照Wu Xiang等[19]的方法。取10 g肉样绞碎,加入50 mL 7.5%(质量分数,下同)的三氯乙酸(含0.1% EDTA),振摇30 min,双层滤纸过滤两次。取5 mL上清液加入5 mL 0.02 mol/L TBA溶液,100 ℃下水浴40 min,取出冷却1 h,1 600×g离心5 min,上清液中加入5 mL氯仿摇匀,静置分层后取上清液,分别在532 nm和600 nm波长处比色,记录消光值。与TBA反应物质的量以每100 g肉中丙二醛的质量来表示。TBARS值按公式(4)进行计算。
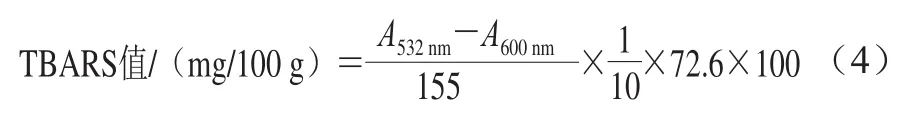
式中:10为10 g样品;72.6为丙二醛相对分子质量;100为100 g样品;155为摩尔吸光系数/(L/(mol·cm))。
1.3.2.7 pH值的测定
pH值测定参考曹锦轩[16]的方法。将肉去除脂肪和肌腱后用绞肉机绞成肉糜,称取3 g于锥形瓶中,并加入30 mL蒸馏水,与均质机中匀浆30 s。然后将pH电极直接插入其中,待稳定后读数。
1.3.2.8 蛋白质构象的测定
采用拉曼光谱仪测定鹅腿肉蛋白质的二级结构。取解冻后肉样压片置于载物台上,用50 倍长聚焦镜头将激光聚于载玻片上的样品。采用633 nm氦-氖激光器,功率17 mW、分辨率2 cm-1、曝光时间30 s,获取范围为600~1 800 cm-1的拉曼光谱。所得图谱均用Origin 7.0软件进行平滑和基线校正,以苯丙氨酸在1 004 cm-1处的拉曼强度为内标进行归一化。蛋白质二级结构的计算方法参照Alix等[20]的方法。
1.4 数据处理与统计
实验数据均为3 次重复,并以平均值±标准偏差表示。使用SAS 8.0软件进行数据处理,采用Duncan's进行多重比较。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 不同解冻方式对鹅腿肉色泽、pH值、脂肪氧化程度及MetMb含量的影响
从表1可知,鹅肉经过解冻后(0 d),对4 种解冻方式的鹅肉L*值、a*值、TBARS值、pH值进行比较,结果均无显著性差异(P>0.05);低温解冻和微波解冻2的鹅肉b*值显著低于流水解冻和微波解冻1(P<0.05);两组微波解冻的鹅肉MetMb含量显著低于另外两种解冻方式的鹅肉(P<0.05)。

表1 不同解冻方式对鹅腿肉色泽、pH值、脂肪氧化程度及MetMb含量的影响Table 1 Influence of different thawing methods on the color, pH, fat oxidation degree and MetMb content of goose meat
比较贮藏过程中L*、a*值和b*值随贮藏时间的变化可知,鹅肉经过微波解冻后,贮藏一定时间,微波解冻1的鹅肉L*值先上升再显著降低(P<0.05),其他解冻方式处理的鹅肉L*值未发生显著变化(P>0.05)。低温解冻和微波解冻1处理的鹅肉L*值变化趋势一致,流水解冻和微波解冻2处理的鹅肉变化趋势一致。贮藏6 d后,4 种解冻方式均降低鹅肉的L*值,这与Galobart[21]和程天斌[22]等研究鸡胸肉冻融过程及猪肉不同解冻方式L*值的变化一致。4 种方式解冻的鹅肉在贮藏期间除了微波解冻2处理组的鹅肉在贮藏6 d后a*值显著降低(P<0.05),另外3 种处理方式均无明显差异(P>0.05),但都呈现降低的趋势,这可能是由于解冻过程中氧合肌红蛋白随着解冻渗出液流失,而长时间的微波解冻时间造成的氧合肌红蛋白损失可能更大,所以a*值降低更显著。微波解冻2处理组的鹅肉b*值在贮藏3 d和6 d后,显著低于另外3 组处理方式(P<0.05)。
以TBARS值表征脂肪氧化程度,4 种方式解冻的鹅肉TBARS值无显著差异(P>0.05),但是在贮藏3~6 d,低温解冻鹅肉TBARS值增加不显著(P>0.05),其他组鹅肉均显著性增加(P<0.05),但微波解冻与流水解冻鹅肉在贮藏6 d时,脂肪氧化程度没有显著性差异(P>0.05)。上述结果表明,低温解冻是抑制鹅肉解冻过程脂质氧化的有效方法,而流水解冻与微波解冻均诱发脂质氧化,这可能与流水和微波对蛋白质和脂质分子的扰动有关。
不同的解冻方式对鹅肉的pH值无显著影响(P>0.05),解冻后各肉样的pH值均在5.5~5.8,而动物肌肉的pH值一般在7.0左右,宰后由于氧气供应中断,肌糖原进行无氧酵解,在糖酵解酶的作用下,使肉pH值下降[23],pH值可在一定程度上反映肉的保水性和嫩度[24]。表1中可以看出,微波解冻1与低温解冻处理组的鹅肉pH值相当,微波处理2与流水解冻处理组的鹅肉的pH值相当,但前两组pH值小于后两组,一般认为肌肉pH值在6.0左右有助于维持系水力[25],因此微波短时间解冻和低温解冻鹅肉系水力更高。随着贮藏时间延长,4 种解冻方法的pH值均呈增加趋势,但是流水解冻与微波处理组2的鹅肉在第6天其pH值超过6.5,说明鹅腿肉已腐败,微波解冻1与低温解冻处理组的鹅腿肉贮藏时间明显长于流水解冻和微波解冻2处理组的鹅腿肉。
由于脂质氧化和色素降解过程,肉类在冷冻储存和解冻过程中会发生颜色变化[26],肉的颜色主要取决于肉中还原型肌红蛋白、氧合型肌红蛋白和MetMb三者比例[27]。由表1可以看出,在贮藏0~3 d,用微波解冻的鹅肉其MetMb含量显著低于流水解冻和低温解冻鹅肉(P<0.05),不同处理组的MetMb含量在0~3 d均呈现上升的趋势,在3~6 d均出现降低,而低温解冻组的鹅肉b*值与之变化一致,贮藏到第6天时,低温解冻和微波解冻1处理组鹅肉MetMb含量显著低于其他两组(P<0.05)。结果表明,低温解冻和微波解冻能有效延缓鹅肉颜色的褐变。
2.2 不同解冻方式对鹅腿肉滴水损失率、蒸煮损失率和剪切力的影响

表2 不同解冻方式对鹅腿肉滴水损失率、蒸煮损失率和剪切力的影响Table 2 Influence of different thawing methods on dripping loss,cooking loss rate, and shear stress of goose meat
由表2可知,流水解冻鹅肉的滴水损失率最高,其次为微波解冻2、微波解冻1处理组和低温解冻,结果与蒸煮损失率一致。在贮藏期间,所有样品滴水损失率和蒸煮损失率均呈现上升趋势,在贮藏6 d后,低温解冻组滴水损失率和蒸煮损失率仍是最低,其次是微波解冻1处理组。因此,采用微波解冻1处理的鹅腿肉保水性劣于低温解冻,但优于流水解冻,这与Xia Xiufang等[14]研究结果一致。短时间微波解冻可以有效缓解在解冻过程中冰晶体对细胞壁的破坏,对肌肉组织水分有良好的保持作用。
微波解冻与流水解冻鹅肉剪切力相当,但显著大于低温解冻(P<0.05)。贮藏3 d后,与0 d相比,除微波解冻2处理组的剪切力值无显著变化,另外3 种处理组均显著增加(P<0.05),可能是由于贮藏时间延长,结缔组织的含量与性质及肌原纤维蛋白的结构状态发生很大的改变,嫩度呈现下降趋势,从而导致肉品变质劣变。贮藏6 d之后,低温解冻鹅肉剪切力值最小,与贮藏3 d相比变化也最小,其次是微波解冻1组。上述结果表明,低温解冻在解冻后及贮藏期间能更好地维持冻结肉的嫩度及品质,其次是微波短时间解冻。
2.3 解冻后鹅腿肉蛋白质二级结构的变化
参照文献[28],本研究拉曼光谱条带的鉴定结果见表3。解冻后样品贮藏期间的拉曼光谱如图1~3所示。图1表示各样品解冻完成后未经贮藏(0 d)的拉曼光谱图,图2和图3分别为贮藏3 d和6 d的拉曼光谱图。

表3 鹅腿肉蛋白拉曼光谱条带的鉴定Table 3 Assignment of Raman bands for goose thigh meat proteins
如图1所示,鹅腿肉在830、937、1 004、1 455 cm-1出现明显谱峰,其中1 650~1 680 cm-1被认为是酰胺I带谱峰。Alix等[20]研究表明,蛋白质的二级结构和酰胺I带最强峰的拉曼位移有关。解冻后的样品在贮藏0 d时酰胺I带最强峰的位置在1 660 cm-1左右,随着贮藏时间的延长,各处理组位置发生不同程度的偏移。流水解冻组在1 600 cm-1处峰的相对强度最强,α-螺旋含量仅次于低温解冻组,流水解冻和低温解冻处理组α-螺旋结构的含量明显高于两个微波解冻组,说明低温解冻对蛋白质二级结构影响最小,而微波解冻可能由于其受热不均一使鹅腿肉蛋白质α-螺旋结构遭到破坏或者促使其转化,在猪肉样品中观察到类似结果[14]。在贮藏过程中,低温解冻组样品中α-螺旋含量逐渐减少,β-折叠含量增加,可能是α-螺旋向β-折叠发生了转化。与此同时,流水解冻和微波解冻1处理组α-螺旋含量先增加后减少,而微波解冻2处理组先减少后增加,表明鹅腿肉蛋白质在贮藏期间α-螺旋向β-折叠可能会相互转化并影响肉质。

图1 4 组解冻样品贮藏0 d的拉曼光谱Fig.1 Raman spectra of frozen goose meat thawed by different methods after 0 day of storage at 4 ℃

图2 4 组解冻样品贮藏3 d的拉曼光谱Fig.2 Raman spectra of frozen goose meat thawed by different methods after 3 days of storage at 4 ℃
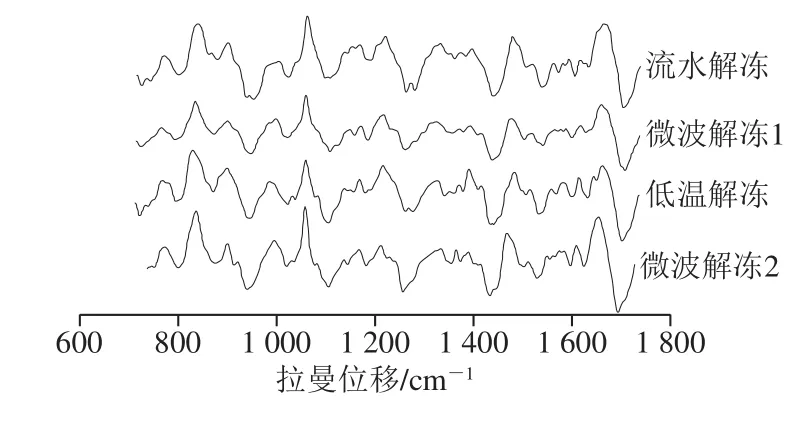
图3 4 组解冻样品贮藏6 d的拉曼光谱Fig.3 Raman spectra of frozen goose meat thawed by different methods after 6 days of storage at 4 ℃
由图2可知,流水解冻组样品酰胺III带1 250 cm-1处峰强度明显增大,这与酰胺I带主峰位置向低波数方向移动、α-螺旋含量增加的变化一致。贮藏第6天,微波解冻2处理组酰胺I带主峰位置向波数低方向移动,峰相对强度增加,α-螺旋含量增加;其他3 组α-螺旋含量均有不同程度减少,1 250 cm-1处谱峰趋于平缓或消失,可能与蛋白质降解有关。α-螺旋含量由大到小排序为:微波解冻1>微波解冻2>流水解冻>低温解冻,该结果表明解冻时间影响蛋白质二级结构,长时间低温解冻可能促使α-螺旋结构被破坏,而微波解冻在解冻后α-螺旋含量相对较低,但贮藏后出现回升。因此,较低温度微波快速解冻可能使蛋白质结构发生可逆变化。蛋白质骨架的振动,包括骨架C-C、C-N伸缩振动也能反映蛋白质结构的变化,937 cm-1处的谱带被认为是α-螺旋结构[29],所有解冻样品该峰相对强度在贮藏3 d内没有明显变化,之后流水解冻样品强度明显加强,低温和微波解冻2处理组有略微加强,而微波解冻1处理组没有明显变化,这可能和蛋白质降解以及分子间的相互作用有关。
3 结 论
本实验通过考察不同解冻方法对冻结肉理化性质与品质影响,结果表明,微波解冻功率和温度相同的条件下,快速微波解冻可以明显提高解冻肉的品质,而低温解冻有助于维持鹅肉色泽、滴水损失率、蒸煮损失率和剪切力值以及抑制脂肪氧化。通过拉曼光谱对蛋白质的二级结构进行分析,发现低温解冻对蛋白质构的影响较小,其次为微波解冻,流水解冻对蛋白质构影响最大。流水解冻不利于维持鹅肉品质特性,而微波解冻对鹅肉品质的影响虽大于低温解冻,但是短时间微波解冻能使冻结鹅肉更好地保持理化属性和品质,与低温解冻效果相当,因此采用微波解冻技术解冻冻结肉以取代传统流水解冻,在鹅肉解冻方面有一定潜在的应用价值。

