枸杞多糖联合顺铂对人肺腺癌细胞A549氧化损伤及凋亡的影响
韩何丹,韩照玉,杜月梅,刘云帆,李艾琳,高丽萍
(北京联合大学生物化学工程学院,生物活性物质与功能食品北京市重点实验室,北京 100191)
肺癌是常见的恶性肿瘤之一,其发病率和死亡率在众多恶性肿瘤中增长最快,并对人群健康及生命产生了巨大威胁[1],其中非小细胞肺癌(non-small cell lung cancer,NSCLC)在我国发病率和死亡率最高[2-4],且发病率逐年增高。目前,化疗是临床肺癌综合治疗的重要手段之一[5]。顺铂(cisplatin,DDP)作为广谱抗肿瘤药物,能与肿瘤细胞中DNA发生交叉联结,破坏DNA功能,从而能激活肿瘤细胞的凋亡途径。对于晚期NSCLC,最常用的化疗方案是以铂类为基础的双药联合治疗,但由于肺癌对化疗药物极易产生耐药性,且DDP的长期大剂量使用会造成患者强烈的不良反应,降低了临床化疗的效率[6]。因此,肺癌的化疗耐药性已成为临床治疗的热点问题。
枸杞多糖(Lycium barbarumpolysaccharides,LBP)是枸杞的主要有效成分之一,具有抗衰老、降血糖、降血脂和增强机体免疫功能的作用及抗肿瘤功效[7-8]。崔晓燕等[9]通过实验观察发现LBP对HeLa细胞有明显的抑制作用,并呈现剂量依赖性。研究表明,LBP对人前列腺癌DU145细胞、小鼠肝癌细胞H22瘤株均有不同程度抑制和促凋亡作用[10-12]。
前期研究结果显示,LBP对DDP引起的肾毒性、生殖毒性均有良好的保护作用[13-14],而LBP对DDP抗癌作用的影响鲜见报道。本实验建立了A549 DDP损伤细胞模型并通过LBP-DDP联合处理,探讨LBP联合DDP对人肺腺癌细胞A549损伤的影响及可能的作用机制,为LBP在临床发挥其抗癌作用并辅助DDP化疗增敏作用提供理论依据,以期提高癌症患者的治疗效果。
1 材料与方法
1.1 材料与试剂
人肺腺癌细胞A549 北京协和医院基础学院细胞中心。
DDP(注射用冻干粉剂) 山东齐鲁制药有限公司;LBP(纯度≥99%) 南京泽朗医药科技有限公司;DMEM/F12培养基、胰酶、CCK-8试剂盒、细胞凋亡试剂盒 美国Genview公司;胎牛血清 美国HyClone公司;BCA蛋白浓度测定试剂盒、Bax抗体、Bcl-2抗体、caspase-3抗体 博士德生物技术有限公司;β-肌动蛋白(β-actin)抗体、HRP标记山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)抗体、山羊抗兔IgG抗体、高效化学发光(efficient chemiluminescence,ECL)试剂盒 北京鼎国昌盛生物技术有限公司;丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒 南京建成生物工程研究所;活性氧(reaction oxygen species,ROS)检测试剂盒 碧云天生物技术研究所。
1.2 仪器与设备
FACS Calibar流式细胞仪 美国BD公司;多功能酶标仪 美国Thermo公司;WFZ UV-4802H紫外-可见分光光度计 尤尼柯上海仪器有限公司;TE2000-M倒置显微镜 日本Nikon公司。
1.3 方法
1.3.1 细胞培养
A549细胞采用10%胎牛血清和1%双抗的DMEM/F12培养基,置于37 ℃、CO2体积分数5%、饱和湿度培养箱中培养。待细胞汇合度至80%~90%时,胰酶消化,按1∶3进行传代培养,取对数生长期细胞用于后续实验。
1.3.2 A549细胞增殖和CCK-8法测定
取100 μL(1×105个/mL)处于对数生长期的A549细胞接种到96 孔板中孵育,待细胞至融合状态时,弃原培养液,每孔加入含100 μL不同质量浓度DDP(0、1、2、4、8、16、32、64、128 mg/L)的无血清培养基,每组设6 个复孔,在37 ℃、含5% CO2饱和湿度的培养箱中培养24 h,弃培养液,各孔加入100 μL含10% CCK-8的培养基,继续孵育4 h,450 nm波长处检测吸光度A,按式(1)计算细胞存活率。
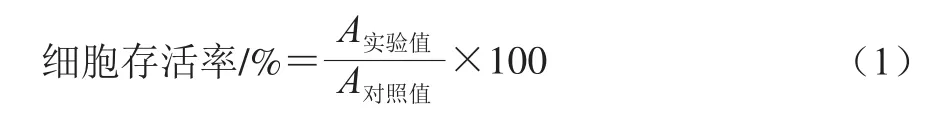
1.3.3 LBP对A549细胞存活率的影响
同1.3.1节的方法,将DDP换成不同质量浓度的LBP(0、2、4、8、16、32、64、128 mg/L),并按照式(1)计算细胞存活率。
1.3.4 LBP联合DDP用药对A549细胞存活率的影响
根据1.3.2节和1.3.3节计算所得DDP和LBP两种药对A549细胞的半抑制浓度(half-inhibitory concentration,IC50),并基于两者的IC50值,将DDP和LBP分别以两种不同质量浓度(6、12 mg/L DDP,8、16 mg/L LBP)组合。再用CCK-8法检测存活率。另设不加药对照组及LBP和DDP单独用药组,将100 μL(1×105个/mL)处于对数生长期的细胞接种于96 孔板中,待细胞生长至融合状态时,按照上述分组,每组设6 个复孔,在37℃、含5% CO2饱和湿度的培养箱中培养24 h后,弃培养液,各孔加入100 μL含10% CCK-8的培养基,继续孵育4 h,450 nm波长处检测吸光度A。按照式(1)计算细胞存活率。
1.3.5 A549细胞内蛋白浓度及抗氧化指标的测定
将2 mL(5×104个/mL)处于对数生长期的细胞接种至6 孔板,待细胞生长至融合状态时,对各组进行药物处理。根据1.3.4节所得各组的最佳浓度,在37 ℃、含5% CO2饱和湿度的培养箱中培养24 h后,在培养瓶中加入适量冷的磷酸盐缓冲液(phosphate buffered saline,PBS),冰浴条件下用细胞刮收集细胞,制成细胞悬液,1 000 r/min离心10 min,弃上清液留细胞沉淀。用1 mL PBS洗涤细胞2 次。PBS重悬后,于细胞破碎仪上30 Hz,10 s破碎。取出离心管,12 000 r/min离心10 min,收集上清液用于后续检测。按照试剂盒说明进行细胞蛋白浓度和MDA、GSH含量以及SOD活力测定。
1.3.6 流式细胞术检测A549细胞内ROS相对含量
按照1∶1 000用无血清DMEM/F12培养液稀释DCFHDA,使终浓度为10 μmol/L。按1.3.5节分组将生长状态良好的A549细胞接种至6 孔板培养24 h,弃旧细胞培养液,PBS洗涤,加入1 mL稀释好的DCFH-DA。37 ℃细胞培养箱内孵育20 min。无血清细胞培养液洗涤细胞3 次除去未进入细胞的探针DCFH-DA,0.25%不含EDTA胰酶消化各孔细胞,轻轻吹打,制成单细胞悬液,1 000 r/min离心5 min,收集细胞,500 μL PBS重悬细胞。200 目滤网过筛收集细胞于流式管内,采用激发光波长480 nm,发射光波长530 nm,上机检测。Cell Quest Pro软件测定ROS平均荧光强度,以其表示ROS相对含量。
1.3.7 流式细胞术检测细胞凋亡率
按1.3.5节分组,将生长状态良好的A549细胞接种至6 孔板,于37 ℃、含5% CO2的饱和湿度培养箱中培养24 h。按照实验分组用药处理各组细胞,继续培养24 h,胰酶消化细胞,含血清培养基终止消化并重悬,1 000 r/min、4 ℃离心10 min,弃上清液;1 mL PBS重悬;离心10 min,弃上清液;重复洗涤2 次;然后用Annexin V-FITC双染法测定A549细胞凋亡率。
1.3.8 Western blot法检测细胞Bcl-2、Bax和Caspase-3蛋白的相对表达量
将1.3.5节中各药物组处理的细胞蛋白上清液,分别按5×上样缓冲液与蛋白样品1∶4(V/V)比例混匀煮沸。以每孔50 μg蛋白上样量对蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),转膜,质量分数5%脱脂奶粉温室封闭1 h,三羟甲基氨基甲烷-盐酸-吐温20缓冲液(Tris buffered saline and tween 20,TBST)洗3 次,分别加入Bcl-2(1∶200)、Bax(1∶200)、Caspase-3(1∶200)及β-actin(1∶500)一抗,4 ℃孵育过夜;TBST洗3 次,加入对应二抗(1∶10 000)37 ℃孵育1 h,TBST洗3 次,化学发光成像系统曝光,Quantity One4.4.0软件测定蛋白条带灰度值,并按式(2)计算蛋白相对表达量。

1.4 数据统计分析
2 结果与分析
2.1 DDP对A549细胞的抑制作用
图1 不同质量浓度DDP对A549细胞存活率的影响(n=3)Fig.1 Effect of different concentrations of DDP on the viability of A549 cells (n = 3)
如图1所示,用不同质量浓度的DDP处理A549细胞24 h后,细胞生长受到不同程度的抑制,随着DDP质量浓度的增加,细胞存活率逐渐下降,且呈现剂量依赖性。与对照组相比,各用药组细胞存活率具有极显著差异(P<0.01)。通过SPSS软件计算,DDP对细胞的IC50为11.90 mg/L。
2.2 LBP对A549细胞的抑制作用
如图2所示,当LBP质量浓度大于8 mg/L时,对A549细胞增殖具有明显的抑制作用,且呈现一定的剂量依赖性,提示一定质量浓度的LBP可以抑制A549细胞活力,由SPSS软件计算得到LBP对A549细胞的IC50为16.27 mg/L。

图2 不同质量浓度LBP对A549细胞存活率的影响(n=3)Fig.2 Effect of different concentrations of LBP on the viability of A549 cells (n = 3)
2.3 LBP联合DDP对A549细胞存活率的影响
对于后续的实验,加药后细胞存活率太低,后期细胞进行流式检测时,细胞碎片太多,影响检测结果;细胞存活率太高,则较难检测出细胞损伤。如表1所示,基于各药物组对A549细胞的半抑制率IC50值,DDP对A549细胞的1/2 IC50约为6 mg/L,且LBP质量浓度不小于8 mg/L时,A549细胞存活率为(50.1±5.2)%,最接近50%。因此选用DDP质量浓度为6 mg/L,LBP质量浓度为8 mg/L进行后续实验。
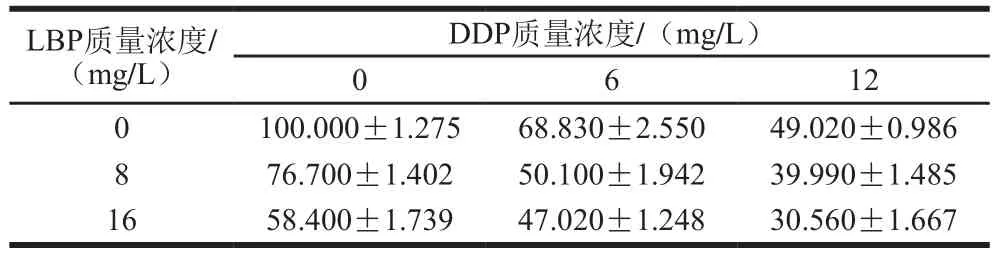
表1 LBP与DDP联合作用对A549细胞存活率的影响(n=3)Table 1 Effect of LBP combined with DDP on the survival rate of A549 cells (n= 3)%
2.4 LBP联合DDP对A549细胞内抗氧化指标的影响
2.4.1 LBP联合DDP对A549细胞中SOD活力、GSH和MDA含量的影响
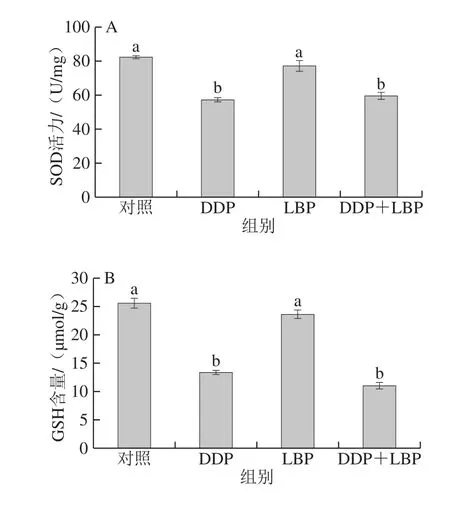
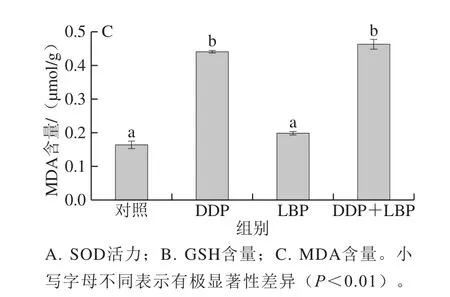
图4 LBP联合DDP对A549细胞内抗氧化指标的影响(n=3)Fig.4 Effects of LBP combined with DDP on GSH and MDA contents in A549 cells (n = 3)
由图4可知,与对照组相比,DDP导致细胞内SOD活力和GSH含量极显著降低,MDA含量极显著升高(P<0.01);LBP单独作用与对照组比较对细胞内SOD活力和GSH、MDA含量无明显变化。LBP+DDP组SOD活力、GSH和MDA含量与对照组比较有极显著差异(P<0.01),但与DDP组相比无显著性差异。
2.4.2 LBP联合DDP对A549细胞内ROS含量的影响
由图5和表2可知,与对照组相比,DDP单独处理极显著增加了A549细胞内ROS含量(P<0.01),而LBP单独处理可极显著降低A549细胞内ROS含量(P<0.01),且LBP和DDP联合处理后,细胞内ROS含量与对照组相比无显著性变化。
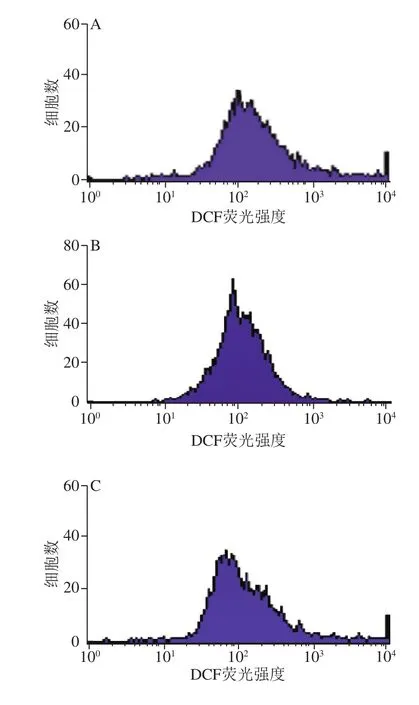
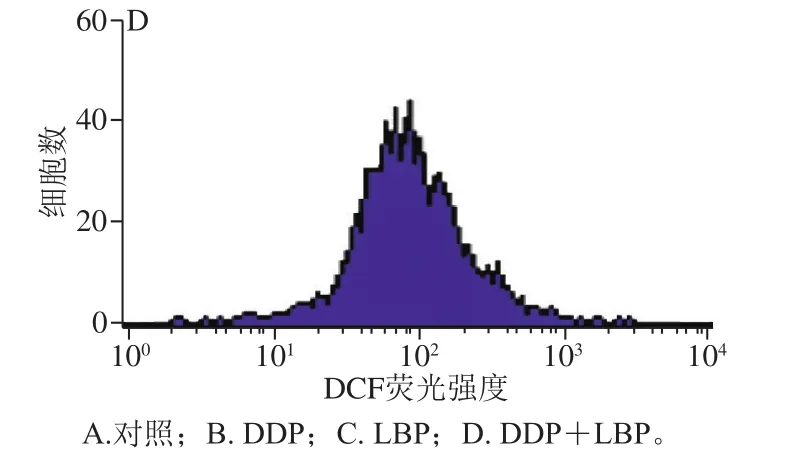
图5 流式细胞术检测LBP联合DDP对A549细胞ROS含量的影响(n= 3)Fig.5 Effect of LBP combined with DDP on ROS content in A549 cells (n = 3)
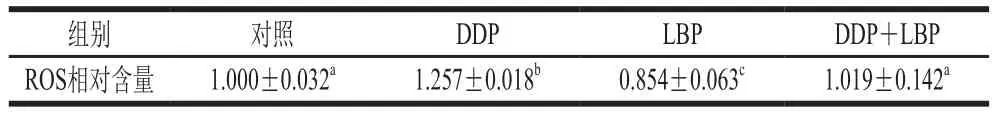
表2 LBP联合DDP对A549细胞ROS相对含量的影响(n= 3)Table 2 Effect of LBP combined with DDP on ROS content in A549 cells (n= 3)
2.5 LBP联合DDP对A549细胞凋亡率的影响
用Annexin V-FITC双染法检测A549细胞凋亡率,由表3可知,DDP能极显著增加A549细胞凋亡率(P<0.01),且LBP联合DDP处理后,细胞凋亡率极显著高于DDP组(P<0.01),表明LBP可促进DDP诱导的细胞凋亡,提示两者具有联合作用。
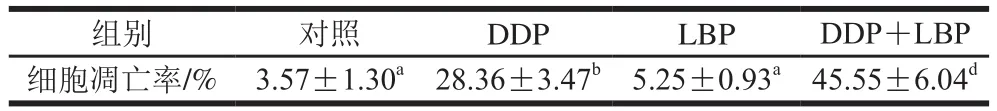
表3 LBP联合DDP对A549细胞凋亡率的影响(n =3)Table 3 Effect of LBP combined with DDP on the apoptosis rate of A549 cells (n= 3)
2.6 LBP联合DDP对A549细胞凋亡相关蛋白表达的影响
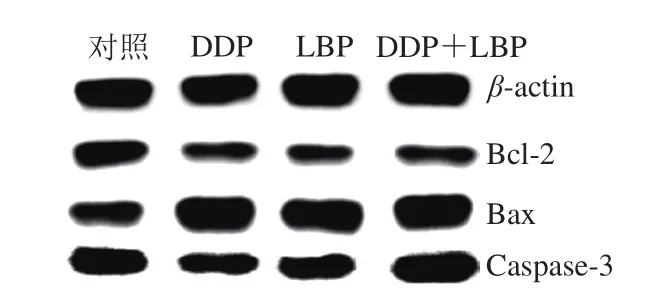
图6 LBP联合DDP对A549细胞凋亡相关蛋白表达的影响(n= 3)Fig.6 Effect of LBP combined with ciplatin on apoptosis-related protein expression in A549 cells (n = 3)
为了进一步探讨LBP联合DDP对A549细胞凋亡的影响,本实验采用Western blot 检测了不同药物组细胞内Bcl-2、Bax和活性Caspase-3的相关蛋白表达。结果如图6和表4所示,与对照组相比,DDP和LBP均能极显著上调Bax及Bax/Bcl-2,且DDP能极显著降低Bcl-2的表达量并上调活性Caspase-3(P<0.01),而LBP单独用药组Bcl-2和活性Caspase-3表达量与对照组相比无明显差异。LBP和DDP联合处理组细胞内凋亡相关蛋白的表达与对照组及LBP组均有极显著性差异(P<0.01),与DDP相比,除Bcl-2外,其他蛋白表达水平均极显著性升高(P<0.01)。结果表明,LBP联合DDP可能通过上调Bax、活性Caspase-3表达及Bax/Bcl-2水平来调控A549细胞凋亡。
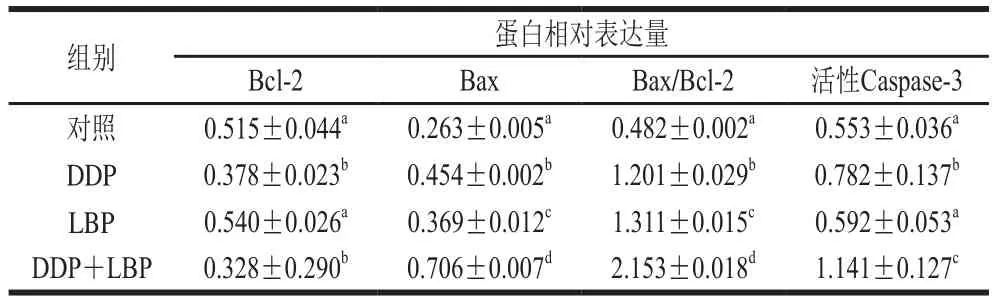
表4 不同药物处理组细胞相关蛋白的相对表达量(n=3)Table 4 Relative expression of apoptosis-associated proteins in different drug treatment groups (n= 3)
3 讨 论
DDP是目前广泛采用且效果较好的治疗肺癌的化疗药物,DDP的抗癌活性是由环境中氯离子浓度决定的。在血液及细胞外组织液中,氯离子浓度高,DDP相对稳定。而当其进入细胞液后,氯离子浓度很低,DDP中的两个氯离子会被水所取代,形成水合物。这种水合物很容易与DNA发生加成反应,形成交联,从而使DNA的复制转录遭到破坏,细胞周期停滞,导致细胞凋亡。由于肿瘤细胞分裂旺盛,所以肿瘤细胞较正常细胞对DDP造成的DNA 损伤更加敏感,因而,DDP的抗癌活性主要是因为DNA加合物的形成[15]。此外,由于细胞中线粒体本身具有裸露的环状DNA,容易突变和受到攻击,DDP可直接损伤线粒体DNA,造成线粒体损伤;DDP含有的亲核氨基也能够与水分子作用产生大量的自由基,进一步造成线粒体的氧化损伤,线粒体损伤和氧化应激反应相互作用,最终导致细胞死亡[16]。有研究显示[17]:DDP生物利用度较低,约为10%~35%,按成人常用剂量10~20 mg/d,溶于200 mL生理盐水中计算,到达细胞时质量浓度为1.05~3.50 mg/L(生物利用度取35%)。本实验用DDP建立了A549损伤细胞模型,结果显示质量浓度为1 mg/L的DDP会明显抑制A549细胞的生长,且呈剂量依赖性,当DDP质量浓度为6 mg/L时,会导致细胞内抗氧化系统紊乱,诱导A549细胞凋亡。然而,DDP在表现高效抗癌活性的同时,又对正常组织产生严重的毒副作用(如肾毒性、血液毒性和耳毒性等)[18],从而限制了DDP对肿瘤患者的长期治疗。故寻找高效低毒的肿瘤化疗增敏剂以增强DDP的化疗效果,改善患者的生活质量成为重要课题。
近年来,天然药物在肿瘤治疗过程中发挥着重要作用,目前发现许多天然药物提取活性成分如黄芪多糖、灵芝多糖及苦参碱等都具有较好的抗肿瘤作用[19-21]。LBP是从枸杞果实中提取的活性多糖,研究显示LBP具有较好的抗肿瘤活性[22]。LBP作为一种具有多种抗肿瘤活性的中药,可以协同化疗药物更好地发挥抗肿瘤作用[23]。本实验结果表明一定质量浓度LBP(8 mg/L)单独用药对A549细胞生长和增殖有极显著抑制作用,且呈剂量依赖性,其生物利用度可达36.01%,按成人健康推荐摄入量1 600 mg/d、治疗推荐摄入量2 400 mg/d,到达细胞浓度约为12~18 mg/L。LBP联合DDP能极显著降低A549细胞的存活率,表明LBP能增强DDP对A549细胞生长的抑制作用。
ROS是细胞在代谢过程中产生的含氧活性化合物的总称,其可以参与调节细胞内多种分子和信号转导通路的活性。肿瘤细胞的ROS产生较正常细胞明显增多,主要是受肿瘤基因、线粒体功能变异等因素的影响,使细胞处于一种更高的氧化应激状态。Finkel等[24]研究结果表明,少量的ROS可以作为信号分子介导信号转导途径,参与炎症反应和免疫反应,对细胞起保护作用;但是一旦过量就会引起脂质过氧化,形成过氧化产物MDA,导致细胞的DNA损伤或凋亡。本实验结果表明DDP单独用药会降低A549细胞内GSH含量和SOD活力,且细胞内MDA含量和ROS含量均极显著增加(P<0.01)。提示DDP引起A549细胞的氧化应激,进而诱导细胞凋亡。郑锐年等[25]研究表明ROS通过上调ROS-AKT1-JNK信号诱导人肝癌细胞株HEPG2细胞凋亡。正常生理条件下,细胞内的ROS由胞内抗氧化系统调节保持平衡状态[4],而DDP进入细胞后,通过损伤线粒体呼吸作用电子传递链,促进细胞的氧化应激反应,导致细胞内ROS的积累[26]。在机体内,抗氧化系统(SOD、GSH等)能清除多余的ROS维持氧化还原反应的平衡。SOD是一种高效氧自由基清除剂,几乎存在于所有生物细胞中,SOD通过与过氧化物酶和氧化物酶作用催化超氧阴离子自由基(O2-·)转化为无害的H2O,从而达到保护细胞的目的。GSH作为体内重要的抗氧化剂和自由基清除剂,具有强大的解毒作用。因此,两者可作为细胞抗氧化能力的重要指标。本实验数据表明,LBP联合DDP与DDP单独作用相比,ROS含量极显著降低(P<0.01),而GSH、MDA含量和SOD活力均无显著变化(P>0.05)。提示DDP能够抑制细胞内抗氧化酶的活力,导致细胞内氧化还原水平紊乱,促使脂质过氧化反应增强,从而引起细胞凋亡。另一方面,LBP联合DDP对DDP所致的细胞抗氧化系统紊乱无明显影响,却能有效地清除A549细胞产生的ROS。另外,曲仙智等[27]通过研究细胞糖代谢过程中相关抗氧化能力与DDP耐药之间的关系,发现升高细胞内ROS水平可以增加胆管细胞癌QBC939和肝细胞癌HepG2对DDP的敏感性。且He Guodong等[28]研究发现ROS抑制剂能够降低DDP的抗癌活性。本研究中凋亡结果显示,A549细胞在DDP单独处理后凋亡率从3.57%升高到了28.36%,两者联用后细胞凋亡率升高至45.55%,提示LBP能明显增强DDP对A549细胞的促凋亡作用,但此过程中氧化应激反应并不是LBP促进DDP诱导癌细胞凋亡的主要机制。
细胞凋亡是一种程序性细胞死亡,通常伴有线粒体膜破裂,细胞色素c从线粒体释放到细胞质[29-30]。Bcl-2是一种抗凋亡蛋白,通过改变线粒体膜的通透性,与Caspase家族蛋白在反馈回路系统中发挥调节细胞凋亡的功能[31-32]。Bax蛋白具有促凋亡作用,是细胞凋亡通路的重要组成部分。已有文献表明,Bcl-2表达的减少和Bax表达的增加均会增加线粒体膜通透性,从而促进细胞色素c等凋亡激活因子的释放,进而增强Caspase-3的活化诱导细胞凋亡[33]。Koraneekit等[34]研究表明咖啡酸和DDP的联合作用可上调Caspase-3和Bcl-2,进而促进人宫颈癌细胞凋亡。Liu Lei等[35]采用单细胞分析研究了DDP诱导人肺腺癌细胞凋亡过程中Bax的动力学分布,本实验结果也表明LBP和DDP单独用药组导致A549细胞内Bcl-2表达量减少,Bax和活性Caspase-3表达量增加,提示LBP和DDP可通过促线粒体释放因子途径诱导A549细胞凋亡。另外,Bax/Bcl-2的比值对于反映药物诱导的癌细胞凋亡至关重要,其意义优于Bcl-2的表达水平,LBP与DDP联合处理A549细胞后,活性Caspase-3表达极显著增加,且Bax/Bcl-2增大,线粒体的渗透性过渡孔隙打开,导致细胞色素c、Caspase-9等促凋亡蛋白流出,促进了细胞凋亡。提示LBP联合DDP促进A549细胞凋亡与其可以共同上调Bax、下调Bcl-2表达并同时激活Caspase-3的表达有关。
PI3K/Akt信号通路作为细胞内重要信号转导通路之一,参与很多重要的生物学过程的调控,其通过影响下游多种效应分子的活化状态,在细胞内发挥着抑制凋亡、促进增殖的关键作用,与人类多种肿瘤的发生、发展密切相关[36-37],该信号通路被认为是癌细胞存活的首要通路。本研究证实LBP联合DDP促进A549细胞凋亡与其可以共同上调Bax、下调Bcl-2表达并同时激活Caspase-3的表达有关,但其对PI3K/AKt信号通路、蛋白激酶B信号作用通道AKt等的影响有待于进一步研究。
综上所述,LBP对DDP抑制人肺腺癌细胞A549生长有联合促进作用,且LBP能够增强DDP诱导的A549细胞凋亡,这是由于LBP与DDP联合作用可以调节A549细胞内促凋亡相关蛋白的表达,而LBP的抗氧化能力对DDP的促细胞凋亡作用并没有显著影响。

