西地那非对高糖培养施旺细胞保护作用的机制研究
黄欢捷 王讯 程一帆 邓斌斌 黄崇础 张万里


[摘要] 目的 探討西地那非对高糖培养施旺细胞保护作用的研究。 方法 培养并纯化后的大鼠施旺细胞为研究对象,分为正常对照组、高糖组、渗透压对照组 、高糖加不同浓度西地那非组 。CCK-8法检测细胞活性,流式细胞术检测细胞活性氧(ROS),Tunnel法检测细胞凋亡率,Western blot 法检测细胞Nrf-2的表达。 结果 高糖组施旺细胞内Nrf-2蛋白表达降低[高糖组(0.33±0.04),正常对照组(1.00±0.05)],ROS水平增高[高糖组(50.61±6.75),正常对照组(23.44±4.18)],细胞凋亡率升高[高糖组(36.62±3.15),正常对照组(4.53±0.26)],细胞活性下降[高糖组(0.91±0.17),正常对照组(1.65±0.25)]。不同西地那非能上调高糖培养施旺细胞内Nrf-2 蛋白表达,降低细胞内ROS水平,抑制细胞凋亡,提高细胞活性。 结论 西地那非可能通过激活Nrf-2信号通路诱导抗氧化应激保护高糖环境下的施旺细胞。
[关键词] 高糖;西地那非;施旺细胞;氧化应激
[中图分类号] R587.2;R747.9 [文献标识码] A [文章编号] 1673-9701(2020)18-0028-04
A study of the mechanism of sildenafil's protective effect on Schwann cells cultured in high glucose
HUANG Huanjie1 WANG Xun1 CHENG Yifan1 DENG Binbin1 HUANG Chongchu2 ZHANG Wanli1
1.Department of Neurology, Division Ⅰ, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325015, China; 2.Wenzhou Medical University, Wenzhou 325015, China
[Abstract] Objective To investigate the study of sildenafil's protective effect on Schwann cells cultured in high glucose. Methods The cultured and purified Schwann cells of rats were taken as research subjects and divided into the normal control group, the high glucose group, the osmotic pressure control group and the high glucose plus different concentrations of sildenafil group. CCK-8 method was used to detect the cell activity, flow cytometric method was used to detect reactive oxygen species(ROS) of the cells, Tunnel method was used to detect the apoptosis rate of the cells, and Western blot method was used to detect the Nrf-2 expression of the cells. Results The protein expression of Nrf-2 in Schwann cells in the high glucose group decreased[(0.33±0.04) in the high glucose group, (1.00±0.05) in the normal control group], the ROS level increased [(50.61±6.75) in the high glucose group, (23.44±4.18) in the normal control group], the apoptosis rate of the cells increased [(36.62±3.15) in the high glucose group, (4.53±0.26) in the normal control group], and the cell activity decreased [(0.91±0.17) in the high glucose group, (1.65±0.25) in the normal control group]. Different concentrations of sildenafil could upregulate the protein expression of Nrf-2 in the cells, reduce the ROS level in the cells, inhibit the cell apoptosis and improve the cell activity on Schwann cells cultured in high glucose. Conclusion Sildenafil may protect Schwann cells in high glucose environment by activating Nrf-2 signaling pathway to induce antioxidant stress.
[Key words] High glucose; Sildenafil; Schwann cell; Oxidative stress(OS)
糖尿病周围神经病变(DPN)是糖尿病发生率最高的并发症。在病史大于20年的糖尿病患者中,DPN发生率超过50%[1,2],DPN可出現躯体感觉障碍和下肢溃疡,严重者可导致患者下肢截肢,这不仅影响患者的日常生活,同时也给家庭、社会和国家带来沉重的经济负担[3]。DPN的病因发病机制尚不清楚,目前治疗DPN的常规药物只能延缓 DPN 的发生和发展,不能有效地治疗或逆转已经发生的 DPN[4,5]。因此,探索DPN机制及防治方法对提高患者存活率和改善其生活质量具有重要的临床实践意义。近年来提出的DPN统一机制学说表明高糖可引起线粒体中活性氧自由基(ROS)生成过多,进而导致氧化应激,从而最终导致周围神经病变[6]。本文前期研究采用西地那非(Sildenafil,Sil)干预糖尿病肾病(DN)大鼠,首次发现抗氧化应激分子 Nrf-2分子的表达水平在干预后显著提升,此结果预示Nrf-2 通路的抗氧化应激机制参与了改善肾损伤[7]。故本研究将探讨西地那非对高糖环境下大鼠施旺细胞(rat Schwann cell,RSC96)的影响。
1 材料与方法
1.1 材料来源
新生5 d Wistar大鼠(温州医科大学动物房提供);DMEM培养基(美国THERMO公司);PBS、胶原酶(Collage-rlase NB4,德国SERVA公司);中性蛋白酶(dispase Ⅱ,美国SIGMA公司);高糖DMEM培养基、胰酶(美国 HyClone公司);D-葡萄糖(北京 Solarbio公司);双抗(美国 Bio-sharp公司);CCK-8 试剂盒(日本同仁公司);西地那非50 mg/片(美国辉瑞公司),Nrf-2 和β-actin(英国 abcam公司)细胞凋亡试剂盒,离心机(美国 Beckman公司),倒置相差显微镜(日本 Olympus公司)。
1.2 施旺细胞的培养、纯化及标记鉴定
将新生5 d Wistar鼠采用乙醚麻醉后,取下整段坐骨神经,置于平衡盐液体中进行分离,注意无菌条件和仔细剥离神经外膜。坐骨神经剪碎后将松散组织置于含有20%胎牛血清的DMEM培养基中培养24 h,每 3天换液1次。观察细胞生长情况备用,采用差速贴壁法进行纯化培养。通过形态学观察及应用 ABC 法免疫细胞化学染色法进行施旺细胞鉴定[8]。
1.3 实验分组
根据前期工作,高糖浓度为50 mmol/L葡萄糖,干预时间为48 h[9,10]。将施旺细胞分组如下:①正常对照组(con):5.6 mmol/L葡萄糖培养;②高糖组(HG):50 mmol/L葡萄糖培养;③渗透压对照组(mannitol):5.6 mmol/L葡萄糖+44.4 mmol/L甘露醇培养;④高糖加不同浓度西地那非组(西地那非浓度分别为 10、30、100 μmol/L) 。
1.4 各组细胞活性检测
施旺细胞活性检测采用CCK-8法:细胞倍增时间取培养的细胞,用完全培养基制备3×104个/mL的细胞悬液,按每孔1500个细胞接种到96孔细胞培养板中,每组4个复孔,培养过夜,然后按照实验分组,各组加入培养基 200 μL,培养箱中培养48 h 后,每孔加入 100 μL标准培养基和10 μL细胞悬液,培养箱内孵育2 h后,应用超微量分光光度计测定450 nm处的吸光度,重复检测3次。
1.5细胞内ROS的检测
细胞内ROS采用荧光探针 2',7'-二氯荧光素二乙酸酯(DCFH-DA)检测。培养结束后向培养板的细胞中加入DCFH-DA,使其终浓度为12 μmol/L。在室温、5%CO2的条件下孵育20 min,用PBS洗涤细胞3次后,流式细胞仪检测细胞荧光强度(激发探针荧光信号的光波为485 nm,用荧光显微镜记录荧光信号),分析和计算施旺细胞内的光密度值。
1.6 细胞凋亡的检测
经不同条件作用48 h后,0.25%胰酶消化收集各组细胞,用多聚甲醛固定经PBS洗涤二次后的各组施旺细胞,孵育打孔后滴加Tunnel反应液,混合均匀,在室温条件下湿盒中避光孵育1 h。经PBS洗涤三次后滴加DAB显色剂,显微镜下观察,一旦出现棕黄色颗粒即终止反应。施旺细胞核呈深棕为阳性。随机选取5个视野下凋亡细胞数及总细胞数的比值表示每组细胞凋亡率。
1.7 Western blot法检测Nrf-2的表达
培养结束后分组提取细胞的全部蛋白,应用考马斯亮蓝法定量并调整蛋白浓度为 5 μg/μL,加入蛋白上样缓冲液混匀。取样品经10%的分离胶电泳2 h后将蛋白转移至NC膜,室温条件下BSA封闭2 h,加入相应一抗,4℃孵育过夜后洗涤一抗,洗涤要充分,再加入相应二抗室温孵育2 h。充分洗涤二抗后 ECL显色、曝光和拍照,图像软件对蛋白条带的光密度值进行分析,Nrf-2蛋白相对表达量以β-actin作为内参。
1.8 统计学处理
采用SPSS19.0统计软件进行结果分析,计量资料以均数±标准差(x±s)表示,用单因素方差分析比较组间差异,两组间比较用Student-Newman-Keuls,P<0.05为差异有统计学意义。
2 结果
2.1 细胞纯度
施旺细胞特异性蛋白采用S-100标记,经免疫荧光染色后,可以使表达S-100蛋白的施旺细胞胞浆发出绿色荧光。所有活细胞的细胞核经DAPI内的DNA结合后发出蓝色荧光。通过每次5个样本的S-100阳性细胞计数与DAPI阳性细胞计数的比例得到施旺细胞纯度,计算3次,平均细胞纯度为(94.8±0.27)%。见封三图2、表1。
2.2 西地那非对施旺细胞活性的影响
与正常对照组相比,高糖组细胞活性明显降低,差异有统计学意义(P<0.01)。与高糖组相比,不同剂量西地那非干预后细胞活性明显升高,差异有统计学意义(P<0.01)。渗透压对照组细胞活性与正常对照组相比差异无统计学意义(P>0.05),見表2、图1。
2.3 西地那非对细胞内ROS水平变化
高糖组施旺细胞内ROS水平与正常对照组相比明显增高,差异有统计学意义(P<0.01)。与高糖组相比,西地那非干预后,施旺细胞内ROS水平明显下降,差异有统计学意义(P<0.01)。渗透压对照组与正常对照组施旺细胞内ROS水平比较,差异无统计学意义(P>0.05),见表2、图1。
2.4 西地那非对各组细胞凋亡率的影响
高糖组施旺细胞凋亡率与正常对照组相比明显增高,差异有统计学意义(P<0.01)。西地那非干预后施旺细胞凋亡率明显下降,差异有统计学意义(P<0.01)。渗透压对照组与正常对照组相比施旺细胞凋亡率差异无统计学意义(P>0.05),见表 2、图1。
注:Sil:西地那非;与正常对照组比较,*P<0.01;与高糖(HG)组比较,#P<0.01
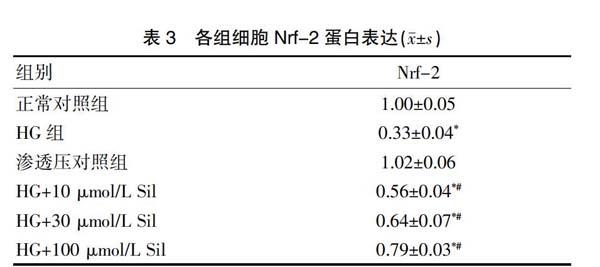
2.5 各组细胞Nrf-2蛋白表达
蛋白免疫印迹结果显示:与正常对照组相比,高糖组Nrf-2蛋白表达明显降低,差异有统计学意义(P<0.01)。与高糖组相比,不同剂量西地那非干预后Nrf-2蛋白表达明显升高,差异有统计学意义(P<0.01)。渗透压对照组Nrf-2蛋白表达与正常对照组相比差异无统计学意义(P>0.05)。见表3、图2、3。
注:Sil:西地那非;与正常对照组比较,*P<0.01;与高糖(HG)组比较,#P<0.01
3 讨论
尽管高糖是DPN 发病的首要因素,但具体机制仍未阐明。高糖可以通过多元醇途径的细胞内山梨醇堆积启动氧化应激,通过蛋白激酶C激活导致糖、脂肪代谢障碍,通过蛋白质及核酸非酶促糖基化增加引起蛋白质及核酸功能失常等途径导致DPN[9],然而线粒体内ROS生成过多是目前公认的导致糖尿病周围神经病变的核心机制[10]。节段性脱髓鞘是DPN最主要的病理改变,而周围神经的髓鞘是由施旺细胞形成的,施旺细胞在周围神经损害修复中起着重要的作用,因此成为DPN治疗中非常重要的靶细胞[11]。
ROS是在维持细胞三羧酸循环过程中产生的。正常情况下,细胞内的抗氧化应激系统可以通过MnSOD、GPX等酶清除ROS以保持细胞内的代谢平衡。但机体在缺氧、高糖等病理条件下细胞内ROS清除能力会显著下降,同时ROS的产生会增加,导致机体内ROS 的大量堆积,从而造成组织器官的氧化应激损伤。因此ROS是反映细胞内氧化应激水平的直接指标[12]。本研究结果显示体外高糖条件下培养48 h的施旺细胞内ROS浓度明显增高,施旺细胞凋亡率明显上升,表明高糖可以显著提高施旺细胞内氧化应激水平导致细胞凋亡。而渗透压对照组的结果提示高糖是引起施旺细胞损害的直接原因,与渗透压无关。
西地那非是一种5型磷酸二酯酶抑制剂(PDE-5i),已被用于治疗勃起功能障碍[13]。其通过抑制PDE-5使NO-cGMP-PKG通路中cGMP浓度上升,通过抑制超氧化物形成来降低氧化应激[14,15]。Wang L等[16]证实,PDE-5i可显著增加糖尿病小鼠坐骨神经中的功能性血管和局部血流量,同时增加坐骨神经的神经纤维密度和感觉传导速度。Nrf-2可以控制多种抗氧化基因和酶对氧化应激的表达,属于转录因子CNC家族。其与胞浆蛋白伴侣分子Keap1结合时处于抑制状态,Nrf-2发生磷酸化后解偶联、转移入核,识别并结合ARE结构,启动如HO-1、GST、SOSTM等在内的一系列抗氧化蛋白表达上调,发挥抗氧化效果[17,18],最近的研究发现Nrf-2在坐骨神经中亦有很好的表达和活化[19-21]。本研究以三种浓度西地那非处理高糖培养施旺细胞,结果显示西地那非改善了高糖对施旺细胞的氧化应激损伤,西地那非组较高糖组,其施旺细胞活性增加,凋亡率下降,表明西地那非对高糖环境下施旺细胞具有保护作用,同时西地那非可以显著提升施旺细胞 Nrf-2 蛋白的表达水平,提示西地那非可能通过激活Nrf-2信号通路诱导抗氧化应激改善高糖对施旺细胞的氧化应激损伤。
综上所述,高糖可通过促进施旺细胞内氧化应激水平抑制细胞增殖,促进细胞凋亡;而西地那非可能通过激活Nrf-2信号通路诱导抗氧化应激改善高糖对施旺细胞的氧化应激损伤,保护高糖环境下施旺细胞,这可能为西地那非在DPN的临床治疗提供新的理论依据和实验基础。
[参考文献]
[1] Chandrasekaran K,Muragundla A,Demarest T,et al. mGluR2/3 activation of the SIRT1 axis preserves mitochondrial function in diabetic neuropathy[J]. Ann Clin Transl Neurol,2017,4(12):844-858.
[2] Tesfaye S. Recent advances in the management of diabetic distal symmetrical polyneuropathy[J]. J Diabetes Investig,2011,2(1):33-42.
[3] Prabodha L,Sirisena N,Dissanayake V. Susceptible and prognostic genetic factors associated with diabetic peripheral neuropathy:A comprehensive literature review[J].Int J Endocrinol,2018.
[4] Román-Pintos L,Villegas-Rivera G,Rodríguez-Carrizalez A,et al. Diabetic polyneuropathy in type 2 diabetes mellitus:Inflammation,oxidative stress,and mitochondrial function[J]. J Diabetes Res,2016,2016:3425617.
[5] 張孝丽,郭晖.Α-硫辛酸治疗糖尿病周围神经病变的研究进展[J].医学综述,2017,17(2):281-283.
[6] Callaghan BC,Cheng HT,Stables CL,et al. Diabetic neuropathy:clinical manifestations and current treatments[J]. The Lancet Neurology,2012,11(6):521-534.
[7] Lledo-Garcia E,Rodriguez-Martinez D,Cabello-Benavente R,et al. Sildenafil improves immediate posttransplant parameters in warm-ischemic kidney transplants:experimental study[J]. Transplant Proc,2017,39(5):1354-1356.
[8] 赵富生,武庚,武杨,等. 雪旺细胞对不同年龄大鼠BMSCs分化的影响[J]. 中国修复重建外科杂志,2011,25(2):160-165.
[9] Brownlee M.The pathobiology of diabetic complications:A unifying mechanism[J].Diabetes,2005,54(6):1615-1625.
[10] Volpe CMO,Villar-Delfino PH,Dos Anjos PMF,et al. Cellular death,reactive oxygen species(ROS) and dia-betic complications[J]. Cell Death Dis,2018,9(2):119.
[11] Lennertz RC,Medler KA,Bain JL,et al. Impaired sensory nerve function and axon morphology in mice with diabetic neuropathy[J]. J Neurophysiol,2011,106(2):905-914.
[12] Wu YB,Shi LL,Wu YJ,et al.Protective effect of gliclazide on diabetic peripheral neuropathy through Drp-1 mediated-oxidative stress and apoptosis[J]. Neurosci Lett,2012,523(1):45-49.
[13] Iqbal Z,Azmi S,Yadav R,et al. Diabetic peripheral neuropathy:Epidemiology,diagnosis, and pharmacotherapy[J]. Clin Ther,2018,40(6):828-849.
[14] Jeong KH,Lee TW,Ihm CG,et al. Effects of sildenafil on oxidative and inflammatory injuries of the kidney in streptozotocin-induced diabetic rats[J]. American Journal of Nephrology,2009,29(3):274-282.
[15] Muzaffar S,Shukla N,Srivastava A,et al. Sildenafil citrate and sildenafil nitrate(NCX 911) are potent inhibitors of superoxide formation and gp91phox expression in porcine pulmonary artery endothelial cells[J]. British Journal of Pharmacology,2005,146(1):109-117.
[16] Wang L,Chopp M,Szalad A,et al. Tadalafil promotes the recovery of peripheral neuropathy in type Ⅱ diabetic mice[J]. PLoS One,2016,11(7):e0159665.
[17] Jana S,Patra K,Jana J,et al. Nrf-2 transcriptionally activates P21(Cip/WAF1) and promotes A549cell survival against oxidative stress induced by H2O2[J]. Chemico-Biological Interactions,2018,285:59-68.
[18] Li L,Dong H,Song E,et al. Nrf2/ARE pathway activation,HO-1 and NQO1 induction by polychlorinated biphenyl quinone is associated with reactive oxygen species and PI3K/AKT signaling[J]. Chemico-Biological Interactions,2014,209:56-67.
[19] Lan X,Han X,Li Q,et al. (-)-Epicatechin,a natural flavonoid compound,protects astrocytes against hemoglobin toxicity via Nrf2 and AP-1 signaling pathways[J]. Molecular Neurobiology,2017,54(10):7898-7907.
[20] Gao W,Lin P,Hwang E,et al. Pterocarpus santalinus L. Regulated ultraviolet B irradiation-induced procollagen reduction and matrix metalloproteinases expression through activation of TGF-beta/Smad and inhibition of the MAPK/AP-1 pathway in normal human dermal fibroblasts[J]. Photochemistry and Photobiology,2018,94(1):139-149.
[21] Li M,Li Q,Zhao Q,Zhang J,et al. Luteolin improves the impaired nerve functions in diabetic neuropathy:Behavioral and biochemical evidences[J]. International Journal of Clinical and Experimental Pathology,2015,8(9):10112-10120.
(收稿日期:2019-12-10)

