氧化镁水热合成氢氧化镁工艺条件研究
汪云川,鄢 僖,唐 博,葛方秋
(呼伦贝尔东明矿业有限责任公司,内蒙古呼伦贝尔 021500)
氧化镁的水化过程影响因素较为复杂。氧化镁水化率与活性密切相关:(1)氧化镁的水化率与其活性成正比,相同水化条件下,氧化镁的活性越高,水化率越大[1];(2)氧化镁的水化率与水化温度及水化时间成正比[2];(3)不同来源的氧化镁其活化能略有差别。这是因为氧化镁形成的机理不同导致其晶格完美程度不同,破坏其晶格所需活化能就不同,表现为氧化镁的化学活性不同,氧化镁的活性在很大程度上决定于其结晶性能[3-6];(4)氧化镁的水化反应机理可描述为:氧化镁首先吸附周围的水,进行化学反应形成氢氧化镁表面层,这个表面层并不稳定,很快向周围水中扩散,至溶液饱和后形成沉淀[7];(5)随着水化反应的进行,水化速率变慢。这是因为水化到一定程度后,氢氧化镁的量增大,大量氢氧化镁沉附于水化氧化镁的周围,阻止了氢氧化镁的扩散和水分子进入氧化镁的表面。这时不能排除水化反应由化学反应控速向氢氧化镁扩散控速转化的可能[8]。总之,氧化镁水化受水化剂、水化温度、水化时间、液固比、陈化时间等因素的影响。高效水化剂的选择至关重要,高效的水化剂不仅会大大缩短水化时间而且可以提高氧化镁的水化率,合适的水化剂还可以提高水化产物氢氧化镁的过滤性能[8]。
1 实验部分
1.1 主要原料
MgO:水氯镁石热解得到的MgO,组成如表1所示。

表1 氧化镁主要组分Tab.1 Main components of MgO %
水氯镁石热解得到的产物氧化镁含量94.2%,氯化镁含量2.2%,其余为少量钾、钠等可溶性氯化物。
1.2 其它试剂及实验仪器
36%乙酸,分析纯,山东浩中化工科技有限公司;乙酸镁,分析纯,深圳中粤化学有限公司;氢氧化镁,分析纯,廊坊鹏彩精细化工有限公司;恒温水浴锅,苏州威尔实验用品有限公司;电动搅拌器,广州市深华生物技术有限公司;高温电动鼓风干燥箱,南京盟博科技有限公司。
1.3 分析表征方法
氧化镁的转化率按如下三个公式计算:

(1)

(2)
(3)
式中:X——氧化镁的水化率,%;C——物质的量浓度,mol/L;V——溶液的体积,L;M——摩尔质量,g/mol;m——产品的质量,g;P——氧化镁的纯度。
溶液中镁离子的物质的量浓度用EDTA滴定法分析。
1.4 实验部分
1.4.1 实验原理和实验流程图
氧化镁水化原理。氧化镁的水化是复杂的过程,氧化镁水化的影响因素很多,氧化镁的水化受水化剂、水化温度、水化时间、液固比、陈化时间等因素的影响。
氧化镁的水化方程式为:

氧化镁水化流程图,如图1。

图1 氧化镁水化流程图Fig.1 Flow chart of MgO hydration
1.4.2 实验方案设计
实验主要考察水化温度、水化时间、液固比、水化剂用量、搅拌速度、陈化时间这些主要因素对水化率的影响。实验是在搅拌装置搅拌转态下完成的,文献报道氧化镁水化过程中加入晶种可以使生成物的晶体颗粒变大,在水化实验中拟加入氢氧化镁做为晶种,使生成的氢氧化镁晶体颗粒变大,提高氢氧化镁的过滤性能。氧化镁水化实验中水化转化剂的选择在该实验中至关重要,合适的水化转化剂不仅会提高原料的水化率,缩短水化时间,而且可以改善水化产物的过滤性能。水化实验过程中根据前期实验结果选择水化剂为乙酸和乙酸镁。实验主要考察以上应素与水化率之间的关系,最终产品氢氧化镁的纯度主要是由水化原料氧化镁的纯度决定,氢氧化镁的过滤洗涤性能对最终产品的纯度也有影响,因为得到的氢氧化镁过滤性能差会夹带部分杂质。实验因素表如表2。

表2 实验因素表Tab.2 Table of experiment factors
1.4.3 各因素与水化率的关系图
通过DPS设计9因素15水平均匀实验方案,三次重复实验选取平均值,实验取得数据平均结果如表3。
实验数据进行二次多项式逐步回归时,对指标在0~100的百分数直接建模、优化分析得到最优组合,求最大值时其观测值可能大于100,这明显不合理,因此,对百分率数据进行建模,分析前先将观测值进行Logistic转换,公式为x′=ln(x/(1-x)),应用Logistic转换值进行建模、优化,最后对结果进行algic转换得到实际所需结果。
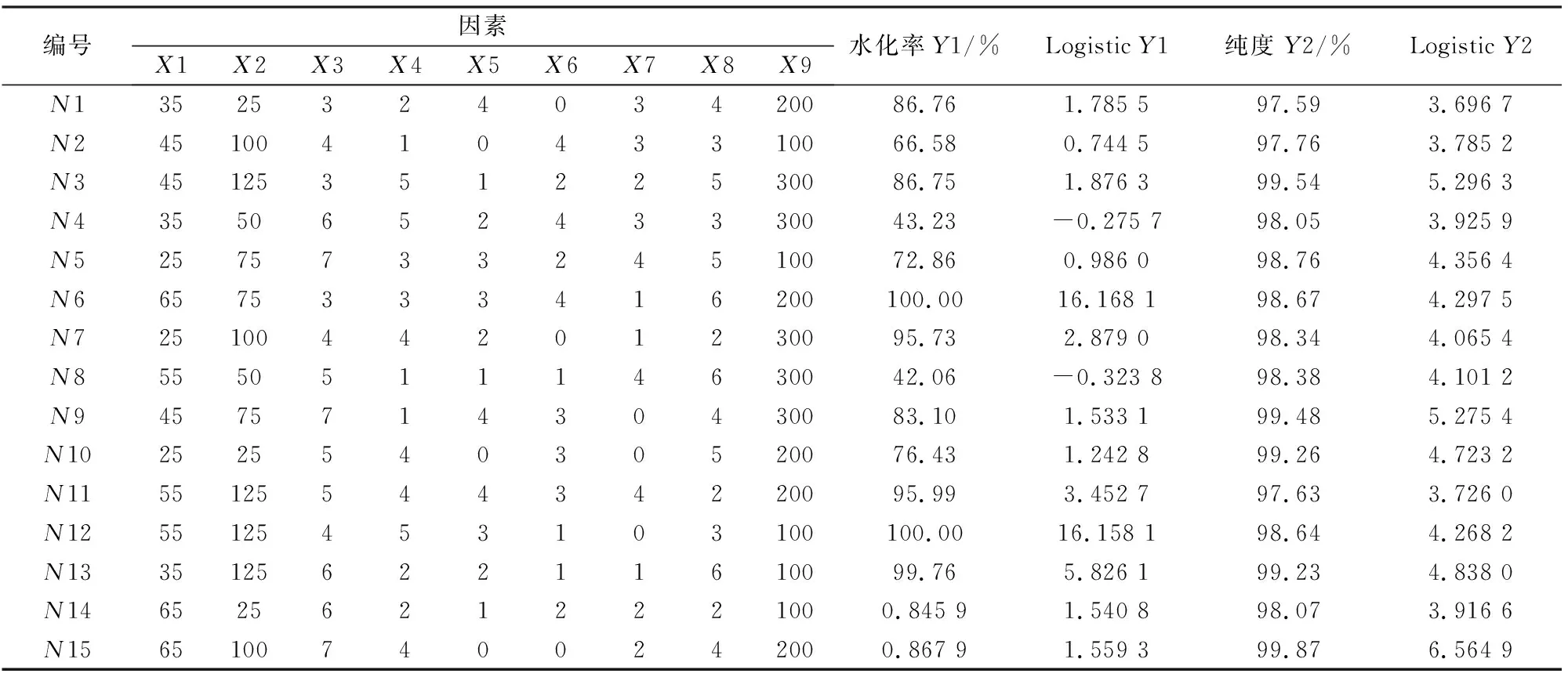
表3 水化率和纯度实验结果Tab.3 Experimental results of hydration rate and purity
1.4.4 二次多项式模型回归
采用DPS数据处理系统软件包,对LogisticY1进行二次多项式逐步回归,得到各因素同水化率之间关系的数学模型(方差分析表如表4):
LogisticY1=9 840 557+0.024 290 677 940×X2-0.000 447 739 151 4×X2×X2-0.469 909 326 0×X5×X5+0.066 489 596 84×X7×X7+0.158 717 025 46×X1×X5-0.079 219 788 15×X1×X7+0.010 332 417 174×X2×X3+0.002 228 034 860 9×X2×X4-0.016 015 375 877×X3×X4-0.654 614 884 7×X3×X5+0.587 810 379 4×X7×X8-0.520 827 975 3×X8×X9
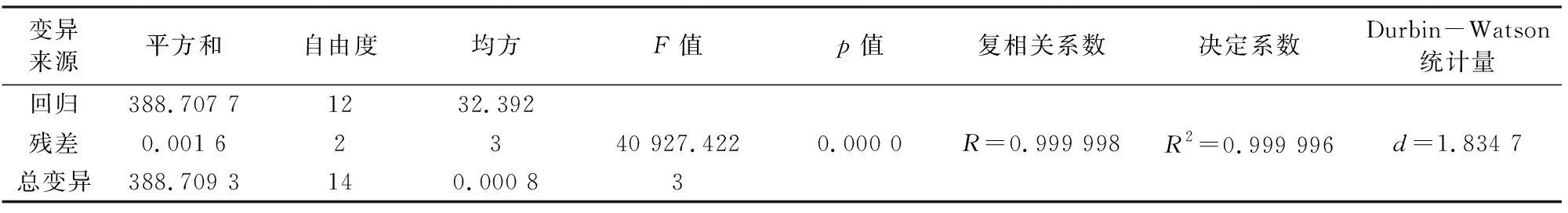
表4 方差分析表Tab.4 Analysis of variance
对LogisticY2进行二次多项式逐步回归,得到各因素同纯度之间关系的数学模型:
LogisticY2=6.583 869 85-1.164 549 581 6×X3+0.117 087 815 20×X3×X3+0.000 221 297 695 93×X1×X2-0.096 265 044 29×X4×X5+0.089 514 710 95×X4×X9-0.064 194 470 58×X6×X7
方程中缺少X1、X2、X4、X5、X6、X7、X8、X9的一次项,说明这些因素对实验结果影响比较小,对建立模型没有实际意义,尤其显著水平大于0.05的予以剔除。根据上面数学模型可以知道,所有因素中只有X3项对回归方程影响最显著,因此说明在氧化镁水化中液固比对纯度影响较大,液固比越高,纯度越低。另外其它因素的交互作用对纯度有一定影响。
主要结果解释:二次多项式回归模型F值应越大越好,F值越大,回归模型越显著,如果F值太小,回归方程不显著,不适合建立二次多项式模型分析,显著水平p应该小于等于0.05,说明该因子具有显著性,在回归方程过程中,各因素间互作项的显著水平p>0.05的均予以剔除。对于剩余标准偏差及调整后的相关系数值越大,越说明回归方程回归良好,而Durbin-Watson统计量得值维持在2附近最好。由表1~表5可知,该实验设计DPS拟合值与实验观测值之间拟合误差非常小,相对误差均小于0.1%,说明方程回归非常好。而两回归方程的F值、p值、相关系数、Durbin-Watson统计量均满足回归方程的要求,说明回归方程能够很好的拟合实际情况。运用DPS数据处理系统对氧化镁水化率(LogisticY1)最优指标求解,并据此条件的各因素值,求解水化得到的氢氧化镁纯度(LogisticY2)的值,所得结果如表6。

表5 方差分析表Tab.5 Analysis of variance

表6 理论最优条件组合表Tab.6 Combination table of theoretical optimal condition
氧化镁水化只是完成了制备高品质氧化镁的第一步,氧化镁在一定条件下加入高效水化剂得到了高纯的氢氧化镁,水化得到的氢氧化镁首先要经过水洗,该实验得出最佳水洗量为所得固体质量的4倍,用蒸馏水经过洗涤、抽滤,如有特殊用途还需用无水乙醇进行处理,处理完后的氢氧化镁经过常温烘干、粉碎后得到高纯氢氧化镁。在制备氧化镁的过程中主要通过高温煅烧等工艺得到高附加值氧化镁产品,原料氧化镁的水化率是制备高附加值氧化镁的关键因素,要求其水化率越高越好[10]。高附加值氧化镁的纯度主要是由水化得到的氢氧化镁的纯度决定的,所以氢氧化镁的纯度越高得到的氧化镁纯度就越高,附加值越大。
2 DPS软件回归处理后的几个因素与水化率的关系图(图2~图4)
从图2可以看出氧化镁的水化率随时间的增加而增加,当时间达到100 min时氧化镁水化趋势已经平缓,在100 min左右时活性氧化镁已全部完成水化。
从图3可以看出随着温度的升高水化率是增加的趋势,当温度达到60 ℃左右时氧化镁已经完全水化,所以选择最佳水化温度为60 ℃。
从图4可知氢氧化钠的量与水化率是负相关的,随着氢氧化钠含量的增加水化率呈下降趋势,因为氢氧化钠的存在抑制了氢氧化镁的生成。再者有氢氧化镁存在的情况下氢氧化钠影响其过滤性能,在氢氧化钠存在的条件下水化生成的氢氧化镁易成为胶体状,不容易过滤。
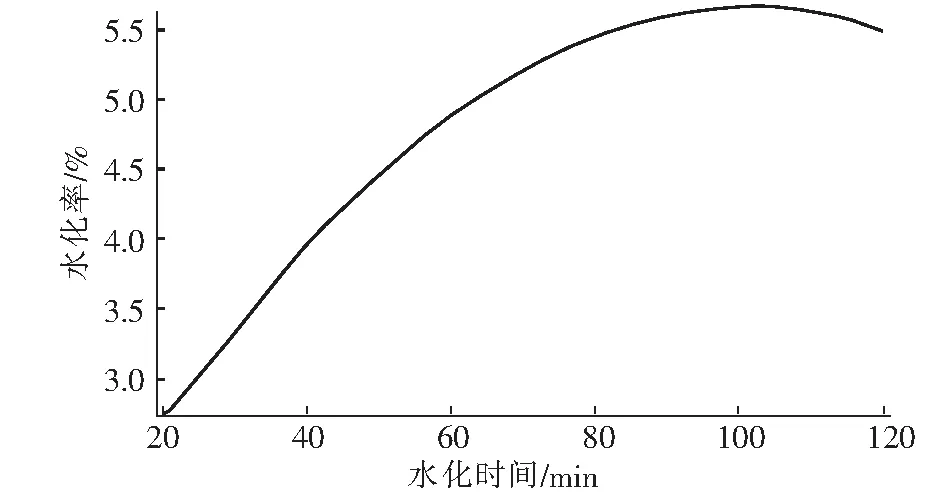
图2 水化时间与水化率的关系图Fig.2 Relationship between hydration time and hydration rate

图3 水化温度与水化率的关系图Fig.3 Relationship between hydration temperature and hydration rate
液固比过大氧化镁的水化率反而会降低,这是因为液固比过大,相当于氧化镁的浓度降低,选择最佳液固比为4。水化率与陈化时间成正比,陈化时间越长水化率越高,最佳陈化时间为4 h。水化剂量对水化率的影响显著,水化剂含量X5含量为3.15%时水化率达到最高值。
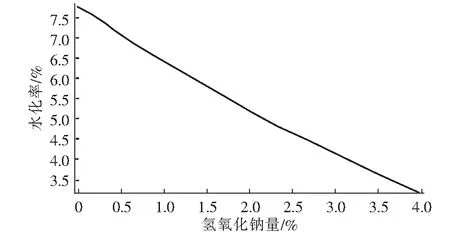
图4 氢氧化钠与水化率关系图Fig.4 Relationship between NaOH and hydration rate
由以上分析结果可知,氯化镁热解得到的氧化镁为原料制备氢氧化镁,氧化镁水化的最优条件:水化温度(X1)60 ℃、水化时间(X2)100 min、液固比(X3)为4(固体与液体质量比)、陈化时间(X4)4 h、水化剂乙酸钠(X5)3.20%、水化剂乙酸(X6)4.0%、水化剂氢氧化钠(X7)0、水化后产物过滤后洗水量(X8)4倍(原料质量的倍数)、搅拌速度(X9)1档(120 r/min),预测的原料的水化率(Y1)为99.99%、产物Mg(OH)2含量(Y2)98.31%。氢氧化钠(X7)为0说明氢氧化钠对水化过程有负面影响,从氢氧化钠与水化率关系图也可以看出随着氢氧化钠含量的增加水化率呈下降趋势。再者有氢氧化镁存在的情况下氢氧化钠影响其过滤性能。
3 小结
实验最后在最优条件下考察了氢氧化镁晶种加入后对水化产物过滤性能的影响,氢氧化钠的加入会导致水化产物氢氧化镁容易形成胶体使得水化产物氢氧化镁的过滤性能大大降低,在水化过程中加入氢氧化镁可能是由于氢氧化镁的加入使得在水化过程中水化形成的氢氧化镁会以加入的氢氧化镁为晶核,在加入的氢氧化镁晶核周围继续形成新的氢氧化镁,在此过程中氢氧化镁晶体不断长大,使形成的氢氧化镁晶粒颗粒变大,不仅大大提高氢氧化镁的过滤性能而且会减少滤饼对杂质的夹带,进一步提高水解产物氢氧化镁的纯度,最终提高镁化合物的附加值。
由最优组合表可以得到氧化镁原料的最佳水化条件,用理论最优水化条件进行实验,实验结果为水化产物Mg(OH)2含量为99.56%,原料水化率99.52%,实验结果优于理论计算值,说明均匀实验设计合理。最终得到的水化产物纯度高,满足要求。氢氧化镁的加入有利于提高水化产物的过滤性能,氢氧化镁加入量为水化原料的2%。

