基于NF-κB信号通路的高压氧干预对BMSCs移植治疗脊髓损伤大鼠炎症因子及血糖水平的影响
王 军,桑卫华,苏 柯
脊髓损伤是中枢神经系统的一种严重创伤,近年来其发生率呈现逐年增高趋势,常导致损伤节段以下肢体严重功能障碍及神经功能障碍[1]。炎症反应是脊髓损伤的诱导因素之一[2],骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)移植是近年来脊髓损伤治疗的研究热点[3],其可促进神经营养因子分泌,加速神经纤维生长,抑制炎症反应。高压氧干预[4]是目前临床常用的脊髓损伤治疗手段,可有效改善病灶区域供氧,抑制神经元凋亡,减轻炎症反应。在脊髓损伤急性期BMSCs移植和高压氧干预均可通过抑制炎症反应来减轻病理损伤[5]。核转录因子-κB(nuclear transcription factor-κB,NF-κB)是一类关键性的核转录因子[6],有研究发现BMSCs移植和高压氧干预可通过NF-κB信号通路改善脊髓损伤大鼠后肢运动功能[5],但其对炎症因子及血糖水平的影响尚不清楚。本研究基于NF-κB炎症信号通路的高压氧干预对BMSCs移植治疗脊髓损伤大鼠白细胞介素1β(interleukin 1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)及血糖水平的影响进行了探讨,以期为临床治疗脊髓损伤提供参考。
1 材料与方法
1.1 实验动物及分组 SD大鼠40只,SPF级,雄性,3~4周龄,体质量(90±10)g,购于上海生旺实验动物养殖有限公司,生产许可SCXK(沪)2018-0001。40只大鼠适应性喂养7 d后随机分为假手术组、模型组、BMSCs组、BMSCs+高压氧组,每组10只。
1.2 造模及干预 造模方法:采用改良Allen打击法[5]制备大鼠脊髓损伤模型。假手术组仅咬除T9~10棘突及椎板,剪开硬脊膜,暴露脊髓,不损伤脊髓;缝合切口后放到饲养环境中,造模失败大鼠剔除并随机补足。模型组于造模1 h后尾静脉注射1 mL PBS溶液;BMSCs组于造模1 h后尾静脉注射1 mL BMSCs悬液(3×106个);BMSCs+高压氧组于造模1 h后尾静脉注射1 mL BMSCs悬液(3×106个),BMSCs注射完成后将大鼠置于高压氧舱内,纯氧洗舱10 min,加压至0.2 MPa,稳压50 min,期间维持氧体积分数>80%,随后匀速减压20 min至常压,1/d,持续7 d。
BMSCs培养及鉴定:无菌条件下取SD大鼠双侧股骨与胫骨内骨髓细胞,将细胞浓度调整至约1×106/cm2,加至4 mL含10%血清的低糖培养基,置于37 ℃、5% CO2的培养箱中培养,细胞贴壁后换液,待细胞融合度达到约85%,经2.5 g/L胰蛋白酶(山东西唐生物科技有限公司)消化后传代培养,培养至第3~4代,细胞生长良好且生长密度达85%时于BMSCs悬液中加入大鼠抗大鼠CD29-FITC抗体(上海华壹生物科技有限公司)、CD90-PE抗体(上海信裕生物科技有限公司)、CD45-PE-cy5抗体(上海哈灵生物科技有限公司)、同型对照FITC(上海史瑞可生物科技有限公司),各10 μL,25 ℃避光孵育0.5 h,无菌PBS重悬,细胞悬液采用流式细胞仪(北京科誉兴业科技发展有限公司)鉴定后备用。
1.3 评价指标 ①大鼠后肢运动功能:于术后第8天采用Basso-Beattie-Bresnahan (BBB)评分评定大鼠后肢运动功能,后肢运动功能分为22个级别,后肢运动功能完全正常为21分,后肢完全瘫痪为0分。将大鼠放入开口盆,轻敲盆壁使其爬行,由2人观察大鼠后肢运动情况。每只大鼠用时5 min,评定3次,取2人得分的平均值。②TNF-α、IL-1β、血糖含量:各组大鼠后肢运动功能评定结束后采集其外周静脉血5 mL,1 000 r/min离心20 min,分离血清,采用全自动生化分析仪(深圳市库贝尔生物科技股份有限公司)检测血糖水平,采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测TNF-α、IL-1β含量。③脊髓组织病理学变化:各组大鼠采血结束后将其处死,取其损伤中心处脊髓组织,苏木素-伊红染色显微镜下观察染色结果。④脊髓组织中NF-κB、核因子κB抑制蛋白α(inhibitorg protein of NF-κB-α,IκB-α)蛋白水平:采用Western Blot检测脊髓组织中NF-κB、IκB-α蛋白水平。取脊髓组织,加入RIPA裂解液,12 000 r/min离心20 min,取上清液,使用BCA蛋白浓度测定试剂盒进行蛋白定量,将定量裂解后的样品取100 μL加入25 μL 5×蛋白上样缓冲液混匀,电磁炉煮沸15 min,用微量加样器将煮沸后的样品滴加到凝胶孔内进行电泳,切胶,转膜,5%脱脂奶粉封闭液(美国BD公司)封闭,PBST洗膜3次×5 min,加入1∶500稀释的兔抗NF-κB单克隆抗体(美国CST公司)、1∶500稀释的鼠抗IκB-α单克隆抗体(上海田源生物技术有限公司)、1∶500稀释的兔抗GAPDH单克隆抗体(北京普利莱基因技术有限公司),4 ℃孵育过夜,PBST洗膜3次×5 min,加入1∶2 500稀释的山羊抗大鼠IgG(武汉艾美捷科技有限公司),25 ℃孵育60 min,PBST洗膜3次×5 min,ECL显色剂孵育PVDF膜5 min,加入富士感光胶片,压片、显影、定影,使用Image J软件分析各条带灰度值,以目的蛋白灰度值与GAPDH灰度值比值代表目的蛋白含量。

2 结果
2.1 各组大鼠BBB评分 模型组、BMSCs组、BMSCs+高压氧组大鼠BBB评分显著低于假手术组(P<0.05),BMSCs组、BMSCs+高压氧组大鼠BBB评分显著高于模型组(P<0.05),BMSCs+高压氧组大鼠BBB评分显著高于BMSCs组(P<0.05),表1。
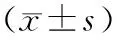
表1 各组大鼠BBB评分
2.2 各组大鼠血清中TNF-α、IL-1β、血糖水平 模型组、BMSCs组、BMSCs+高压氧组大鼠血清中TNF-α、IL-1β、血糖水平显著高于假手术组(P<0.05),BMSCs组、BMSCs+高压氧组大鼠血清中TNF-α、IL-1β、血糖水平显著低于模型组(P<0.05),BMSCs+高压氧组大鼠血清中TNF-α、IL-1β、血糖水平显著低于BMSCs组(P<0.05),表2。
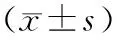
表2 各组大鼠血清中TNF-α、IL-1β、血糖水平
2.3 各组大鼠脊髓组织病理学变化 假手术组脊髓组织结构完整,无出血肿胀,神经组织形态正常,细胞核较大且轮廓清晰,无炎性细胞浸润。模型组脊髓组织结构不完整,有出血肿胀,神经组织结构紊乱,细胞核裂解甚至消失,大量炎性细胞浸润。BMSCs组脊髓组织结构较清晰,有部分出血肿胀,神经组织较连续,细胞核形态趋于正常,炎性细胞浸润减少。BMSCs+高压氧组脊髓组织病理损伤较BMSCs组明显减轻(图1)。
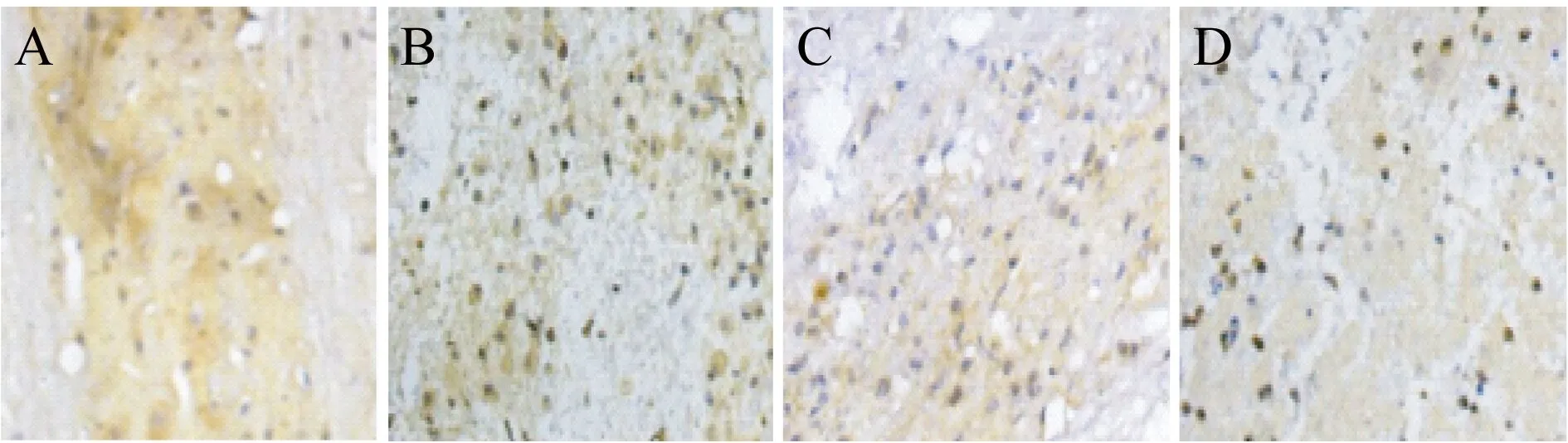
注:A,假手术组;B,模型组;C,BMSCs组;D,BMSCs+高压氧组图1 各组大鼠脊髓组织病理学变化(HE染色,×400)
2.4 各组大鼠脊髓组织中NF-κB、IκB-α蛋白水平模型组、BMSCs组、BMSCs+高压氧组大鼠脊髓组织中NF-κB蛋白水平显著高于假手术组(P<0.05),IκB-α蛋白水平显著低于假手术组(P<0.05);BMSCs组、BMSCs+高压氧组大鼠脊髓组织中NF-κB蛋白水平显著低于模型组(P<0.05),IκB-α蛋白水平显著高于模型组(P<0.05);BMSCs+高压氧组大鼠脊髓组织中NF-κB蛋白水平显著低于BMSCs组(P<0.05),IκB-α蛋白水平显著高于BMSCs组(表3、图2)。
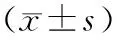
表3 各组大鼠脊髓组织中NF-κB、IκB-α蛋白水平
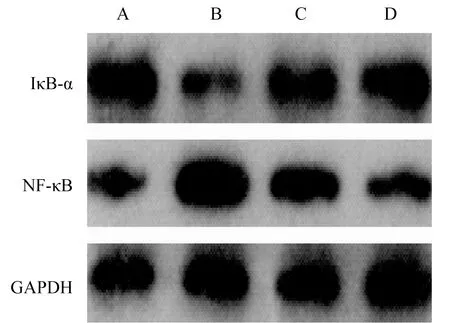
注:A,假手术组;B,模型组;C,BMSCs组;D,BMSCs+高压氧组图2 各组大鼠脊髓组织中NF-κB、IκB-α蛋白水平
3 讨论
脊髓损伤包括原发性损伤和继发性损伤[7],原发性脊髓损伤主要是暴力引起的血管、神经破坏或断裂,继发性脊髓损伤则是在前者基础上进一步引起的脊髓出血水肿、缺血再灌注、炎症反应等[1],炎症反应是脊髓继发性损伤一系列瀑布式反应的关键部分,有研究发现BMSCs移植和高压氧干预在脊髓损伤急期均可通过抑制炎症反应来改善脊髓组织病理性改变从而减轻脊髓损伤[5]。
BMSCs移植以其取材方便、移植痛苦小、移植费用低、不良反应小、移植病程短、感染率低等优点引起国内外学者广泛关注[8],成为近年来脊髓损伤修复的研究热点。BMSCs具有自我更新快和可自体移植等特点,可分化为神经细胞,分泌神经生长因子如脑源性神经营养因子、胶质细胞源性神经生长因子等,促进神经元、轴突再生[9];还可抑制炎性细胞活化,下调炎症因子水平,减轻炎症反应[10]。脊髓损伤后采用BMSCs移植疗效较好,短时间内就可以改善运动功能障碍,是治疗脊髓损伤的有效手段[11]。高压氧干预为缺血缺氧性疾病的常用治疗手段,该法能够修复血脊髓屏障,改善受损组织微循环,减少局部血容量,减轻组织水肿[12];还能维持神经细胞能量代谢,促进神经细胞修复,促进轴突再生,改善运动及神经功能[13]。本研究结果显示BMSCs+高压氧组大鼠BBB评分显著高于模型组、BMSCs组,BMSCs+高压氧组较模型组、BMSCs组脊髓组织肿胀明显减轻,炎性细胞浸润明显减少,这同Geng等[14]研究结果一致,说明BMSCs移植和高压氧干预可促进脊髓损伤大鼠运动功能恢复及损伤修复。NF-κB是炎症反应过程中的关键调节因子,有研究发现脊髓损伤时NF-κB炎症信号通路受到出血、缺氧等刺激,其抑制蛋白IκB-α被激活导致IκB蛋白磷酸化,NF-κB二聚体被释放,与靶基因特定结合位点结合,导致神经元细胞内NF-κB表达增多,TNF-α、IL-1β等炎症因子水平上调,而TNF-α、IL-1β又可进一步激活NF-κB炎症信号通路,形成正反馈调节机制,使炎症反应不断放大,加重脊髓损伤[15]。本研究结果与上述研究结论相符,本研究中BMSCs+高压氧组大鼠脊髓组织中NF-κB蛋白水平显著低于模型组、BMSCs组,IκB-α蛋白水平显著高于模型组、BMSCs组,BMSCs+高压氧组大鼠血清中TNF-α、IL-1β含量显著低于模型组、BMSCs组,说明BMSCs移植和高压氧干预可通过抑制NF-κB炎症信号通路下调炎性因子TNF-α、IL-1β表达,减轻炎性反应。有研究发现[16]脊髓损伤后机体普遍存在不同程度高血糖,且高血糖与脊髓损伤患者致残率密切相关,是影响脊髓损伤预后的重要因素之一。本研究结果显示模型组大鼠血糖水平显著高于假手术组,BMSCs+高压氧组大鼠血糖水平显著低于模型组、BMSCs组,提示BMSCs移植和高压氧干预可能通过抑制NF-κB炎症信号通路调节胰岛B细胞分泌活动而降低血糖水平,促进大鼠脊髓损伤修复。
综上所述,基于NF-κB信号通路的高压氧干预能够抑制BMSCs移植治疗脊髓损伤大鼠炎症因子表达,降低血糖水平,减轻脊髓损伤后病理变化,促进脊髓损伤修复,这可为治疗脊髓损伤提供新的研究方向。

