苦瓜提取物联合脂肪干细胞移植对顺铂所致大鼠肾损伤的影响
于雅娟
临床上医者常将顺铂用于辅助治疗多种肿瘤疾病,其疗效较好,但是剂量过大或者使用时间过长将会引起肾脏等器官的严重中毒[1]。因此,研究顺铂急性肾损伤的防治具有重要意义。苦瓜中含有多种生物活性物质,可以保护肾脏免受糖尿病和阿霉素等诱导的损伤[2-3]。研究显示,外源性脂肪干细胞移植后靶向性迁移到肾脏损伤部位,从而促进损伤的肾小管结构和功能的恢复[4-6]。本研究旨在探讨苦瓜提取物和脂肪干细胞移植联合治疗顺铂所致肾脏损伤的疗效及机制。
1 材料和方法
1.1 材料 DMEM/F12培养基、PBS(美国Hyclone公司);晚期糖基化终产物受体(receptor for advanced glycation end products,RAGE)、活性氧(reactive oxygen species,ROS)、Bcl-2和Bax兔抗大鼠多克隆抗体(美国Santa Gruz公司);辣根过氧化物酶标记的山羊抗兔IgG(英国Abcam公司);胰蛋白酶、TRIzol试剂、逆转录PCR(reverse transcription PCR,RT-PCR)试剂盒(大连宝生物工程有限公司)。清洁级成年雄性SD大鼠75只,体质量200~250 g,由北京维通利华动物实验技术有限公司提供,生产许可证号:SCXK(蒙)2014-0001,实验动物使用许可证号:SYXK(蒙)2014-0002。大鼠于室温25 ℃,湿度60%~70%,SPF环境下自由饮水和采食。
1.2 实验方法
1.2.1 脂肪干细胞复苏与PKH-26标记 鼠脂肪干细胞迅速放入37 ℃恒温水浴箱中,在30 s内快速复苏后,稀释、离心、弃上清、洗涤细胞后用DMEM完全培养液重悬细胞,并调细胞浓度为1×106/mL,MTT法检测不同时间点细胞增殖活化能力,培养箱取出细胞,更换新培养液,各孔加入20 μL 5 g/L MTT,振荡均匀,放入细胞培养箱培养4 h,弃掉各孔上清液,加入150 μL二甲基亚砜,振荡10 min,酶标仪测定各孔吸光度值。在细胞培养箱中培养7 d之后离心、弃上清、洗涤细胞,将细胞浓度调整到1×106/mL,对细胞行PKH-26标记,显微镜观察。
1.2.2 顺铂肾损伤模型建立及分组 75只SD大鼠随机选15只为对照组,将剩余大鼠经尾静脉给予5 mg/kg顺铂,每周注射1次,连续3周,建立顺铂诱导的大鼠肾脏损伤模型(参与造模的60只大鼠血液中肌酐和尿素氮水平显著高于造模前)。将建模成功的60只大鼠随机分为模型组、苦瓜提取物组、脂肪干细胞组及联合治疗组,每组15只。造模成功后24 h,脂肪干细胞组大鼠经尾静脉注射0.5 mL 1×108/L的脂肪干细胞悬液,苦瓜提取物组大鼠灌胃80 mg/kg苦瓜提取物,联合治疗组大鼠同时给予脂肪干细胞悬液和苦瓜提取物。对照组和模型组尾静脉注射0.5 mL DMEM/F12培养液。上述干预措施1/d,连续7 d。
1.2.3 血清肌酐和尿素氮水平测定 治疗7 d,每组随机取3只大鼠,采集尾静脉血必要时联合内眦静脉采血2 mL,分离血清,全自动生化分析仪检测血清肌酐和尿素氮水平。
1.2.4 尿液中NAG、γ-GT和尿蛋白水平测定 治疗7 d,每组随机取3只大鼠,收集24 h尿液,按照试剂盒说明书操作,测定大鼠尿N-乙酰-β-D-葡萄(N-acetyl-b-D-glucosaminidase,NAG)、尿γ-谷氨酰转肽酶(γ-glutamyltranspeptidase,γ-GT)和尿蛋白水平。
1.2.5 苏木精-伊红染色 治疗7 d,每组随机取3只大鼠,麻醉后处死,取出肾脏组织,加入10%甲醛固定,制备肾组织切片,梯度乙醇脱水,二甲苯透明,行浸蜡包埋,将包埋好的蜡块于切片机上,切成5~8 μm薄片,再贴到载玻片上,45 ℃烘干,脱蜡后行苏木精-伊红染色,显微镜下观察。
1.2.6 荧光显微镜观察 治疗7 d,取各组大鼠肾脏组织制备冰冻切片。显微镜下每张冰冻切片随机选取3个视野拍照记录;假设每张照片的总亮度为1,为每张照片选取一个光亮度点,利用ACDSee 5.0软件确定其坐标。在图像中随机选取8个视野,观察PKH-26标记脂肪干细胞的存活和分布。
1.2.7 TUNEL法检测 治疗7 d,取各组大鼠肾脏组织制作石蜡切片后脱蜡,向切片上滴加复合消化酶进行室温孵化20 min;洗涤后滴加50 μL TUNEL标记反应混合液,在湿盒中37 ℃孵育1 h,滴加POD2转化液50 μL;湿盒37 ℃孵育30 min,PBS冲洗3次,DAB显色;行苏木精-伊红复染后在荧光显微镜下观察计算凋亡率。
1.2.8 RT-PCR检测 治疗7 d,每组选取3只大鼠,麻醉后取肾脏组织于冰上充分研磨后迅速加入TRIzol试剂裂解细胞抽提总RNA。根据反转录说明书合成相应的cDNA并进行扩增。扩增条件均为94 ℃预变性1 min,94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,共33个循环。RAGE上游:5′-CACCTTCTCCTGTAGCTTCA-3′,下游:5′-TGCCACAAGATGACCCCAAT-3′;ROS上游:5′-ACGGACCCAAAGAGTTAG-3,下游:5′-GTTAGCGTTAGACGGAGC-3′;Bax上游:5′-ACACCTGAGCTGACCTTGGA-3′,下游:5′-CCGTGTCCACGTCAGCAATC-3′;Bcl-2上游:5′-GGTGGTGGAGGAACTCTTCA-3′,下游:5′-ATGCCGGTTCAGGTACTCAG-3′;GAPDH上游:5′-GCCAAGTATGATGACATCAA-3′,下游:5′-CCATATTCATTGTCATACCA-3′。以GAPDH基因为内参,测定RAGE、ROS、Bax、Bcl-2的mRNA相对表达水平。
1.2.9 Western Blot检测 治疗7 d,取冻存肾组织,加入裂解液制成匀浆液,离心取上清,BCA法测定总蛋白浓度。对变性后的蛋白行10%SDS-PAGE凝胶电泳;湿转法转膜至PVDF膜,TPBS洗涤;5%脱脂牛奶4 ℃封闭过夜;加入RAGE、ROS、Bax、Bcl-2一抗室温孵育1 h,TPBS洗涤;加入辣根过氧化物酶标记的羊抗兔IgG二抗室温孵育1 h,TPBS洗涤;用ECL发光试剂盒进行显色,扫描图像并半定量分析,测定各组肾脏组织中RAGE、ROS、Bax、Bcl-2蛋白相对表达水平,以GAPDH为内参。

2 结果
2.1 各组大鼠血清肌酐及尿素氮水平比较 经验证造模成功。干预治疗7 d后,模型组大鼠血清肌酐和尿素氮水平均高于对照组(P<0.05);脂肪干细胞组及苦瓜提取物组鼠血清肌酐和尿素氮水平均明显低于模型组(P<0.05),联合治疗组大鼠血清肌酐和尿素氮水平低于单独治疗组(P<0.05)。表1。
表1 大鼠血清肌酐及尿素氮水平
2.2 各组大鼠尿NAG、γ-GT和尿蛋白水平比较 与对照组比较,肾脏损伤模型组大鼠尿液中NAG、γ-GT和尿蛋白水平明显升高(P<0.05);与模型组比较苦瓜提取物组和脂肪干细胞组大鼠尿液中NAG、γ-GT和尿蛋白水平显著降低(P<0.05),而联合治疗组大鼠上述指标则进一步下降(P<0.05)。表2。
表2 大鼠尿NAG、γ-GT和尿蛋白水平
2.3 大鼠肾脏病理形态变化 光镜观察,对照组(图1A)大鼠肾脏肾小球丰富,轮廓清新、肾小管排列规则;模型组(图1B)大鼠肾脏部分细胞胞核消失,肾小管结构混乱,可见胞浆空泡,肾脏结构病变严重。苦瓜提取物组(图1C)及脂肪干细胞组(图1D)大鼠肾脏肾小球数量较模型组增多,部分区域可见肾小管结构,但显示欠清晰;肾小球局部区域尚可分辨,较对照组模糊,肾脏组织空泡化减轻,病变有所缓解。联合治疗组(图1E)大鼠肾脏组织未见明显的胞浆空泡化,与单独治疗组相比肾脏恢复更为明显。
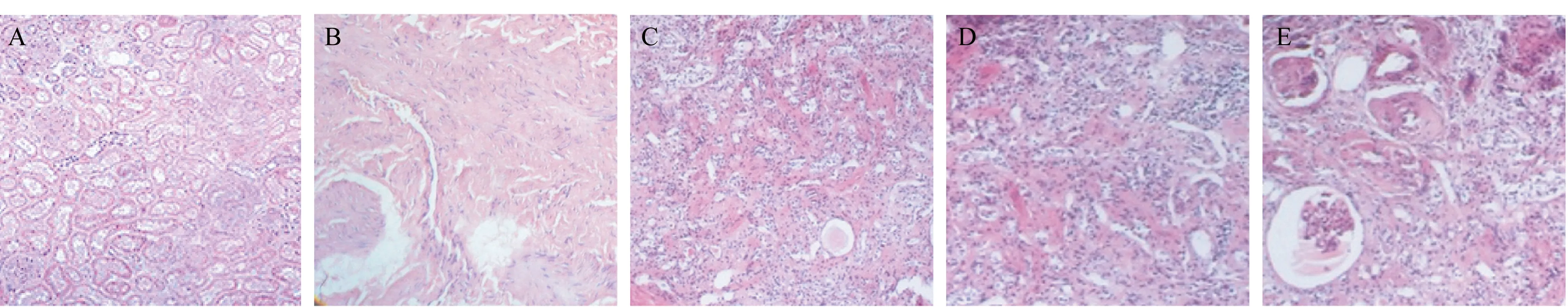
图1 大鼠肾脏病理形态变化(×40)
2.4 脂肪干细胞存活和分布情况 对照组、模型组和苦瓜提取物组大鼠肾脏组织中未见有PKH-26标记的脂肪干细胞,脂肪干细胞组和联合治疗组大鼠肾脏组织中可见PKH-26标记的脂肪干细胞,联合治疗组大鼠肾脏组织中阳性脂肪干细胞数量[(62.48±8.68)个/高倍视野]明显高于脂肪干细胞组[(32.64±4.76)个/高倍视野]。
2.5 各组大鼠肾脏细胞凋亡情况 与对照组[(1.14±0.08)%]比较,模型组大鼠肾脏细胞凋亡率[(15.79±0.14)%]显著升高(P<0.05);脂肪干细胞组[(9.10±0.12)%]和苦瓜提取物组[(9.14±0.10)%]大鼠肾脏细胞凋亡率显著低于模型组[(15.79±0.14)%](P<0.05);与脂肪干细胞和苦瓜提取物单独治疗组比较,联合治疗组大鼠肾脏细胞的凋亡率[(4.82±0.05)%]则进一步降低(P<0.05)。
2.6 各组大鼠肾脏组织中RAGE、ROS、Bax、Bcl-2 mRNA表达水平 与对照组比较,模型组大鼠肾脏组织中的RAGE、ROS和Bax mRNA表达水平显著升高(P<0.05),脂肪干细胞组和苦瓜提取物组大鼠肾脏组织中RAGE、ROS和Bax mRNA表达水平显著降低(P<0.05),联合治疗组大鼠RAGE、ROS和Bax mRNA表达水平最低(P<0.05)。与对照组比较,模型组大鼠肾脏组织中Bcl-2 mRNA表达水平显著降低(P<0.05);脂肪干细胞组和苦瓜提取物组大鼠肾脏组织中Bcl-2 mRNA表达水平显著升高(P<0.05),联合治疗组Bcl-2 mRNA表达水平较高(P<0.05),见图2。
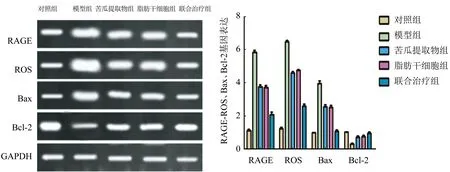
图2 肾脏组织RAGE、ROS、Bax、Bcl-2 mRNA表达
2.7 各组大鼠肾脏组织中RAGE、ROS、Bax、Bcl-2蛋白表达水平 与对照组比较,模型组大鼠肾脏组织中的RAGE、ROS和Bax蛋白表达水平显著升高(P<0.05),脂肪干细胞组和苦瓜提取物组大鼠肾脏组织中RAGE、ROS和Bax蛋白表达水平显著降低(P<0.05),联合治疗组大鼠RAGE、ROS和Bax蛋白表达水平最低(P<0.05)。与对照组比较,模型组大鼠肾脏组织中Bcl-2蛋白表达水平显著降低(P<0.05);脂肪干细胞组和苦瓜提取物组大鼠肾脏组织中Bcl-2蛋白表达水平显著升高(P<0.05),联合治疗组Bcl-2蛋白相对表达水平较高(P<0.05)。
3 讨论
随着顺铂在临床上应用的增多,大剂量顺铂的毒性已经越来越受到关注[7]。临床上对于顺铂毒性的防治常常使用药物促进其排泄,但是这些药物需要静脉滴注,且本身也具有不良反应[8]。苦瓜中含有丰富的生物活性成分,其在肾脏保护方面作用显著。干细胞是一类具有多向分化潜能的多能细胞,研究表明其参与多种受损组织的修复[9]。脂肪干细胞因其易于获得、遗传稳定、可快速扩增,为代谢性疾病的治疗带来了新希望[10]。Atashi等[11]研究表明脂肪干细胞在治疗肾损伤等疾病方面具有巨大潜力。
本研究通过注射顺铂构建肾脏损伤模型,造模后大鼠血清尿素氮、肌酐含量、尿液中NAG、γ-GT及尿蛋白含量明显高于造模前,由此可知大鼠肾脏过滤功能受到严重的损伤。经过不同干预治疗后,脂肪干细胞组和苦瓜提取物组大鼠血清肌酐、尿素氮及尿NAG、γ-GT、尿蛋白含量均显著降低,联合治疗组上述指标进一步降低。苏木精-伊红染色结果显示脂肪干细胞组和苦瓜提取物组肾脏组织学形态明显改善,联合治疗组改善更明显。荧光显微镜观测结果显示联合治疗组中PKH-26标记的脂肪干细胞较多,苦瓜提取物可以促进脂肪干细胞在肾脏组织中的存活和分布。TUNEL细胞凋亡率结果显示,模型组中肾脏细胞凋亡率显著升高,脂肪干细胞和苦瓜提取物单独治疗可以缓解因顺铂引发的肾脏细胞凋亡,联合治疗组中的肾脏细胞凋亡率显著低于单独治疗组。
本研究从分子生物学角度分析苦瓜提取物联合脂肪干细胞移植的抗凋亡作用,结果显示联合治疗组RAGE、ROS、Bax mRNA和蛋白表达水平较苦瓜提取物组、脂肪干细胞组明显下调,Bcl-2 mRNA和蛋白表达水平上调亦明显。RAGE与AGEs相互作用导致细胞氧化-抗氧化防御系统失衡,造成ROS生成增多,促进氧化应激。顺铂引起的肾脏毒性会引起肾脏组织中RAGE-ROS信号通路表达水平上升,进而引起ROS集聚,导致肾脏组织发生病变。研究结果表明,苦瓜提取物和脂肪干细胞联合治疗显著缓解顺铂毒性引发的氧化应激。
在细胞代谢调节中,Bax蛋白可激活线粒体通透性转化孔的开放,引起线粒体结构和功能紊乱,Caspase激活蛋白外流,细胞凋亡;而Bcl-2表达上调可以抑制细胞凋亡,为凋亡抑制基因,是抑制凋亡蛋白酶激活的关键因素[12]。研究结果显示联合治疗组肾脏组织中Bax表达水平下调,Bcl-2表达水平上调,保护了肾脏细胞免受顺铂引起的凋亡。本研究因试验条件有限,对于苦瓜提取物、脂肪干细胞作用机制的研究尚不足,在今后的研究中将进一步深入研究,尽可能从多条可能的通路进行探讨。

