蛋氨酸-胆碱缺乏饮食诱导非酒精性单纯性脂肪肝小鼠模型建立及动态观察
朱文娅,常 艳
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指肝脏脂肪过多蓄积的一种疾病,确诊依赖病理学,治疗仍主要依靠生活方式的改善,还无经过循证医学论证的治疗药物[1]。本病的疾病谱包括了非酒精性单纯性脂肪肝(non-alcoholic simple fatty liver,NAFL)、脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、肝纤维化,也发现了部分患者可进展至晚期肝硬化、肝细胞癌[2]。其中NASH与NAFL的治疗原则和流行病学调查二者的转归都有很大区别。因此,建立合适的NAFL动物模型对于了解这一阶段疾病的病理生理特点具有较大价值。
目前,NAFLD动物模型主要包括由相关基因变异引起的遗传性小鼠模型、饮食诱导的动物模型、获得性和遗传性相结合的动物模型。在这些模型中,遗传性小鼠模型的建立一般通过改变NAFLD发病过程中的关键酶缺陷、瘦素基因等影响正常肝脏组织向NAFLD发展,但因其往往作用的环节单一,未模拟出NAFLD发展的缺陷,从而在研究NAFLD的病理生理机制上有所限制[3]。在饮食诱导的小鼠模型中,高脂饮食诱导模型最为经典,此类模型不仅可以诱导NAFLD的形成,而且可以导致小鼠超重、出现胰岛素抵抗,与人类NAFLD的临床表现相类似。蛋氨酸-胆碱缺乏饮食(methionine-choline-deficient diet,MCDD)诱导的小鼠模型是获得性脂肪酸β-氧化减少小鼠模型的代表,它的作用机制在于减少了脂蛋白的合成,造成了甘油三酯(triglycerides,TG)在肝脏细胞的沉积,并且损伤了抗氧化屏障机制导致了氧化应激的增加[4],在NAFL和NASH发生和发展的多个环节都产生作用。本研究选择了MCDD诱导小鼠建立NAFL动物模型并进行动态观察,为研究NAFLD发病机制提供支持。
1 材料与方法
1.1 材料 24只SPF级8周龄、雄性C57BL/6小鼠,由北京科宇动物养殖中心公司提供,生产许可证号:SCXK(京)2018-0010;实验动物使用许可证号:No.1103202011000301。实验动物的饲养在SPF级实验室中完成,所有操作均符合无菌原则。试验性喂养1周后称量小鼠体重均为20 g。
C-800全自动生化分析仪(美国Beckman公司)、可调式加样器1000/100/10 μL(德国Eppendorf公司)、MULTIFUGE 3SR+台式离心机(美国ThermoFisher Scientific公司)、电子天平(湘平ES-100K)、倒置显微镜(日本Olympus公司);辐照蛋氨酸-胆碱缺乏小鼠饲料。
1.2 研究方法 24只小鼠随机分为观察组(n=12)和对照组(n=12)。观察组小鼠给予MCDD,对照组小鼠普通喂养饲料正常饮食,剂量根据小鼠体重分别剂量为12 g/(只·天)。均给予自由饮水、运动。在给予饲料后,每天观察动物进食、饮水、行为、活动、精神状态、毛发及二便等情况。
分别于实验第8、15、22天各随机抽取观察组和对照组4只小鼠,处死后采集标本。取得小鼠肝脏制作石蜡切片、进行苏木精-伊红染色,对取得的小鼠肝脏组织苏木精-伊红染色切片置于光镜下观察,并根据2005年NASH临床研究网络病理委员会设计的NAFLD疾病谱组织学评分系统非酒精性脂肪性肝病活动度评分(non-alcoholic fatty liver disease active score,NAS)标准[5]对小鼠肝脏病理切片阅读,进行评分、记录。其中NAS≥5分者可明确NASH的诊断,NAS≤3分则可排除NASH,两者之间者为NASH可能。
摘取小鼠眼球后采集新鲜静脉血标本,留置于抗凝标本管内,静置1 h,按2 500 r/min转速离心,离心后取上层清亮血清标本。测定所取得小鼠血清中的丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、TG的水平。

2 结果
2.1 小鼠一般情况 2组小鼠均未出现死亡,与对照组相比,观察组小鼠的毛发紊乱、无光泽,体重明显减轻,活动减弱,精神萎靡,进食量较正常小鼠减少,大便性状明显干结。
2.2 小鼠体重变化情况 通过对观察组小鼠体重均数的观察,MCDD小鼠体重呈下降趋势,从第8天开始与起始体重(20 g)差异比较具有统计学意义(P<0.05),提示第8天是小鼠体重明显变化的时间节点(表1);从实验观察的第8天起,MCDD小鼠与对照组小鼠的体重差异比较具有统计学意义(P<0.05,表2)。
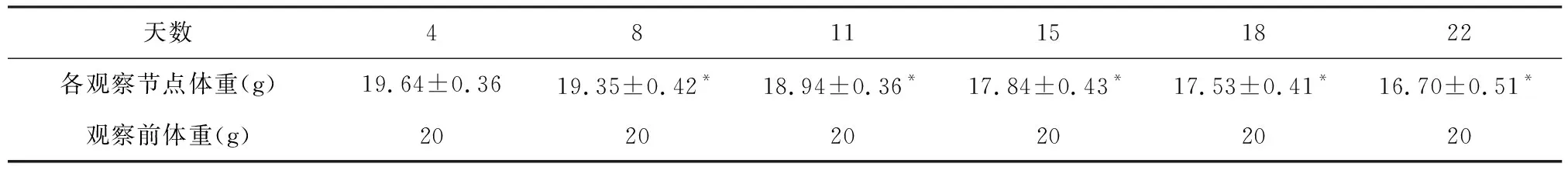
表1 观察组小鼠不同时间点与初始体重比较
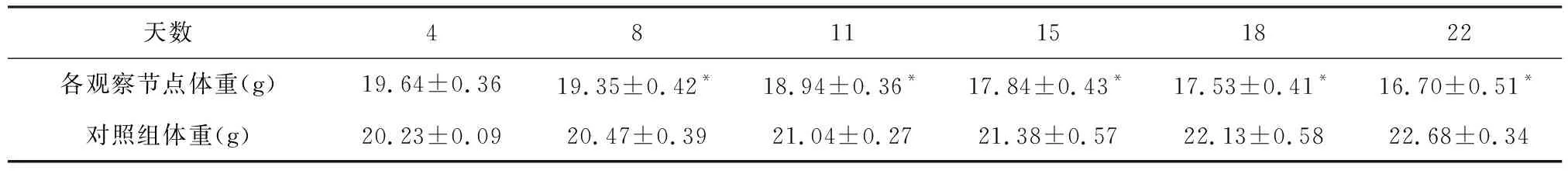
表2 观察组与对照组各观察时间节点体重比较
2.3 肝脏大体情况和观察组小鼠肝脏组织病理学评分
2.3.1 肝脏大体情况 分别于第8、15、22天处死观察组小鼠及对照组小鼠。通过对新鲜肝脏样本观察可以得出,观察组小鼠肝脏从第8天开始逐渐色泽加深、边缘变钝,整体呈肿胀表现,而对照组小鼠至第22天均未出现上述表现。
2.3.2 观察组小鼠肝脏组织病理学评分 观察组小鼠肝脏组织切片镜下观察可见:肝小叶内含脂滴细胞数明显增加,脂滴弥漫浸润,体积增大明显、有空泡样表现,部分肿胀呈圆,汇管区及小叶间可见炎细胞浸润。对3次观察组小鼠的肝脏病理切片进行组织学评分,表3。
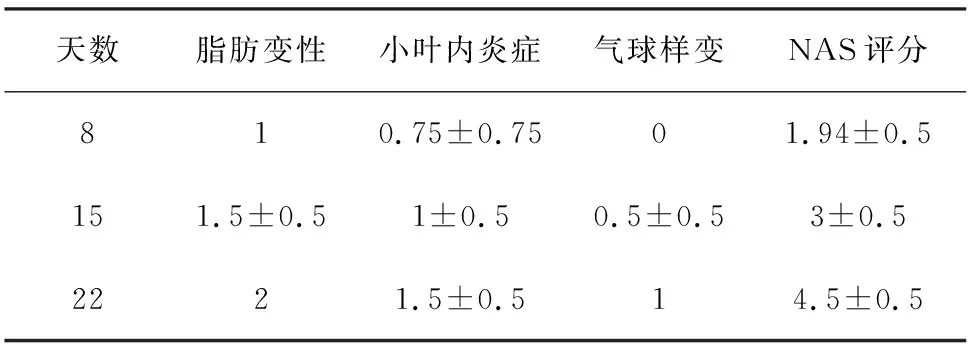
表3 观察组小鼠肝脏组织病理学NAS评分
观察组小鼠肝脏组织大体和苏木精-伊红染色切片均可见明确的肝脏脂肪性变的特点,染色切片中从第8天起即可观察到明显肝脏脂肪变性。而在针对肝细胞是否发生明确炎症的NAS评分中可发现,随着时间的推移,NAS评分逐渐增高,而对照组小鼠至22天进行肝脏病理检查均未见上述3种病变发生,评分均为0,提示了显著的差异。至第15天观察组小鼠NAS评分仍低于4分,且与第8天处死的小鼠NAS评分进行比较差异并无统计学意义(t=0.294,P>0.05),而第22天处死小鼠的NAS评分和第8、15天差异比较均有统计学意义(t=2.601,P=0.04;t=3.57,P=0.019)。
2.4 小鼠血清中ALT、AST和TG的水平测定情况观察组小鼠血清中ALT、AST水平较对照组有所上升,但差异比较并无统计学意义;随造模时间的延长,均数呈上升趋势,但在各时间节点的差异比较并无统计学意义。TG的水平也随时间变化呈现增长趋势,且各时间节点均与对照组差异比较具有统计学意义(t=2.35,P=0.017;t=2.491,P=0.013;t=1.99,P=0.033),第22天与第8天差异比较具有统计学意义(t=3.29,P=0.023),第15天则与第8天比较差异无统计学意义(t=0.366,P=0.373)。表4。
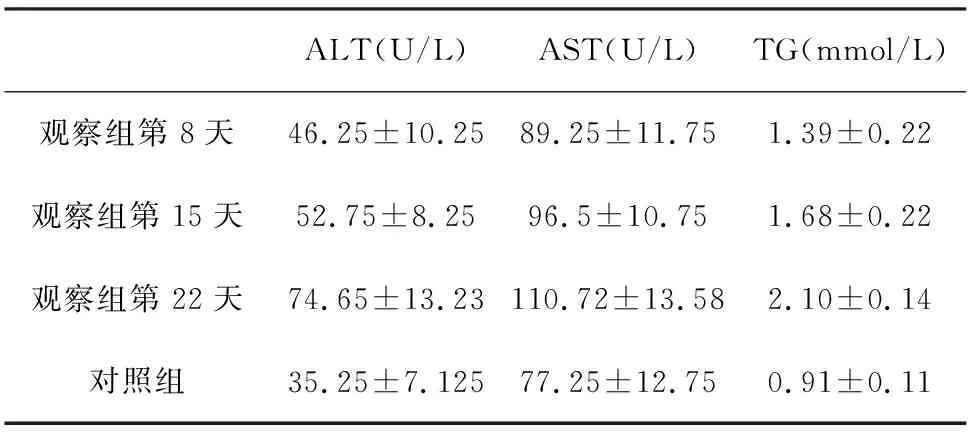
表4 小鼠血清中ALT、AST以及TG的水平测定结果
对所检测的ALT和病理学评分进行了Pearson相关性分析,得出相关系数为0.574(P=0.032),肝酶的升高与病理学评分呈正相关关系,但关系强度一般。
3 讨论
NAFLD是一种以肝脏脂肪蓄积过多为特征的慢性肝脏疾病,其肝脏的病理表现与酒精性脂肪性肝病(alcoholic fatty liver disease,AFLD)类似,但因其发病人群无显著乙醇摄入而认为与AFLD的致病机制及危险因素均不相同[5]。此种疾病的患病率在欧洲、北美等发达地区一直居高不下,在我国发病率有逐年上升的态势,在北京、上海等发达富裕地区患病率已经高达15%[6],成为了仅次于慢性病毒性肝炎的第2位的慢性肝脏疾病。作为NAFLD发病的初期,超声和核磁对NAFL的敏感性并不强(脂肪浸润程度>33%才可出现阳性表现)[7],NAFL治疗目前也无显著推荐药物,无论是诊断还是治疗都存在不足之处。因此,研究NAFL的动物模型对于研究此类病变程度的NAFLD具有重要意义。
MCDD是指在喂养饲料中选择性的不含有蛋氨酸及胆碱,一般认为2~4周的时间即可诱导小鼠产生脂肪性变甚至是NASH,并可继续发生纤维性病变[8]。它诱导模型动物出现NAFLD的机制在于:①蛋氨酸是一种必须氨基酸,其提供的甲基用于形成胆碱,当缺少胆碱时,肝脏合成磷脂减少,不能有效地合成脂蛋白尤其是极低密度脂蛋白,从而使TG运出肝脏受阻、沉积在肝脏内,形成脂肪肝;②胆碱的减少会使得细胞膜中的卵磷脂会被代谢以提供胆碱,引起肝细胞膜损伤;③蛋氨酸、胆碱缺乏引起肝脏内严重缺乏抗氧化物,MCDD使抗氧化屏障机制受损并增加氧应激[9];④氧应激还可以导致TNF-α等多种炎性因子激活[10],并可激活IκKβ通道活化NF-κB,而NF-κB又是可以诱导TNF-α的转录因子,从而形成TNF-α—IκKβ通道循环,导致炎症呈持续性发展;⑤CYP2E1上调引起自由基、超氧阴离子等的产生,导致肝脏细胞炎症的发生[11],自由基的大量形成可造成肝细胞膜等多部位和成分的广泛损伤和肝纤维化。
本研究在通过MCDD诱导小鼠模型建立的过程中,把时间节点控制在每周处死小鼠进行病理学观察,并根据2005年制定的NAS病理评分标准进行评分,得出结论是从第1周即出现了肝细胞的脂肪性变(评分>0分),至第3周末可见小叶内炎症、少量气球样变,但根据评分细则仍<5分,并且评分与第1周末未出现统计学差异,提示在第2周时间节点前小鼠的NAFLD病变发展程度控制在单纯性脂肪性病变的水平。
本研究中尽管在每个时间节点的模型小鼠ALT、AST的均值均高于正常,并且表现出了随时间延长呈上升趋势,但和正常组小鼠比较差异无统计学意义,各时间节点的ALT、AST水平比较差异无统计学意义。ALT与病理评分的相关性分析表明ALT升高的程度和病理等级评分之间的相关性存在但并不密切,证实了把ALT的异常升高作为观察NAFLD是否进展至NASH的做法是不完善的。有研究表明在ALT升高的NAFLD患者中出现炎症、肝硬化的可能要高于ALT正常者,但发生进展期肝纤维化的可能是无差异的,并非所有的ALT正常的NAFLD患者都不会出现NASH、乃至肝硬化的可能[12]。
MCDD诱导的动物模型也存在以下不足之处:与多数NAFLD患者情况不同,诱导的动物模型大都出现体重下降,没有肥胖的存在;胰岛素抵抗不明显[13],部分动物实验表明MCDD诱导的动物胰岛素敏感性甚至出现增强的表现[14];诱导形成NASH所用时间较短,和一般NAFLD从单纯脂肪性病变过度到NASH需要较长时间的病理过程不完全符合;所需饲料为精确不含蛋氨酸及胆碱,配置难度较大,造模成本较高脂饮食高。

