常见食品及调味品中嘌呤类组分含量分析及分布规律
丁玉庭,张静,周绪霞,赵培城
1(浙江工业大学 食品科学与工程学院,浙江 杭州,310014)2(国家远洋水产品加工技术研发分中心(杭州),浙江 杭州,310014)
嘌呤是由1个嘧啶环和1个咪唑环稠和而成的一种生物碱类物质,以嘌呤核苷酸形式参与人体代谢,起到能量供应、组成辅酶等重要作用。嘌呤在人体内经过一系列代谢变化后,最终生成尿酸,而尿酸合成增加或排除减少会引发高尿酸血症[1]。食物摄入是嘌呤的主要来源之一,CHOI等[2]研究发现,较高的肉类和海鲜消费量与较高的血清尿酸水平有关;OMOLE等[3]研究表明,高尿酸血症极有可能会引起痛风,对心血管疾病产生不良影响,因此健康的生活方式和饮食结构对缓解痛风和高尿酸血症有重要作用[4]。在日本,高尿酸血症患者每日嘌呤摄入量限制为400 mg[5];急性和慢性痛风患者每天嘌呤摄入量应控制在150 mg以下[6]。对中国居民每日膳食嘌呤平均摄入量的评估表明,标准人(18 岁轻体力活动男子)每日摄入嘌呤总量呈逐年增加趋势,2002年每人每日年达到319 mg,尤其是动物性食物的嘌呤摄入量逐年增加[7]。可见,我国现代饮食习惯中嘌呤含量较高的食品逐渐占主体地位,让人们了解各类食品的嘌呤含量数据极为重要。但是当前嘌呤含量的数据尚不完善且相差较大,现有的各项数据来源不可靠[8],且检测方法不一致;特别是调味品中嘌呤含量数据十分匮乏,近年来,调味品市场销量不断创新高,而高尿酸血症发病率不断升高[9]。
本文拟建立一种基于反相高效液相色谱(reversed-phase high performance liquid chromatography,RP-HPLC)能够准确检测常见代表性食品以及调味品中嘌呤类组分及其含量的方法,并通过该方法对代表性食品,包括水产品、畜禽肉类、豆制品、食用菌、水果以及调味品中嘌呤类物质的组成及其含量进行检测,并对其含量规律进行分析,为居民饮食结构的合理安排提供理论依据和参考建议。
1 材料与方法
1.1 材料与仪器
鸡肉、鸭肉、五花肉、牛肉、羊肉、猪肝等畜禽肉类,草鱼、鲫鱼、扇贝等水产品,大豆、豆腐等豆制品,香菇等食用菌,海底捞酱、海鲜酱、沙茶酱、鸡鲜调味料、鸡精、牛肉酱、炖肉料、浓汤宝、黄豆酱、番茄酱等各类调味品以及新鲜蔬菜、水果,均购自大型超市。
腺嘌呤(纯度≥99.5%)、鸟嘌呤(纯度≥99.0%)、黄嘌呤(纯度≥99.5%)、次黄嘌呤(纯度≥99.0%),Aladdin公司;5′-肌苷酸二钠(disodium 5′-inosinate,IMP)、5′-鸟苷酸二钠(disodium 5′-guanosine monophosphate,GMP)(食品级),希杰(聊城)生物科技有限公司;KH2PO4、H3PO4、KOH、NaOH、高氯酸等均为分析纯,上海凌峰化学试剂有限公司;甲醇(色谱纯),德国 MERCK 公司。
E2695型高效液相色谱仪,美国Waters公司;RE-2000A型真空旋转蒸发仪,上海亚荣生化仪器厂;Allegra 64R高速台式冷冻离心机,美国Beckman Coulter有限公司;PHS-3C型数显酸度计,上海精科仪器有限公司。
1.2 实验方法
1.2.1 嘌呤标准溶液的制备
分别准确称取4种嘌呤标准品各0.100 g,加入5 mL 0.1 mol/L NaOH溶液,促进溶解,再用超纯水定容至1 000 mL,配制成0.1 g/L嘌呤标准溶液,放入4 ℃冰箱保存。
1.2.2 样品前处理
采用王静莹等[10]的酸水解法,并作适当调整。每份样品制备3份平行样:将食品、调味品等样品磨碎,称取200.00 mg放入20 mL具塞试管,加入体积分数10%高氯酸3 mL,置于沸水浴中水解60 min,取出后迅速冰浴冷却。水解液用1 mol/L KOH溶液调节pH至3.8,定容至5.0 mL,3 000 r/min离心30 min,取上清液用0.45 μm滤膜过滤后置于4 ℃冰箱保存待用。
1.2.3 嘌呤类组分检测方法优化
采用RP-HPLC的方法测定嘌呤类组分含量。由于流动相pH对检测结果影响较大,本实验分别设定pH为3.6、3.8、4.0的0.02 mol/LKH2PO4缓冲液作为流动相进行对比试验,以得到优化的HPLC测定条件。采用色谱柱:Agilent XDB-C18柱(4.6 mm×250 mm,5.0 μm);流速1.0 mL/min;柱温25 ℃;进样量20 μL;紫外波长254 nm。
2 结果与分析
2.1 嘌呤类物质HPLC检测方法优化
2.1.1 HPLC检测条件优化
通过RP-HPLC法检测嘌呤类组分含量时,Agilent XDB-C18柱可直接进样分析水溶性嘌呤样品,而选择254 nm作为紫外波长,是因为4种嘌呤都存在共轭双键,在紫外区220~300 nm区间内存在较强的吸收峰。另外,流动相pH值对嘌呤的分离影响最大。刘桂英等[11-12]用HPLC法测定不同豆类、食用菌类的嘌呤含量,选用pH 4.0的0.007 mol/L KH2PO4缓冲液为流动相;凌云等[13]通过HPLC法检测肉类食品中嘌呤含量时,分别采用了pH 3.62和pH 3.8的0.02 mol/L KH2PO4缓冲液作为流动相;曲欣[14]对比了0.02 mol/L KH2PO4缓冲液作为流动相,pH分别为3.6、3.8、4.0时的液相色谱图。本实验采用0.02 mol/L KH2PO4缓冲液作为流动相,对比pH分别为3.6、3.8、4.0时嘌呤混标的分离情况,最终选择pH 3.8的缓冲液作为流动相,如图1所示,得到了分离效果较好的4种嘌呤独立的峰,出峰顺序依次为鸟嘌呤、次黄嘌呤、黄嘌呤、腺嘌呤。

1-鸟嘌呤 2-次黄嘌呤 3-黄嘌呤 4-腺嘌呤(下同);流动相pH为3.8图1 四种嘌呤标准品HPLC图Fig.1 HPLC chart of four kinds of purines standard solution
2.1.2 HPLC检测方法的线性范围与精密度
配制4种嘌呤混标溶液,依次按照质量浓度1、5、10、25、50、80、100 mg/L梯度进样,在1.2.3色谱条件下(流动相pH 3.8)分析测定,每个质量浓度设定3份平行样,将峰面积的平均值与嘌呤混标的质量浓度相对应,得到图谱如表1所示,计算得到线性回归方程。相关系数在0.999 6~0.999 8,相对标准偏差在0.97%~1.69%之间,以3倍信噪比(s/n=3)和10倍信噪比(s/n=10)得到方法的检出限和定量限分别为0.06~0.21 mg/L和0.25~0.72 mg/L。由数据可知,此方法精密度较高,重现性较好,实验结果可靠性较高。
2.1.3 HPLC检测方法的回收率研究
用猪肉样品进行加标回收测定回收率,样品中分别添加3个水平的嘌呤标液,每个样品设定6份平行样,计算回收率和相对标准偏差。实验结果如表2所示,回收率控制在79.85%~102.60%,在阈值范围内,能满足定量分析的要求。

表1 四种嘌呤标准品回归方程Table 1 Results of linear equation and linear relation

表2 加标回收试验结果Table 2 Results of recovery
2.2 代表性食品原料中嘌呤类组分测定及规律研究
将各类食品样品用1.2.2的方法进行处理,再按照优化的1.2.3的方法进样检测,得到常见代表性食品原料中嘌呤含量,结果分析如图2~图13所示。
2.2.1 水产品中嘌呤类组分含量
图2~图4为所测部分水产品中4种嘌呤组分含量的高效液相色谱图。可见,水产品中4种嘌呤分离度较好。

图2 草鱼嘌呤HPLC图Fig.2 HPLC chart of four kinds of purines in grass carp
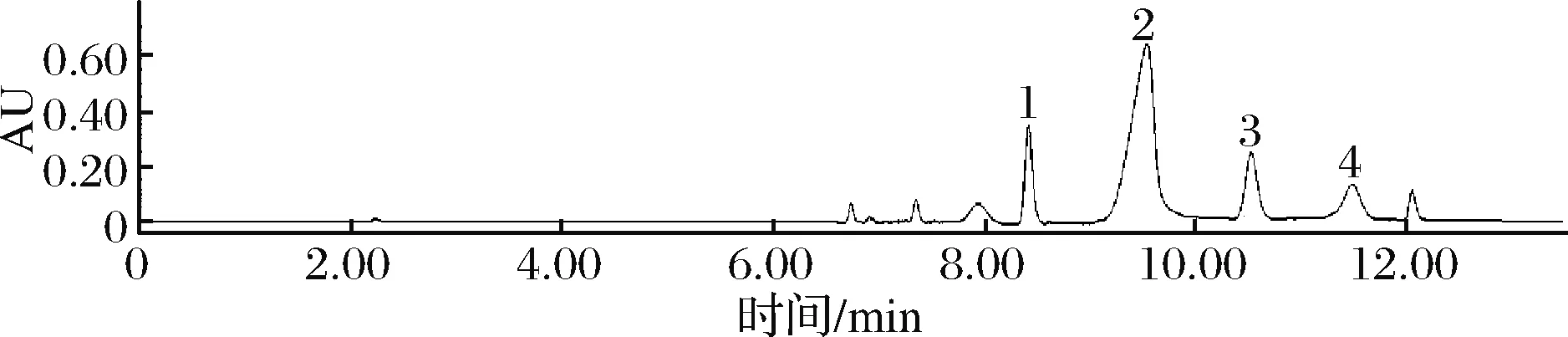
图3 海虾嘌呤HPLC图Fig.3 HPLC chart of four kinds of purines in sea shrimp

图4 蛏子嘌呤HPLC图Fig.4 HPLC chart of four kinds of purines in razor clam
所测水产品中各嘌呤组分含量对比如图5所示,水产品中总嘌呤含量在147.46~433.15 mg/100 g,属于高嘌呤食物;不同种类水产品其嘌呤组分差异较大,草鱼、鲫鱼等总嘌呤含量分布在147.46~168.12 mg/100 g,且次黄嘌呤的含量占总嘌呤的60%以上,这与潘洪志等[15]和KANEKO等[5]研究结果一致。花蛤、扇贝等贝类中总嘌呤含量在160.36~288.85 mg/100 g,腺嘌呤含量较高,可占总嘌呤含量的34.04%~83.96%;海虾的总嘌呤含量大于400 mg/100 g,且显著高于鱼类和贝类。

图5 水产品中各嘌呤组分含量Fig.5 Content of purines in aquatic products
2.2.2 畜禽肉类中嘌呤类组分含量
图6~图8为所测部分畜禽肉类中4种嘌呤组分含量的高效液相色谱图。大部分畜禽肉类的4种嘌呤均能较好地分离。
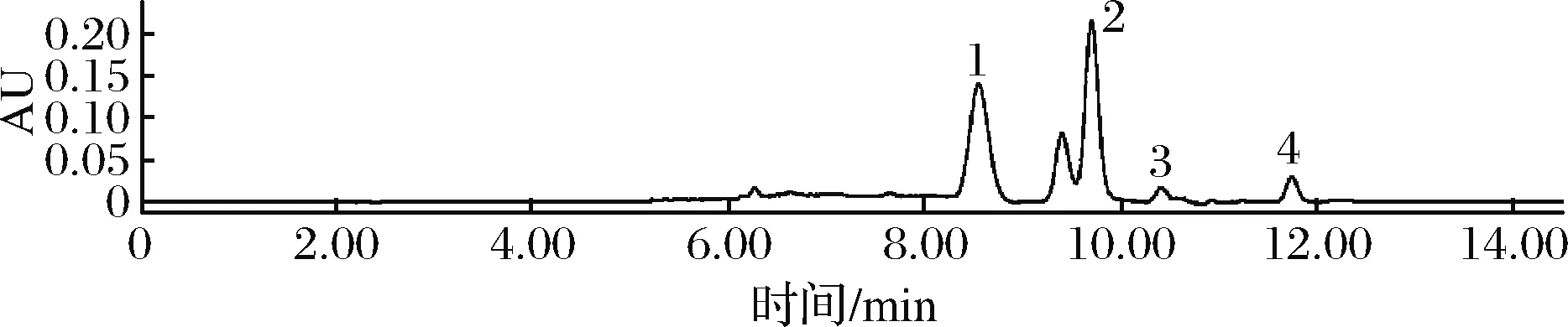
图6 鸭肉嘌呤HPLC图Fig.6 HPLC chart of four kinds of purines in duck

图7 猪肉嘌呤HPLC图Fig.7 HPLC chart of four kinds of purines in pork

图8 猪肝嘌呤HPLC图Fig.8 HPLC chart of four kinds of purines in pork liver
由图9可知,畜禽肉类总嘌呤含量在106.09~286.06 mg/100 g,大部分属于中等嘌呤食物,其中内脏猪肝的嘌呤组含量显著高肉种嘌呤组含量,嘌呤组分中以次黄嘌呤含量最多,占总嘌呤的52.05%~70.20%,而黄嘌呤含量最少。这与杨海斌[16]研究结果一致。猪肝中总嘌呤含量达到286.06 mg/100 g,次黄嘌呤占总嘌呤的53.55%,这与潘洪志等[15]检测发现动物内脏嘌呤含量高于其他食品,肉和肉制品中嘌呤含量低于水产品的观点吻合。在不同畜肉类中,猪肉的总嘌呤含量为125.51 mg/100 g,牛羊肉分别为106.09、107.92 mg/100 g,猪肉高于牛羊肉,而牛羊肉之间差别不大。鸡鸭肉嘌呤含量较杨海斌[16]实验结果测得的低,猪肉嘌呤含量较凌云等[13]测得的结果要高,这可能与不同品种、不同部位、不同生长期和不同饲养方式有关。ZHENG等[17]研究发现,纯种猪肉的总嘌呤含量较低,低嘌呤饲料喂养也会影响猪肉中的嘌呤含量,且猪肉肌内脂肪与嘌呤含量呈负相关。

图9 畜禽肉类中各嘌呤组分含量Fig.9 Content of purines in livestock and poultry meat
2.2.3 植物性食品中嘌呤类组分含量
图10~图12为植物性食品中4种嘌呤组分含量的高效液相色谱图。

图10 大豆嘌呤HPLC图Fig.10 HPLC chart of four kinds of purines in soybean
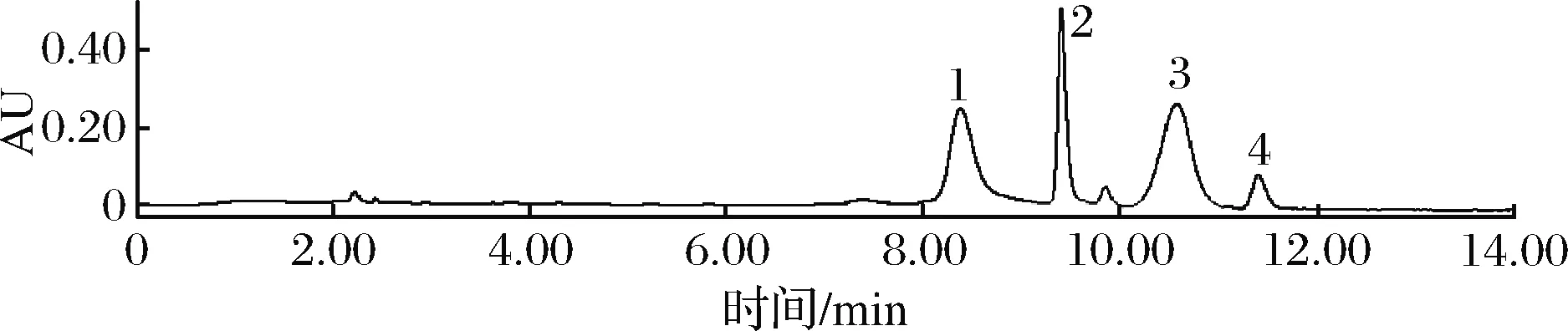
图11 干香菇嘌呤HPLC图Fig.11 HPLC chart of four kinds of purines in dry mushrooms
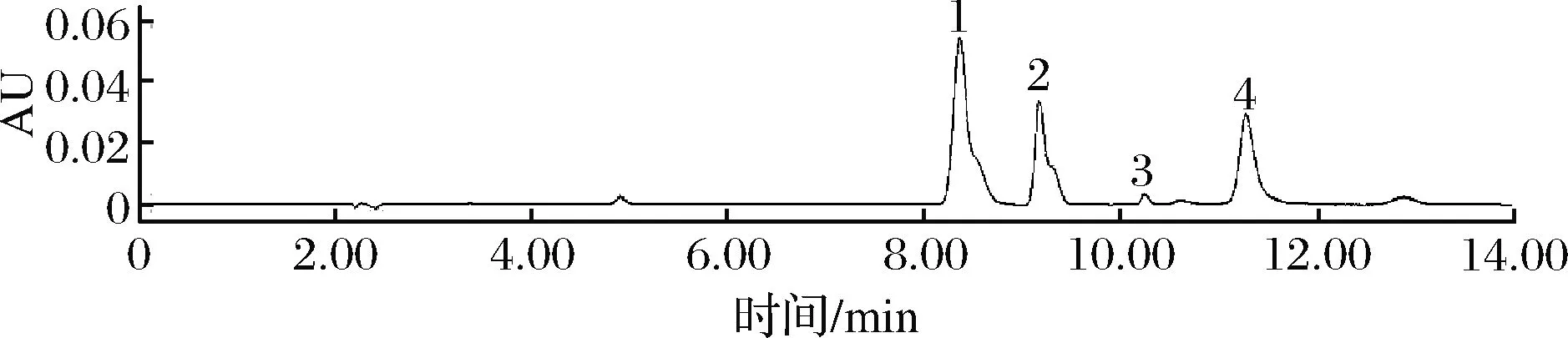
图12 鲜香菇嘌呤HPLC图Fig.12 HPLC chart of four kinds of purines in freshmushrooms
植物性食品中嘌呤含量普遍低于动物性食物,且不同种类植物性食品相差较大。刘桂英等[12]发现不同菌类嘌呤含量相差较大,在39.27~323.77 mg/100 g不等。毛玉涛等[18]发现植物性食物嘌呤含量较低,尤其常见蔬菜的嘌呤含量都很低。由图13可知,豆腐、新鲜食用菌、蔬菜、水果的嘌呤含量均较低,而豆类、干制食用菌中嘌呤含量较高,超过150 mg/100 g,但因其干物质含量高,故不能被列为高嘌呤食物;在植物性食品的嘌呤组分中,腺嘌呤和鸟嘌呤含量较高,占总嘌呤含量60%以上,而次黄嘌呤含量较低。

图13 植物性食品中各嘌呤组分含量Fig.13 Content of purines in plant food
2.3 典型调味品中嘌呤类组分及其分布规律研究
2.3.1 典型调味品中嘌呤含量及分布规律
基于现代饮食中人们对食品风味追求的不断强化,调味料已成为人们热衷的烹饪助手,其中,5′-肌苷酸二钠和5′-鸟苷酸二钠(I+G)各50%混合物更是食品增鲜的必备添加剂,已在各类调味食品中广泛使用。由于核苷酸在体内可代谢生成次黄嘌呤和鸟嘌呤,因此,会增加人体的嘌呤摄入量。图14~图16为部分调味料中嘌呤类组分的液相色谱图。
图14 鸡鲜调味料嘌呤HPLC图Fig.14 HPLC chart of four kinds of purines in fresh chickenseasoning
图15 鸡精嘌呤HPLC图Fig.15 HPLC chart of four kinds of purines in chickenessence

图16 浓汤宝嘌呤HPLC图Fig.16 HPLC chart of four kinds of purines in condensed soup
图17为市售10种典型调味品的嘌呤组分及其含量。
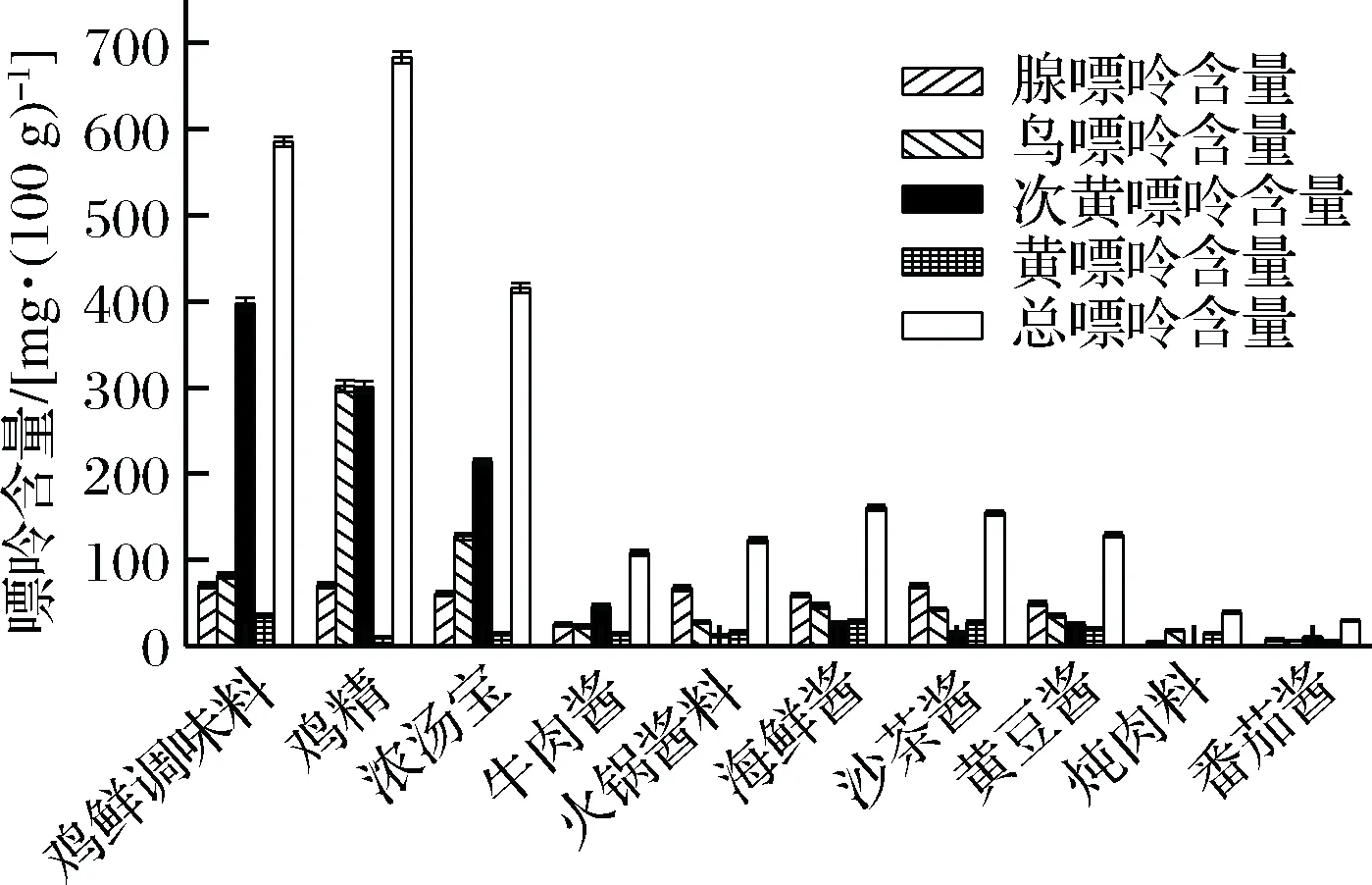
图17 调味品中各嘌呤组分含量Fig.17 Content of purines in condiments
结果表明,调味品的嘌呤含量普遍较高,尤以水分含量低的鸡精和鸡鲜粉基类调味品的嘌呤含量居高,总嘌呤含量大于500 mg/100 g,这与张萍等[19]的研究结果一致;在酱类调味品中,牛肉酱等的总嘌呤含量在100 mg/100 g左右,以次黄嘌呤为主,约占总嘌呤的42%,属于中等嘌呤食物;海鲜酱和沙茶酱中的总嘌呤含量大于150 mg/100 g,以腺嘌呤为多,占总嘌呤的45%以上;发酵黄豆酱中总嘌呤含量约为120 mg/100 g,介于牛肉酱和海鲜酱之间。另外,炖肉料、番茄酱的嘌呤含量低于50 mg/100 g,炖肉料的原材料主要以砂仁、肉寇、茴香、肉桂、陈皮、山楂等植物类香辛料为主,番茄酱的主要原材料为番茄,所以这类调味品的嘌呤含量普遍较低。
2.3.2 调味品I+G中嘌呤含量及分布规律
鸡精和鸡鲜调味料是继超鲜味精后广泛流行使用的复合调味品,属特高嘌呤类食品辅料,表3为市售3种品牌的鸡精和鸡鲜调味料的嘌呤组分含量比较。

表3 富I+G呈味核苷酸的调味品中嘌呤组分比较 单位:mg/100 g
由表3可知,I+G增鲜剂的组成仅是次黄嘌呤和鸟嘌呤,IMP的呈味特征为鸡肉鲜味,鲜度约为味精的40倍;GMP的呈味特征为鲜菇鲜味,鲜度约为味精的160倍。在3种品牌的鸡精和鸡鲜调味料中,除了次黄嘌呤和鸟嘌呤外,尚含9%~18%的腺嘌呤和黄嘌呤成分,这是由于鸡精和鸡鲜调味料中强化添加了I+G和酵母抽提物等呈味核苷酸类物质,导致鸟嘌呤和次黄嘌呤含量偏高的缘故。在高嘌呤组分中,次黄嘌呤已被证明对血清尿酸浓度影响均大于鸟嘌呤、腺嘌呤和黄嘌呤等3种嘌呤[5],因此大剂量添加调味料会使人体摄入更多次黄嘌呤成分,增加健康风险。
另外,尚需特别注意的是,未经热处理的生鲜食品由于存在降解呈味核苷酸二钠的磷酸酯酶,导致失去I+G的鲜味[20],因此,建议生鲜食品在加入调味品前需首先进行85 ℃以上热处理钝化酶以保障鲜美味,不然,既得不到相应的鲜美味,还会造成人体摄入更多的由磷酸酯酶分解产生的嘌呤物质。
3 结论
本文建立了基于RP-HPLC的食品中腺嘌呤、鸟嘌呤、黄嘌呤和次黄嘌呤的含量测定方法,并对典型食品及常见调味料的4种嘌呤成分含量及分布规律进行了分析研究。所检测食品中,总嘌呤含量由高到低依次为水产品>畜禽肉类>植物性食品,其中水产品中为147.46~433.15 mg/100 g,属于高嘌呤类食物;畜禽肉类中为106.09~286.06 mg/100 g,大部分属于中嘌呤类食物,而内脏猪肝的总嘌呤含量>280 mg/100 g;植物性食品总嘌呤含量大部分<50 mg/100 g,属于低嘌呤类食物。不同种类调味品中嘌呤组分差异较大,其中鸡精、鸡鲜调味料嘌呤含量高于500 mg/100 g。排除个体健康状况等因素影响,控制饮食中嘌呤的摄入是预防高尿酸血症的主要途径。因此,日常饮食应注意高嘌呤类物质的摄入,尤其要减少火锅、烧烤和饭店等重口味、高热量、高嘌呤的餐饮摄入,高尿酸血症患者更应控制水产品、肉类、动物内脏等高嘌呤食物的摄入量,通过饮食控制有效降低高尿酸血症和痛风的潜在健康风险。

