微囊化酿酒酵母FMS115的高密度培养
,3,*
(1.南京农业大学食品科技学院,江苏南京 210095;2.江苏省农业科学院农产品加工所,江苏南京 210014;3.上海海洋大学食品学院,上海 201306)
酿酒酵母(Saccharomycescerevisiae)是一种真核模式生物,在发酵、医药、食品和生物等领域均具有十分广泛的应用[1-3],因可以通过无氧呼吸将葡萄糖转化为酒精,且耐高渗性能良好,尤其广泛应用于发酵和酿造工业中[4],是人类最早利用的一类微生物。其营养成分十分丰富,含有菌体蛋白质、多种氨基酸、维生素、脂肪、食物纤维、矿物元素、微量元素等生理活性物质[5]。不仅活的酵母细胞可以发酵产酒精等香气物质,为人类提供各色各样的食品,死亡的酵母菌体内也因丰富的营养物质可用来做培养基等生物材料。在实际生产中,由于体积的限制和营养物质的消耗,酵母在培养一代左右即停止生长,因此解决酵母高密度培养的问题有助于实现以最少的投入获得最大的利益。
细胞高密度培养(high-cell density cultivation,HCDC)是指在一定的培养条件下,在不影响胞内产物积累的基础上,尽可能多地积累生物量[6]。常用的微生物高密度培养方法有恒定分批培养、补料流加培养、连续培养和细胞循环培养[7]。Eugene等[8]以补料分批培养的方式,采用合成培养基,获得了140 g/L的最大干细胞生物量。王颖等[9]优化的培养基和培养条件最终使酿酒酵母细胞密度提高了22.0%。目前许多研究主要集中在培养条件的优化,无法解决代谢产物的抑制,由于发酵产业规模扩大,传统菌体培养方式的缺陷凸显,解决代谢产物的抑制比解决菌体生长的营养需求更加迫切[10]。本文拟对培养基和培养条件进行优化,在条件优化的基础上,结合微胶囊技术和半连续补料培养方法,以解决产物的抑制作用,达到高密度培养的目的。
微胶囊是一种允许小分子营养物质自由进入和囊内代谢产物自由排出,同时阻止囊外生物大分子进入的物质,曾作为基因重组细胞的免疫隔离和运载工具[11-12]。早期研究是将海藻酸钠滴入氯化钙溶液中,形成海藻酸钙固芯含菌胶囊,这种胶囊密度高,菌体主要生长在空隙和表面,空间效应不佳,生长量不高[13-14]。液芯胶囊在物质运输方面更容易,细胞生长均匀,密度大[15],多用于乳酸菌的增殖培养[16]。酵母体积大,无氧呼吸产CO2,生长速度快,微胶囊易破裂,只能静置培养,微胶囊化酵母培养的研究甚少。因此,本实验拟将菌液与氯化钙混合滴入海藻酸钠溶液中,聚合形成液芯微胶囊,通过更换培养基,增加菌体密度。
酵母菌株FM-S-115发酵性能良好,耐糖性和耐酒精性强,是一株较为优质的酿酒酵母[17-18]。本实验在培养基YPDB基础上,将优化碳源及碳源含量、氮源及氮源含量四个因素;在培养条件上,将优化温度、菌液接种量和培养基初始pH三个因素,确定影响最显著的三个因素,设计正交试验得出最适培养条件,最后将合适海藻酸钠和氯化钙质量浓度下制得的微胶囊包裹酵母在最适条件下静置培养4代,达到高密度培养的目的,以期为酵母的高密度培养相关研究提供参考。
1 材料与方法
1.1 材料与仪器
酿酒酵母FM-S-115 保存于江苏省农业科学院农产品加工研究所食品生物工程研究室;马铃薯葡萄糖琼脂培养基(PDA):0.3%马铃薯浸粉、2.0%葡萄糖、1.4%琼脂;酵母浸出粉胨葡萄糖肉汤培养基(YPDB):1.0%蛋白胨、0.5%酵母浸出粉、2.0%葡萄糖;葡萄糖、蔗糖、果糖、麦芽糖、乳糖 分析纯,西陇科学股份有限公司;蛋白胨、胰蛋白胨、酪蛋白胨、酵母浸粉、牛肉膏 分析纯,北京奥博星生物技术有限责任公司;海藻酸钠、氯化钙、黄原胶、壳聚糖 食品级,南京松冠生物科技有限公司。
UV-1600PC紫外分光光度计 上海美普达仪器有限公司;SW-CJ-1C型双人单面净化工作台 苏州净化设备有限公司;TOMYSX500自动灭菌锅 日本Tomy Digital Biology公司;FE28pH计 梅特勒-托利多仪器(上海)有限公司;DHZ-DA冷冻恒温振荡器 苏州培英实验设备有限公司;JB-10磁力搅拌器 上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 菌种活化 将甘油管保存的菌种在无菌条件下接种到YPDB培养基中,28 ℃,150 r/min摇床培养;活化2~3代后作为菌液使用。
1.2.2 生长曲线测定 将预先活化好的菌液以3%的接种量接入YPDB培养基中,28 ℃,150 r/min摇床培养,培养时间为24 h。每隔2 h取一次样,三组平行试验,测定菌体的OD600,以时间为横坐标,OD值为纵坐标,绘制生长曲线。
1.2.3 单因素实验 分别优化碳源及含量、氮源及含量、温度、培养基pH和菌液接种量七个条件,每组实验3个平行。由于处理条件不同,培养液的颜色有差别,为了减小培养液颜色的误差,取1 mL菌液离心去上清液,加5 mL蒸馏水,测量稀释5 倍下OD600,以菌体稀释5倍下的OD600表示菌体密度,下同。
1.2.3.1 培养基优化 以YPDB为基础培养基,分别以乳糖、果糖、麦芽糖、葡萄糖和蔗糖取代碳源,含量2%,其余培养基成分不变,28 ℃,150 r/min,培养16 h,确定最适碳源;预实验中,将碳源含量持续增加至14%,菌株生长量持续增加,参考此结果,设置碳源含量为14%、16%、18%、20%以及培养基本身的碳源含量2%,优化碳源含量。以蛋白胨、胰蛋白胨、酪蛋白胨、酵母粉和牛肉膏取代培养基中的氮源,含量1%,其余培养基成分不变,28 ℃,150 r/min,培养16 h,确定最适氮源;设置最适氮源含量为0%、1%、3%、5%和7%,优化氮源含量。
1.2.3.2 培养条件优化 以YPDB为培养基,分别设置温度20、25、30、35 ℃,此时培养基初始pH6.7(pH自然),菌液接种量为3%,优化培养温度。设置培养液初始pH2.0、3.0、4.0、5.0、6.0和pH6.7(pH自然),此时温度为28 ℃,菌液接种量为3%,优化培养基初始pH。设置菌液接种量1%、3%、5%、7%、9%、11%,此时培养基初始pH6.7(pH自然),温度为28 ℃,优化菌液接种量。
1.2.4 正交试验 单因素实验结果得出,温度、培养液初始pH和碳源含量三个因素影响最显著,借助正交设计助手Ⅱ软件,采用三因素三水平L9(34)的正交设计实验,确定最适合菌株生长的条件。正交试验的因素和水平设计如表1所示。

表1 正交试验的因素水平Table 1 Factors and levels of orthogonal test
1.2.5 液芯微胶囊化酵母的制备
1.2.5.1 微胶囊制备 具体制备方法参考文献[19],略作修改。将培养至对数期的酵母菌悬液8000 r/min,离心3 min取菌体,将菌体加入到0.3%黄原胶和氯化钙的混合液中,混合均匀后,逐滴滴入匀速搅拌的海藻酸钠溶液中,立即收集预胶囊,用无菌水冲洗数次后,转入0.1%的壳聚糖溶液中成膜30 min,收集微胶囊,用无菌水彻底洗去残留的壳聚糖,即制备完成。
1.2.5.2 海藻酸钠质量浓度的确定 参考同类研究[20],配制质量浓度分别为0.8%、1.0%、1.2%和1.5%的海藻酸钠溶液,此时氯化钙质量浓度保持在7.0%,选择破囊率最小时的浓度为合适的海藻酸钠质量浓度。
1.2.5.3 氯化钙质量浓度的确定 配制质量浓度分别为3.0%、5.0%、7.0%和9.0%的氯化钙溶液,此时海藻酸钠质量浓度保持在1.2%,选择破囊率最小时的浓度为合适的氯化钙质量浓度。
1.2.5.4 破囊率的计算

式(1)
1.2.6 微囊化酵母高密度培养 将合适的海藻酸钠和氯化钙质量浓度下制得的微囊化酵母置于最适培养条件下静置培养,16 h后将胶囊过滤转移到无菌新鲜培养基中继续培养,取胶囊计活菌数,如此延续培养几代,直至胶囊中活菌数不再升高时即为培养结束。
1.2.7 活菌总数的测定 培养基菌液活菌计数:用无菌生理盐水梯度稀释菌液,选择10-4、10-5和10-6三个稀释度的菌悬液100 μL于无菌培养皿中,再及时倒入融化且冷却至45 ℃左右的YPDB培养基,立即充分摇匀,30 ℃条件下,培养24 h后菌落计数,将各平板中计得的菌落数的平均值换成单位容积的含菌量,再乘以相应的稀释倍数,得出每毫升菌液的活菌数[22],即菌体密度,单位为CFU/mL。
囊内活菌计数:取培养结束的完整胶囊,微胶囊与破囊液1∶10摇晃至完全破碎,用无菌生理盐水梯度稀释,以下操作步骤同菌液活菌计数,单位为CFU/g。
破囊液[23]的制备方法:由0.20 mol/L NaHCO3和0.06 mol/L Na3C6H507·2H2O混合而成。
1.3 数据分析
实验中的数据均为三组重复,用SAS V8分析显著性差异,正交设计助手Ⅱ设计正交试验,Origin 8.5绘制图表。
2 结果与分析
2.1 酿酒酵母FM-S-115的生长曲线
酿酒酵母FM-S-115以YPDB为培养基,30 ℃,150 r/min培养24 h,其生长情况见图1。由图1可知,前8 h增长速度快,细胞活力高。在8~16 h内,增长速度降低,菌体密度逐步趋于稳定。16 h时菌体密度达到最高且不再增加,进入平稳期。对比窦冰然等[24]得出的面包酵母的生长曲线在24 h之后达到平稳期,此株酿酒酵母生长时间更短,在实际生产中优势明显。考虑到稳定期内菌体互相竞争导致活性下降,选择16 h为最佳培养时间。
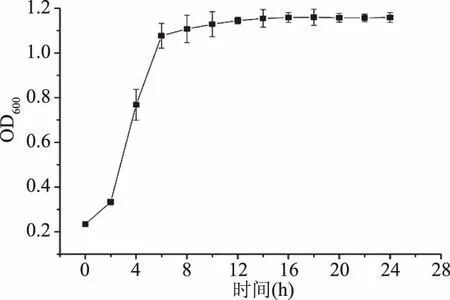
图1 菌株FM-S-115的生长曲线Fig.1 Growth curve of FM-S-115
2.2 培养基和培养条件优化
2.2.1 碳源种类对菌株FM-S-115生长量的影响 以乳糖、果糖、麦芽糖、葡萄糖和蔗糖作为培养基碳源,考察不同碳源对菌体的生长情况的影响,结果见图2。可以看出,蔗糖和果糖均是优质的碳源,其中蔗糖的利用率最高(OD600=1.115)且差异显著(P<0.05),其次是葡萄糖和麦芽糖,与朱作华等[25]对耐高温、耐高糖的酒精酵母的条件优化中得出的实验结果相同,实验中选择蔗糖为最适碳源。
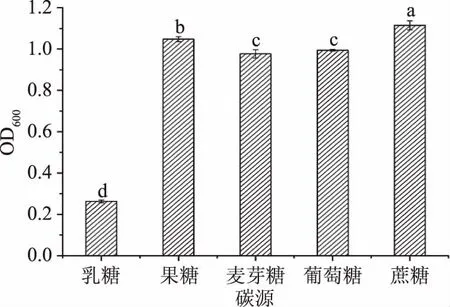
图2 碳源种类对菌株FM-S-115生长量的影响Fig.2 Effect of carbon source on growth of FM-S-115注:图中不同小写字母表示差异显著(P<0.05),图3~图10同。
2.2.2 碳源含量对菌株FM-S-115生长量的影响 为考察菌株FM-S-115对碳源含量的耐受性,改变蔗糖含量为2%、14%、16%、18%和20%,结果如图3。由图3可知,蔗糖含量2%~20%的范围内,OD值先升高后趋于平稳,在16%时最高,达到1.843,比2%蔗糖添加量对应的OD值1.142提高了40%,对比李飞龙等[26]研究得出的布拉氏酵母的最适葡萄糖含量在0.5 g/L的结果来说,此株酵母更耐糖且嗜糖。随着蔗糖含量继续增加,菌体密度呈现下降的趋势,原因可能是细胞膜内外渗透压不平衡,抑制了细胞的生长。考虑到生产中碳源含量过高还会加速菌体生长,过早到达稳定期,不利于生产发酵,经方差分析蔗糖含量在16%、18%和20%下的结果无显著性差异(P>0.05)的情况下,选择16%为FM-S-115最适碳源含量。
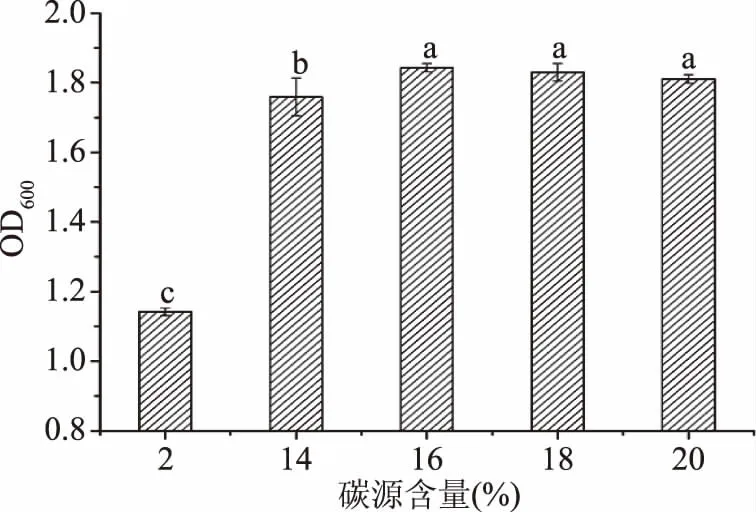
图3 碳源含量对菌株FM-S-115生长量的影响Fig.3 Effect of carbon source contenton growth of FM-S-115
2.2.3 氮源种类对菌株FM-S-115生长量的影响 为考察不同氮源对酵母FM-S-115生长量的影响,选择了蛋白胨、胰蛋白胨、酪蛋白胨、酵母粉和牛肉膏五种常见的有机氮源取代YPDB中的氮源培养酵母,结果见图4。可以看出,酵母FM-S-115对五种氮源均有较高的利用率,尤其是蛋白胨、胰蛋白胨、酪蛋白胨和酵母粉,稀释五倍下的OD值均大于1.1,且无显著性差异(P>0.05),由于蛋白胨最为便宜易得,选为最适氮源。

图4 氮源种类对菌株FM-S-115生长量的影响Fig.4 Effect of nitrogen sourceon growth of FM-S-115
2.2.4 氮源含量对菌株FM-S-115生长量的影响 上述实验得出最适氮源是蛋白胨,以YPDB为培养基,改变蛋白胨的含量为0%、1%、3%、5%和7%,观察不同的蛋白胨含量对菌体生长的影响,结果见图5。可以看出,蛋白胨含量对菌体OD值的影响表现为先升高后减少,1%时OD值最大为1.057,浓度继续增大OD值明显降低,原因在于不适宜的氮源含量对菌体的生长和产物的表达合成都可能产生负面影响[27]。考虑到实际发酵中会影响产物的合成,选择1%为最适氮源含量。
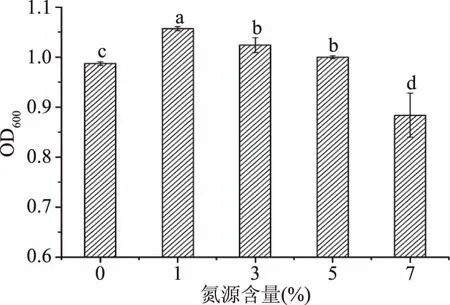
图5 氮源含量对菌株FM-S-115生长量的影响Fig.5 Effect of nitrogen source contenton growth of FM-S-115
2.2.5 温度对菌株FM-S-115生长量的影响 通过考察20、25、30、35 ℃四个温度下菌株的长势,选择合适的发酵温度,结果见图6。由图6可知,当培养温度逐渐提高时,菌体的生长量先增加后降低,在30 ℃时达到最高,与赵小丽等[28]对酿酒酵母的高密度培养条件优化得出的最适培养温度在30 ℃的研究结果一致。分析可知温度的提高会加速细胞代谢,从而加速菌体生长,但是过高会降低酶活性,因此温度高于30 ℃时,菌体密度逐渐降低。故实验中选择30 ℃为最适培养温度。
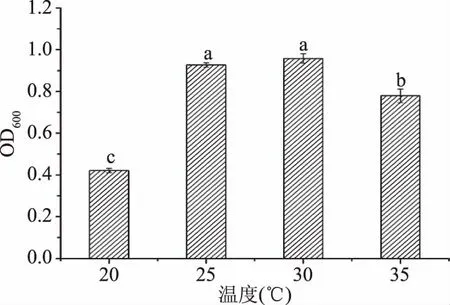
图6 温度对菌株FM-S-115生长量的影响Fig.6 Effect of temperature on growth of FM-S-115
2.2.6 培养液初始pH对菌株FM-S-115生长量的影响 菌株在培养基pH2~6.7范围内的生长情况结果见图7。如图7所示,pH2.0~4.0时,酵母的生长量随之增加,pH4.0时达到最高(OD600=0.941),大于4.0时对菌体的生长显示出抑制作用,原因在于不适宜的pH环境影响菌体的生长代谢。此外,菌株在pH4.0~6.7的范围OD值变化不大,说明此菌株有较宽广的pH适应范围。实验中选择菌体密度最大时的pH4.0为适宜培养基pH。
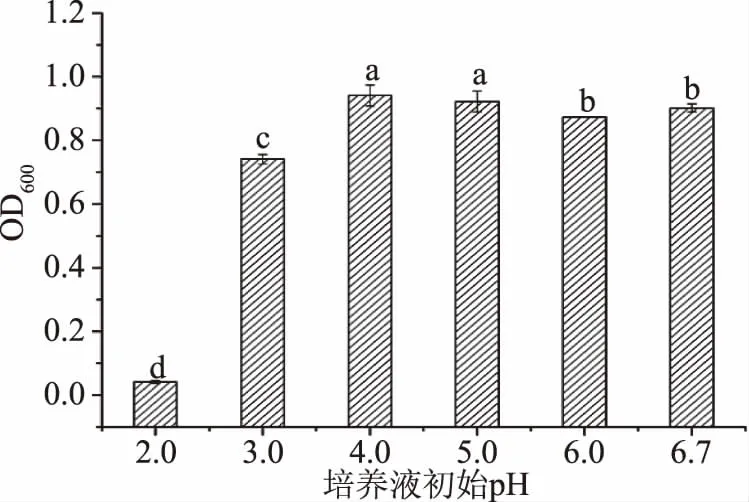
图7 培养液初始pH对菌株FM-S-115生长量的影响Fig.7 Effect of initial pH of mediumon growth of FM-S-115
2.2.7 菌液接种量对菌株FM-S-115生长量的影响 接种量大小对菌体生长的影响如图8所示。可以看出,接种量1%~7%范围内,菌体密度随之增加,在7%时最大(OD600=1.155),继续增加接种量菌体密度下降,原因是接种量过低会延长发酵时间,过高会使得酵母之间互相竞争养分,过早到达衰退期。对比郑苗等[29]对东方伊萨酵母研究得出2%接种量时菌体生长效果最佳的结果,此株酿酒酵母更能耐受较高的接种量。实验中在5%~9%的范围内无显著差异(P>0.05)的情况下,为了菌体的活性以及发酵产物的积累考虑,选择5%为该菌株的最适接种量。
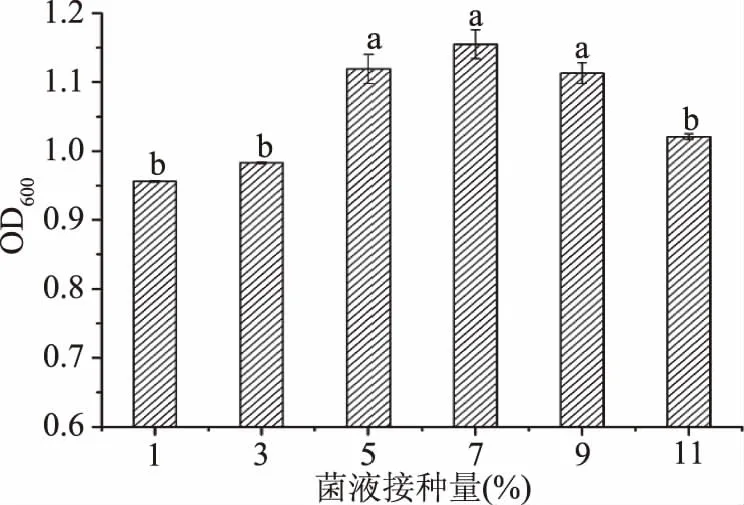
图8 菌液接种量对菌株FM-S-115生长量的影响Fig.8 Effect of inoculation amounton growth of FM-S-115
2.2.8 正交试验结果 通过对比各个单因素实验结果的菌体OD值增长幅度以及结合数据显著性差异分析,可以得出三个影响最大的因素:温度、培养液初始pH和碳源含量。正交试验结果如表2所示。根据极差分析结果看出,三个因素之间影响最大的是温度,其次是培养液初始pH,碳源含量影响最小。最优组合为A3B3C2,即温度为32 ℃,pH为4.5,碳源含量为16%时,菌体稀释5倍下的OD值最大,为1.471。对OD值分析,试验号8和试验号9的结果没有显著性差异(P>0.05),为选出最优组合对两组培养基进行菌落计数。试验号8的菌落总数为1.51×108CFU/mL,试验号9为1.79×108CFU/mL,因此选择试验号9,即温度为32 ℃,pH为4.5,蔗糖含量为16%为最佳培养条件,此条件下的菌落总数是优化之前液体培养(YPDB培养基,28 ℃、150 r/min,培养16 h,下同)菌落总数1.02×108CFU/mL的1.75倍。
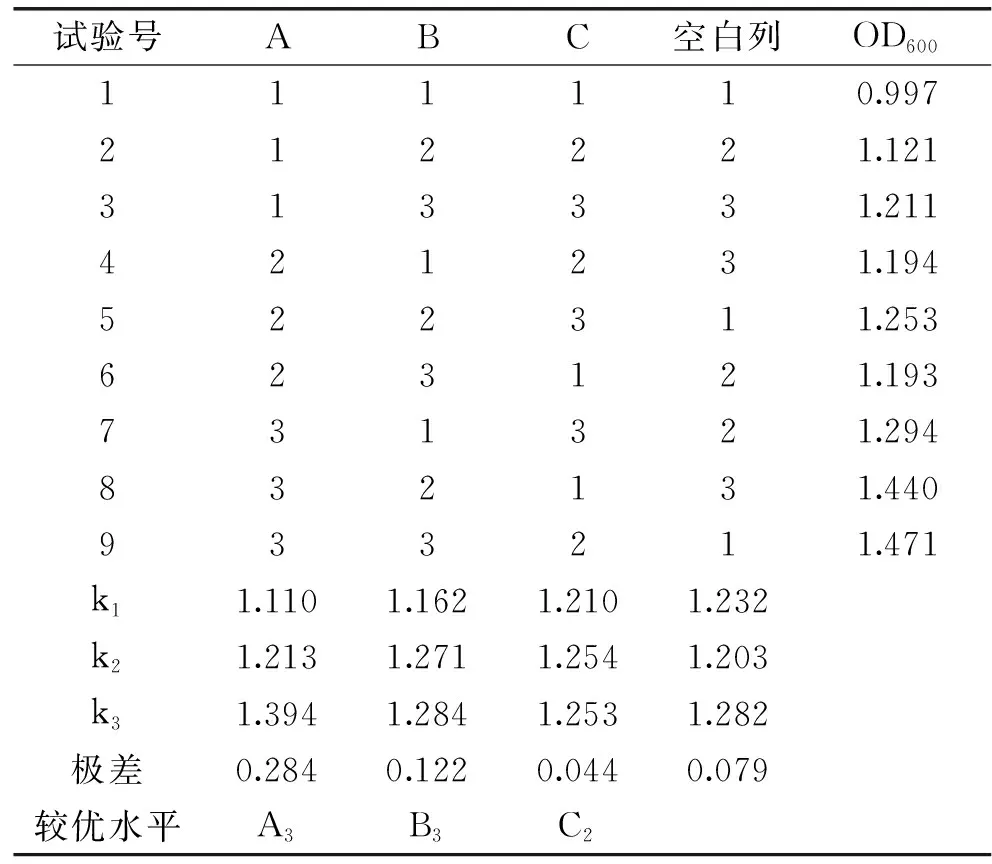
表2 FM-S-115菌株条件优化正交试验结果Table 2 Results of orthogonal test foroptimization of FM-S-115 cultivation conditions
2.3 微囊化酵母FM-S-115高密度培养结果
2.3.1 海藻酸钠质量浓度的确定 海藻酸钠质量浓度对培养一代后的胶囊破囊率的影响如图9所示。可以看出,在0.8%~1.5%的范围内,破囊率先降低后升高,在1.2%时,破囊率最低,为14.89%。继续升高海藻酸钠质量浓度,破囊率升高,原因可能是海藻酸钠浓度过低时,不能满足钙离子的配位需求,造成微胶囊孔隙过大,通透性大大增加,浓度过高时,配位数增加,空隙减小,胶囊的囊壁增厚,通透性降低,导致破囊率升高[19]。实验中选择制备微胶囊的海藻酸钠质量浓度为1.2%。
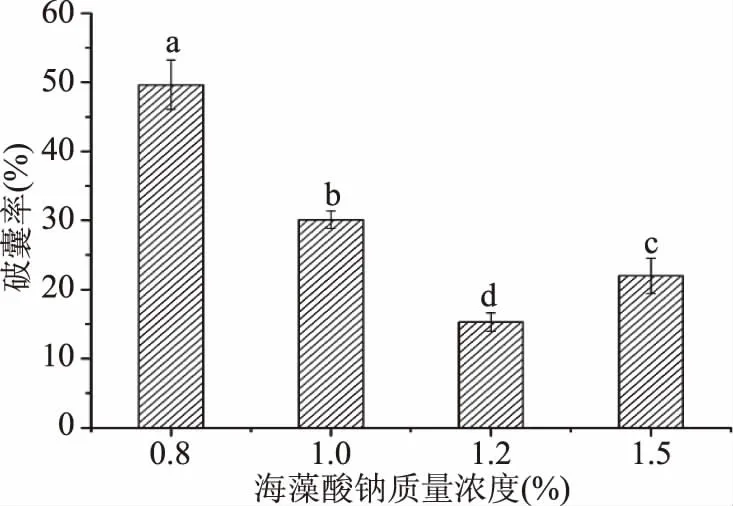
图9 海藻酸钠质量浓度对破囊率的影响Fig.9 Effect of sodium alginateconcentration on capsule damage rate

图10 氯化钙质量浓度对破囊率的影响Fig.10 Effect of calcium chlorideconcentration on capsule damage rate
2.3.2 氯化钙质量浓度的确定 氯化钙质量浓度对培养一代后的破囊率的影响如图10所示。可以看出,3.0%~9.0%的范围内,破囊率先降低后升高,7%时破囊率最低,为13%左右,浓度继续增加,形成的胶囊通透性低,酵母的生长空间狭窄,导致破囊率升高。此外,酵母发酵过程中产气也是一个重要原因。实验中选择制备微胶囊的氯化钙质量浓度为7.0%。
2.3.3 微囊化酵母活菌计数结果 随着更换培养基次数的增加,囊内活菌数的变化如图11。可知,培养至第4代菌落总数最大,到第5代时密度略降低,因为更换囊内菌体培养基次数增加,酵母老化,胶囊破碎,菌体流出,故确定培养代数为4代。培养结束时破囊计得囊内活菌总数为8.10×108CFU/g,是在优化前液体培养1.02×108CFU/mL的7.94倍,是优化后液体培养1.79×108CFU/mL的4.53倍,菌体密度得到大幅提升,达到了酵母高密度培养的目的。

图11 培养代数对活菌计数的影响Fig.11 Influence of culture generations on colony count
3 结论
通过单因素和正交试验实验得出最适培养基为:1.0%蛋白胨,0.5%酵母浸出粉,16%蔗糖;最适培养条件为:温度32 ℃、培养基初始pH4.5、菌液接种量5%,150 r/min培养16 h。在此条件下培养,酵母FM-S-115的活菌数为1.79×108CFU/mL,是优化前1.02×108CFU/mL的1.75倍。通过对液芯微胶囊制备过程海藻酸钠和氯化钙浓度优化,海藻酸钠质量浓度为1.2%,氯化钙质量浓度为7.0%时,破囊率最低。微囊化酵母在最适条件下连续培养,最终囊内活菌总数为8.10×108CFU/g,是培养条件优化前液体培养的7.94倍,是优化后液体培养的4.53倍,可见将微生物微胶囊化包埋后培养对提高生长量方面有很大意义。

