不同MRI技术对类风湿性关节炎活动度的诊断价值
武汉大学中南医院风湿免疫科(湖北 武汉 430071)
刘 婷 夏 上
类风湿性关节炎(rheumatoid arthritis,RA)是以腕关节受累为主的多系统慢性自身免疫性疾病,可累及全身周围小关节,病情持久,并可反复发作,最终导致关节软骨受损,骨髓水肿、骨质破坏、关节功能障碍,晚期甚至可因关节间隙狭窄、关节功能丧失而致残[1-2]。因此,如何有效诊断RA活动性并采取对应措施干预延缓病情进展,是降低RA致残率的基础。DAS-28评分虽可有效评价RA炎症活动,但其仅能反映滑膜炎症的活动性,在反映RA病理活动期上尚有欠缺[3-4]。MRI是RA的主要影像学辅助检查手段,其在反映RA骨膜增厚、软骨破坏等病理特征时优势显著[5-6]。本研究着重分析DCE-MRI、DWI两种不同MRI技术对RA活动度的诊断价值,具体报道如下。
1 资料与方法
1.1 一般资料 将2014年1月至2018年8月在我院确诊为RA的126例患者纳入研究范围,均符合RA诊断要求,有完整DCE-MRI、DWI影像资料,其中男27例,女71例,年龄47~72岁,平均(56.01±9.87)岁,参照DAS-28评分结果将其分为临床缓解组(n=42)、中度活动组(n=48)、高度活动组(n=36),且DSA-28评分与MRI检查间隔时间<1周。
1.2 检查方法 扫描设备为西门子3.0T MR扫描仪,配备表面线圈,对比剂为Gd-DTPA,注射剂量0.1mmol/kg;扫描体位为俯卧位,嘱患者双手上举,掌心向下,将双侧手腕置于同一平面并固定。现行常规MRI扫描,行冠状面TSE T1WI扫描,TR600ms、TE20ms、ETL3、层厚3mm、FOV210mm×210mm、矩阵504×352;TSE T2WI扫描,TR 3500ms、TE85ms、ETL3、层间距0.2mm、FOV24mm×24mm、矩阵256×256、NAS4;再行DWI扫描,TR4300ms、TE285ms、层厚3mm、FOV250mm×250mm、矩阵768×768,b值取0、800s/mm2。再行3D-VIBE序列T1WI扫描,层厚3mm,层间距0,TR5.0ms、TE2.0ms,翻转角0°、4°、6°、8°、10°、12°,再行DCE-MRI扫描,TR 3ms、TE1.42ms,矩阵100×80,FOV150mm×120mm×70mm,扫描至第三期时应用高压注射器经肘静脉按2ml/s速率注射Gd-DTPA,扫描40个时相,单个时相扫描时长10s,扫描总时长400s,再行冠状面T1WI增强扫描。
1.3 影像分析 将所得影像资料上传至后处理工作站,并由两位高年资影像学医师采用双盲法进行对应后处理,对受累关节异常征象,如滑膜炎、骨髓水肿等进行观察,获取DCE-MEI量化参数,包括早期强化率(EER)、平均强化率(AER)、最大强化率(MER)、达峰时间(TTP)及DWI量化参数ADC值,每个值均重复测量3次,取平均值为最终结果。
1.4 统计学分析 采用SPSS19.0软件进行统计学分析,EER、MER、AER、TTP、ADC等量化参数采用表示,重复方差分析及LSD-t检验,并以临床确诊结果为金标准绘制ROC曲线,获取EER、MER、AER、TTP、ADC的曲线下面积(AUC)、最佳敏感阀值,并以最佳敏感阀值为截断,计算对应量化参数的诊断效能,均行Sig双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 RA患者DCE-MRI结果三组RA患者DCE-MRI影像相关指标EER、MER、AER、TTP比较差异均有统计学意义,且临床缓解组EER、MER、AER<中度活动组<重度活动组,临床缓解组TTP>中度活动组>重度活动组,差异有统计学意义,见表1。
2.2 RA患者DWI检查结果 三组RA患者ADC值比较差异有统计学意义,且临床缓解组ADC>中度活动组>重度活动组,差异有统计学意义,见表2。
2.3 EER、MER、AER、TTP、ADC的ROC曲线分析 经ROC曲线分析,EER、MER、AER、TTP、ADC等指标AUC值、最佳敏感阀值、敏感度、特异度见表3,以AER诊断效能最佳,见图1、图2、表3。
2.4 影像示例 女,年龄49岁,入院时腕关节疼痛、肿胀,自述症状持续4d,MRI冠状T1WI增强可见关节周围明显强化,滑膜增厚(图3),T2WI(图4)可见骨髓水肿,DWI高信号(图5),提示RA活动期。
3 讨 论
基于DAS28在判断RA病理进展上的局限性,DCE-MRI、DWI均可间接反应RA病理进展及活动性。本研究显示,临床缓解组EER、MER、AER<中度活动组<重度活动组,临床缓解组TTP>中度活动组>重度活动组,提示缓解期血管通透性、血管容积较低,随活动期可逐渐上升,究其原因,DCE-MEI用于RA的基础主要依据RA在疾病进展中出现的反复活动性,于RA患者,活动期与稳定期间滑膜内血管容积、通透性均可出现明显差异,临床研究指出,当RA处于活动期时,受滑膜内炎性反应、毛细血管增生等因素影响,滑膜内呈炎性血管翳,DCEMRI可见快速明显强化;而当RA处于稳定期,RA滑膜内呈纤维血管翳表达,DCE-MRI主要表现为中度延迟强化[7-8]。
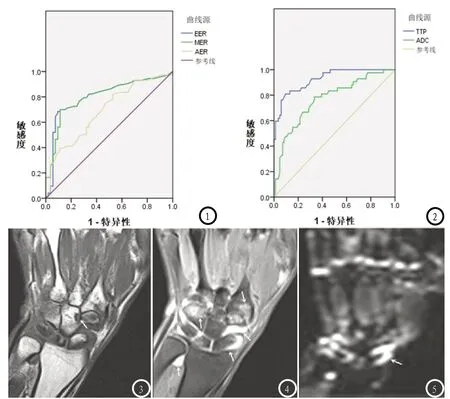
图1 EER、MER、AER的ROC曲线图;图2 TTP、ADC的ROC曲线图;图3-5 RA患者DCE-MRI、DCE影像图

表1 RA患者DCE-MRI结果

表2 RA患者DWI检查结果
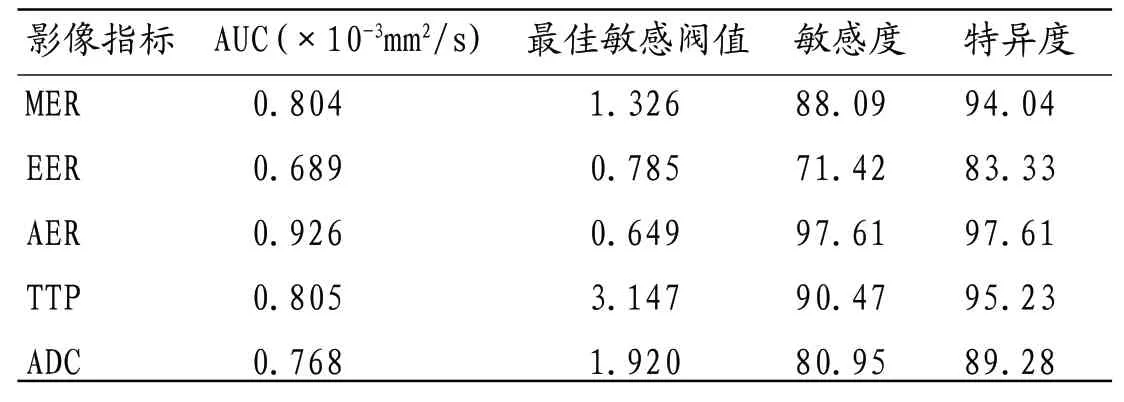
表3 EER、MER、AER、TTP、ADC的诊断效能
研究还显示,临床缓解组ADC>中度活动组>重度活动组,差异有统计学意义,提示当RA处于活动期时,ADC值呈明显低表达,并随活动期进展而降低;究其原因,DWI主要基于组织水分子扩散运动反应RA活动性,一般情况下,当RA处于活动期时,不仅滑膜内血管容积大、炎性细胞浸润,滑膜炎性血管翳导致滑膜内细胞数目增加,细胞间隙随之缩小,炎性细胞、毛细血管成分的增加均导致细胞间隙内水分子吸附作用增强,均可使组织水分子扩散受限,呈现高DWI值,对应ADC则低表达[9-10]。
经ROC曲线分析,EER、MER、AER、TTP曲线下面积分别为0.804、0.689、0.926、0.805,最佳敏感阀值分别为1.326、0785、0.649、3.147,但以AER>0.649为RA活动期阳性阀值,其诊断RA活动性效能最佳,灵敏度、特异度均高达97.61%;而ADC值ROC曲线下最大面积为0.768,最佳敏感阀值为1.920,诊断灵敏度、特异度分别为80.95%、89.28%,仅优于EER,提示DCEMRI用于诊断RA活动性或具更佳诊断效能,这与王唯伟等[11]的报道结论略有差异,其报道EER、MER、AER、TTP、ADC诊断RA活动性的敏感度均高达100%,以ADC值特异度最佳,为89.00%,分析差异或因样本数量、研究对象个体差异所致,但本研究也有一定局限性,如未进一步将上述影像学指标与RA病理进行进一步分析,未进一步联合DCE-MRI影像指标进行联合诊断,DWI检查时仅选取单个b值,因此,DCE-MRI、DWI用于RA活动性诊断的临床价值仍有待进一步深入探究。
综上所述,DCE-MRI、DWI用于诊断RA活动性均具一定临床价值,但前者或能取得更佳诊断获益,值得临床进一步深入探究。

