芽孢杆菌HT-7对棉花黄萎病菌的拮抗作用及拮抗因子初探
李文鹏,陶 冶,赵素雅,牛秋红
(南阳师范学院 生命科学与技术学院,河南 南阳 473061)
棉花是我国重要的经济作物,全国播种面积约333.3万hm2,年产量500多万t,经济总值近400亿元[1]。近年来,棉花黄萎病(Verticilliumwilt)在我国三大产棉区呈发展态势,全国棉田黄萎病流行约200万hm2,导致棉田常年减产15%~20%,造成的经济损失高达数十亿元,严重危及我国棉花产业的可持续发展[2-4]。
棉花黄萎病为土传性维管束型病害,其致病菌为大丽轮枝菌(VerticillumdahliaeKleb),具有分布广、危害重、传播途径广泛的特点。大丽轮枝菌在土壤中通过根系损伤部位侵入棉花[5],引起棉花叶片黄化枯萎、维管束褐化、蕾铃脱落,甚至整株死亡,严重影响棉花的纤维品质和产量[6]。目前,生产上主要通过种植抗(耐)病品种、调控土壤微生物群落结构等途径防控棉花黄萎病。
国内外防治棉花黄萎病的主要方法有抗性育种、农业防治、化学防治、生物防治技术等。近年来,我国棉花抗黄萎病新品种的选育取得一定进展,但西北内陆棉区的多数品种仍表现为低耐或感病水平,不能满足生产需求[7]。在实际生产中,由于粮棉争地、耗时费力等因素,轮作倒茬很难实施。化学防治方面,传统农药溴甲烷等因其对生态环境和人类健康产生威胁,已经被逐渐淘汰,而新的化学农药防治谱不足,且对环境仍然存在潜在的不良影响[8],棉花黄萎病的防控任重而道远。生物防治主要是通过部分微生物及微生物代谢产物的作用,对农作物病虫害进行防治的技术和方法[9-10],因其具有持续时间长、安全、残留少等优势,越来越受到人们的重视,被公认为是最具发展潜力的防治方法[11]。近年来,有学者发现,部分芽孢杆菌、放线菌和真菌对植物病原菌具有较好的拮抗作用[12-15]。但生物防治存在生防制剂效果不稳定的短板,由于不同地区的微生物种群不同,生防菌株能否在土壤中或者植株内很好地定殖是其发挥抗病作用的前提[16-17]。刘海洋等[18]从土壤中筛选出1株芽孢杆菌AL7,发现其不但对大丽轮枝菌有较好的抑制效果,而且在土壤中也有较强的定殖能力,其极强的定殖和杀菌能力,为该生防菌的普及提供更大的可能性。李社增等[19]研发的枯草芽孢杆菌NCD-2,对黄萎病的防效超过50%。该菌株已被开发为防治棉花黄萎病的微生物农药。
我国棉花栽培品种以陆地棉为主,虽然其产量可观但其抗黄萎病能力较差,而海岛棉黄萎病抗性突出而持久[20-21]。研究发现,根际微生物以及内生菌也参与了棉花对黄萎病的抵抗[22-23]。目前,对棉花根际黄萎病菌拮抗菌的研究多集中在菌种筛选和防效测定方面,对其拮抗机制以及相应基因、蛋白质资源挖掘的研究较少。鉴于此,以黄萎病抗性棉(海岛棉,海7124)根部土壤为材料筛选黄萎病拮抗菌株,并利用盆栽试验验证其生防效果。在此基础上,进一步深入挖掘拮抗菌株对黄萎病菌的拮抗机制,分离出其主要的毒力蛋白并对其抗菌性能进行检测,为生防菌防治棉花黄萎病提供理论支持和基因资源,并为下一步开发棉花黄萎病生防工程菌株奠定基础。
1 材料和方法
1.1 材料
供试大丽轮枝菌V991,由河南大学植物逆境国家重点实验室蔡应繁教授惠赠。供试棉花品种为感病棉品种TM-1。供试土样采自南阳师范学院西区黄萎病抗性棉品种海7124棉田。
1.2 方法
1.2.1 土样采集与土壤拮抗菌株的分离 采集黄萎病抗性棉(海7124)根系土壤,自然风干,土壤微生物的分离采用梯度稀释法[24],称取5 g土样置于装有50 mL无菌水的三角瓶中,37 ℃、220 r/min摇瓶培养48 h,混合液置于80 ℃恒温水浴锅中加热10 min[25],取1 mL混合液依次稀释,分别取10-4、10-5、10-6、10-7共4个梯度的稀释液100 μL涂布LB平板,37 ℃恒温培养12 h,挑取形态、大小、色泽不同的单菌落,经多次划线纯化后编号,于4 ℃冰箱保存备用。
1.2.2 拮抗细菌的筛选 采用传统的对峙培养法进行抑菌试验[26],在PDA培养基平板中央接种大丽轮枝菌,25 ℃倒置培养3 d备用。待测菌株37 ℃、220 r/min摇瓶培养12 h,取100 μL菌液均匀涂布LB平板,37 ℃恒温培养12 h,用直径1 cm的打孔器打出细菌菌饼,在接种大丽轮枝菌PDA平板两侧对称放置,25 ℃恒温对峙培养10 d,测量抑菌直径,设置3个平行试验,并按照下列公式计算抑菌率[27]。抑菌率=(对照组真菌菌落生长直径-处理组真菌菌落生长直径)/对照组真菌菌落生长直径×100%。
1.2.3 拮抗菌株的鉴定 将筛选得到的拮抗菌株划线转接于LB平板中,观察菌落形态,利用扫描电子显微镜观察其单细胞形态。用AxyPrep细菌基因组DNA小量试剂盒提取菌株的基因组DNA,并以通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT-3′对其16S rDNA序列进行PCR扩增[28]。将纯化后的扩增产物与pMD18-T(TaKaRa公司)克隆载体连接,并转化至大肠杆菌DH5α中,筛选阳性转化子测序(北京三博远志生物技术有限责任公司)。将得到的基因序列在GenBank数据库中进行比对,结合序列相似性比对结果对拮抗细菌进行初步鉴定。
1.2.4 拮抗菌株对盆栽棉花黄萎病的防效测定 接种筛选得到拮抗菌株于LB液体培养基中摇瓶培养活化过夜,按1%的比例转接于150 mL LB中,37 ℃、220 r/min摇瓶培养48 h。8 000 r/min常温离心20 min收集菌体,无菌水重悬菌体,调节至1.0×107cfu/mL。按每100 g土壤加10 mL菌液的比例配制试验用土样,分别在接菌处理(试验组)和未接菌处理(对照组)的土壤中播种经消毒处理的感病棉种子。待棉花两片子叶完全展开后,通过灌根的方式向试验组每盆浇灌10 mL菌液,对照组浇灌10 mL无菌水。待棉花长至二叶一心后,伤根接种大丽轮枝菌,继续培养并观察棉花的发病情况。按以下分级标准记录黄萎病的发病级别,0级:健康植株;1级:1片以下或部分子叶变黄或坏死发病;2级:2片子叶变黄或坏死;3级:1片真叶变黄或坏死的现象;4级:2片或2片以上真叶变黄或坏死,并按照下列公式计算病情指数和防治效果[29]。
病情指数=∑(级值×株数)/(最高级值×总株数)×100;
防治效果=(对照病情指数-处理病情指数)/对照病情指数×100%。
数据分析使用SPSS 22.0软件。采用单因素方差分析(One-way ANOVA)进行统计分析,所有显著水平定为P<0.05,所有结果为3次独立生物学重复的平均值±标准误差。
1.2.5 拮抗菌株发酵滤液对大丽轮枝菌孢子萌发的影响 收集拮抗菌株的发酵上清液,用0.22 μm微孔滤膜过滤制成无菌发酵滤液备用。取3 mL无菌发酵滤液与3 mL 1.0×106~1.0×107cfu/mL的大丽轮枝菌孢子悬液混合均匀(试验组),另取3 mL LB液体培养基与3 mL 1.0×106~1.0×107cfu/mL的大丽轮枝菌孢子悬液混合均匀(对照组),25 ℃、180 r/min振荡混合培养12 h,设置3个平行试验,镜检观察大丽轮枝菌孢子萌发及菌丝生长情况[30],计算孢子萌发率。
孢子萌发率=萌发孢子数/总孢子数×100%。
1.2.6 拮抗菌胞外代谢产物的热稳定性检测 取拮抗菌株无菌发酵滤液各1 mL置于2支1.5 mL的EP管中,1支置于100 ℃水浴锅中加热10 min,另1支置于25 ℃水浴锅中加热10 min备用。制备1.0×106~1.0×107cfu/mL的大丽轮枝菌孢子悬液,按5%的比例将孢子悬液加到PDA培养基中混合均匀,制备大丽轮枝菌孢子固体培养基平板,待平板完全冷却凝固后,在距离培养基边缘等距处打孔,每孔中分别加200 μL备用的2组无菌发酵滤液,并设置对照(CK,等量LB液体培养基),25 ℃恒温培养5 d,设置3个平行试验,观察真菌孢子萌发的情况,并测量抑菌圈直径。
1.2.7 胞外蛋白抑菌活性检测及毒力蛋白的确定 收集500 mL拮抗菌株发酵上清液,设置300、500、700、900 g/L硫酸铵对拮抗菌株胞外蛋白进行分级盐析,溶解收集梯度盐析粗蛋白溶液,将盐析的粗蛋白溶液经0.22 μm微孔滤膜过滤后备用。另取200 μL 1.0×106~1.0×107cfu/mL大丽轮枝菌孢子悬液,均匀涂布于PDA平板中,在距离培养基边缘等距处打孔,每孔中分别加100 μL备用粗蛋白滤液,25 ℃恒温共培养5 d,观察大丽轮枝菌孢子萌发情况,并对不同梯度盐析蛋白质进行SDS-PAGE蛋白电泳检测,将潜在的活性蛋白切胶,送至上海颢泽生物医药科技有限公司进行质谱鉴定、比对分析,确定毒力蛋白的种类。
1.2.8 毒力蛋白的基因克隆 采用AxyPrep细菌基因组DNA小量试剂盒提取拮抗菌株的基因组DNA。从GenBank数据库中调取与拮抗菌株同源性较高已有细菌的毒力蛋白(经1.2.7确定)基因序列,根据基因序列的保守区用DNAMAN尝试设计引物,对拮抗菌株毒力蛋白基因进行扩增。其上游引物P1∶5′-ATGTTTTATCGTATGAAACG-3′,下游引物P2∶5′-TTTTTTTGTATAGCGCACCC-3′。反应体系30 μL:基因组1 μL、上下游引物各1 μL、2×Taqplus Master Mix 15 μL、去离子水12 μL。PCR扩增条件:97 ℃预变性5 min,97 ℃变性30 s,57 ℃退火30 s,72 ℃延伸1 min,30个循环。将纯化后的扩增产物与pMD18-T(TaKaRa公司)克隆载体连接,并转化至大肠杆菌DH5α中,筛选阳性克隆提取质粒并进行测序。用含有酶切位点BamHⅠ和HindⅢ的上下游引物对目的基因进行扩增,构建重组克隆质粒。
1.2.9 毒力蛋白的表达、纯化及抗菌活性测试 用内切酶BamHⅠ和HindⅢ对重组克隆质粒和pET-32a(+)质粒双酶切,并构建表达质粒PET-β,转化宿主菌E.coliBL21,探索最佳的IPTG诱导条件。8 000 r/min常温离心20 min,收集表达后菌体,进行超声波破碎,破碎上清进行Ni-NTA介质金属螯合亲和层析,对目标蛋白梯度洗脱,洗脱液进行SDS-PAGE电泳检测。收集重组毒力蛋白探究其抗菌活性,将重组毒力蛋白与大丽轮枝菌孢子悬液混合培养,探究重组毒力蛋白对孢子萌发的影响,利用平板对峙试验研究重组毒力蛋白对大丽轮枝菌菌丝生长的影响。并以昆布多糖为底物,采用DNS法对重组毒力蛋白活性进行测定,以每分钟反应生成相当于1 μg葡萄糖的量为1个酶活单位(U,QB 2583—2003)。
酶活力(U/mL)=葡萄糖生成量(mg)×1 000/时间(min)×酶液加入量(mL)。
2 结果与分析
2.1 拮抗菌株的分离及筛选
利用稀释涂布平板法分离得到56株待测菌株,采用对峙平板法对得到的56株待测菌株进行抗菌活性检测,其中,编号为HT-7的菌株对大丽轮枝菌菌丝生长的抑制效果较为显著,抑菌率高达56%(图1),故对其进行更深一步的研究。

图1 菌株HT-7对大丽轮枝菌的抑制效果Fig.1 Inhibitory effect of strain HT-7 against V.dahlia
2.2 拮抗菌株的分类鉴定
经革兰氏染色确定菌株HT-7为革兰氏阳性菌,菌落形态呈圆形凸起,表面光滑湿润,扫描电子显微镜观察其单细胞形态为无鞭毛的杆状细菌,细胞大小为(1.2~2.0)μm×(0.5~0.7)μm(图2)。对其16S rDNA序列同GenBank数据库比对发现,菌株HT-7与BacillusvanilleaXY18T的同源性高达到99.86%,初步鉴定其为芽孢杆菌属。
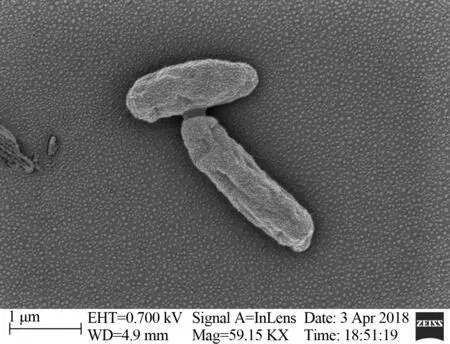
图2 菌株HT-7的细胞形态
2.3 菌株HT-7对盆栽棉花黄萎病的防效
未经菌株HT-7处理的对照组棉花,伤根接种大丽轮枝菌2周后出现典型的棉花黄萎病发病性状,叶片泛黄、叶片边缘出现烧焦状干枯,植株萎蔫,部分叶片用手轻触即掉落。经拮抗菌株HT-7处理后的试验组棉花在伤根接种大丽轮枝菌2周后长势较好,未出现染病现象。4周后,对照组棉花出现大量死亡的现象,部分棉花植株叶片全部脱落,而试验组棉花仅有少部分出现叶片脱落的现象。采集部分试验组正常棉花的叶片观察,未发现叶柄变黑的发病症状(图3)。

图3 拮抗菌株HT-7 对棉花黄萎病的拮抗效果(伤根接种4周后)
分别对试验组和对照组棉花的发病情况进行统计分析(表1),经菌株HT-7处理的棉花伤根接种大丽轮枝菌后发病率和病情指数显著低于对照组,其发病率降低58.33%,病情指数降低82.64%,防治效果高达82.58%。结果表明,拮抗菌株HT-7能有效防治大丽轮枝菌对棉花的侵害。

表1 拮抗菌株HT-7对棉花黄萎病的拮抗效果
2.4 菌株HT-7发酵滤液对大丽轮枝菌孢子萌发的影响
将菌株HT-7的无菌发酵滤液与大丽轮枝菌孢子混合培养12 h后镜检观察,经菌株HT-7处理的试验组大丽轮枝菌孢子短粗膨大,且有聚集现象,大部分孢子无法正常萌发,菌丝较少。未经菌株HT-7处理的对照组大丽轮枝菌孢子萌发正常,菌丝生长旺盛(图4)。
统计大丽轮枝菌孢子萌发情况,结果表明,与HT-7无菌发酵滤液混合培养的大丽轮枝菌孢子(试验组)不能正常萌发,萌发率仅为12.1%,远低于对照组(37.9%),表明菌株HT-7发酵滤液对大丽轮枝菌孢子萌发有明显的抑制作用。

图4 液体环境中HT-7对大丽轮枝菌孢子及菌丝的影响
2.5 菌株HT-7拮抗因子热稳定性检测
对分别经100 ℃、25 ℃水浴加热10 min的菌株HT-7发酵滤液进行抗菌活性检测,平板共培养5 d后观察发现,25 ℃水浴加热10 min的发酵滤液对大丽轮枝菌孢子萌发有较强的抑制作用,在平板中产生明显的抑菌圈,其抑菌圈直径达18 mm,而100 ℃水浴加热10 min后的发酵滤液丧失抑菌能力,在平板中未出现透明圈(图5),证明菌株HT-7的主要毒力因子为热不稳定性物质。
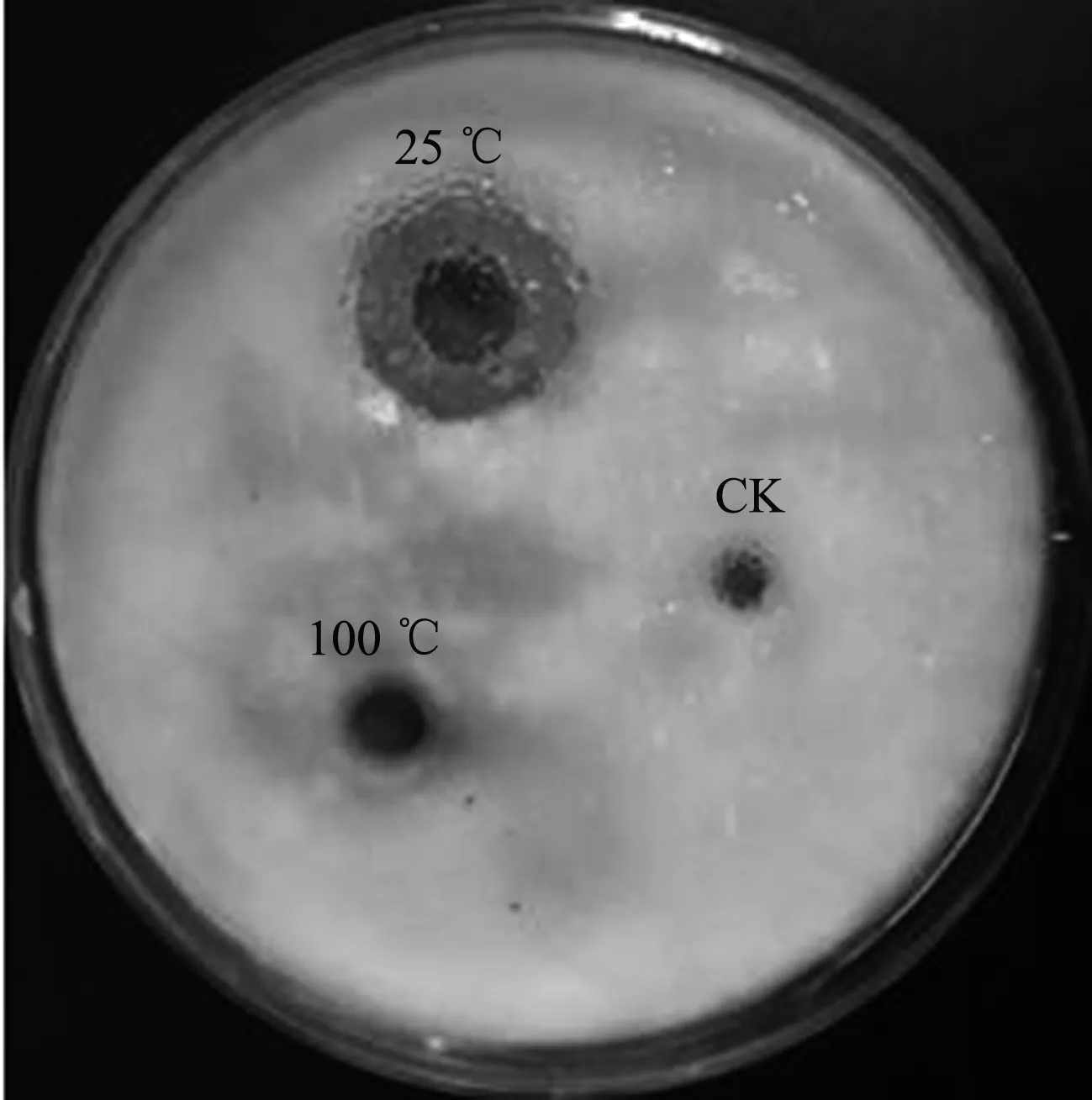
图5 HT-7胞外产物对大丽轮枝菌孢子萌发的影响
2.6 胞外蛋白的抑菌活性检测及毒力蛋白的确定
对不同质量浓度硫酸铵盐析沉淀的蛋白质进行抗菌活性检测,发现4个质量浓度硫酸铵盐析沉淀的蛋白质均有抗菌活性,其中500 g/L和700 g/L硫酸铵盐析蛋白质抑菌效果最佳(图6a)。将各质量浓度下盐析出的蛋白质进行SDS-PAGE凝胶电泳检测(图6b),对毒力蛋白进行质谱鉴定,初步判定其为β-1,3-1,4-葡聚糖酶。

a.不同质量浓度硫酸铵盐析蛋白质的抑菌结果;b.盐析蛋白质的SDS-PAGE电泳结果,其中M为蛋白质分子质量 Marker,1、2、3、4分别表示300、500、700、900 g/L硫酸铵盐析获得的蛋白质条带a.Bacteriostatic test results of protein obtained by gradient precipitation of ammonium sulfate;b.SDS-APGE results of protein obtained by gradient procipitation of ammonium sulfate,M means protein molecular weight marker,1—4 indicate protein solution obtained by gradient precipitation of 300,500,700,900 g/L ammonium sulfate respectively
2.7 菌株HT-7毒力蛋白β-1,3-1,4-葡聚糖酶基因克隆
根据β-1,3-1,4-葡聚糖酶的基因序列设计引物,PCR扩增得到β-1,3-1,4-葡聚糖酶基因(图7),产物送至生工生物工程(上海)股份有限公司进行序列测定,结果显示,该基因片段全长大小732 bp,编码243个氨基酸。将该毒力蛋白氨基酸序列递交至NCBI数据库进行比对分析,该氨基酸序列与B.velezensis的糖基水解酶家族蛋白质氨基酸序列(WP-038460387)同源性为99.59%,与B.amyloliq-uefaciens的β-1,3-1,4-葡聚糖酶(AAO43052)同源性为97.94%,说明从菌株HT-7中成功扩增得到毒力因子β-1,3-1,4-葡聚糖酶基因。

M:Marker 5000;1—3:β-1,3-1,4-葡聚糖酶基因
2.8 菌株HT-7毒力蛋白的表达、纯化及活性检测
用内切酶BamH Ⅰ和Hind Ⅲ对构建的重组表达质粒pET-β进行双酶切验证,产物进行琼脂糖凝胶电泳检测,凝胶电泳结果在5 000 bp和750 bp处各出现1条单一明亮条带(图8),表明重组质粒构建成功,并将重组质粒转化至宿主E.coliBL21中进行诱导表达。
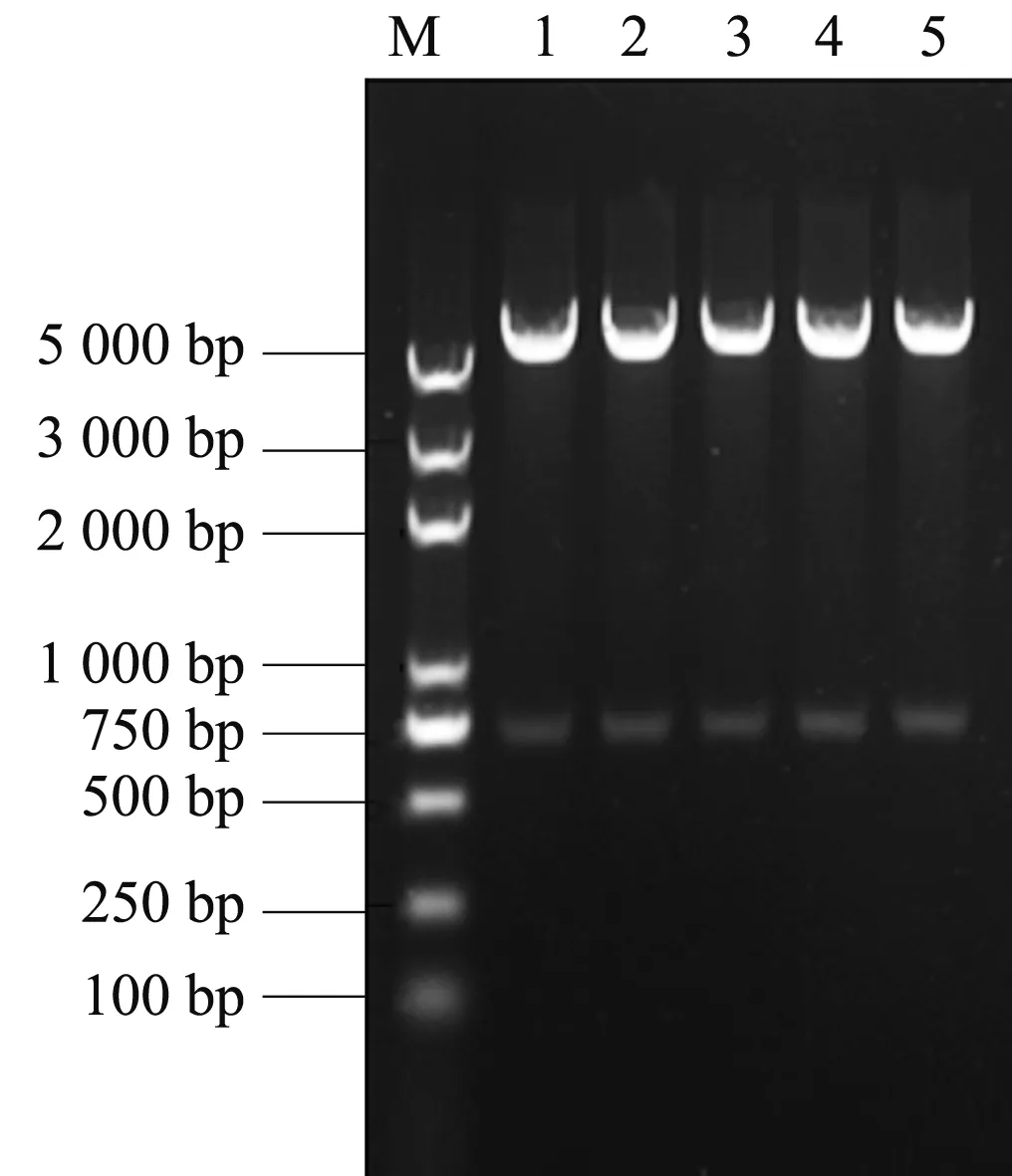
M:Marker 5000;1—5:质粒pET-β的双酶切结果
通过探索,确定转化后的宿主E.coliBL21在0.4 mmol/L IPTG条件下30 ℃诱导培养8 h效果最佳。超声波破碎宿主菌细胞,上清进行Ni-NTA介质金属螯合亲和层析并进行SDS-PAGE电泳检测,在200 μmol/L咪唑下洗脱得到1条单一蛋白质条带(图9a)。在重组β-1,3-1,4-葡聚糖酶的平板抑菌试验中,重组β-1,3-1,4-葡聚糖酶有效抑制大丽轮枝菌菌丝的延伸,导致其无法正常生长,通过测量,抑菌率达25%(图9b)。
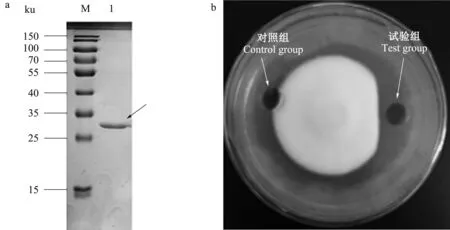
a.重组β-1,3-1,4-葡聚糖酶SDS-GAGE电泳结果,其中,M为蛋白质分子质量Marber,1表示重组β-1,3-1,4-葡聚糖酶;b.重组β-1,3-1,4-葡聚糖酶抑菌检测结果a.SDS-PAGE results of recombinant β-1,3-1,4-glucanase,M means protein molecular weight marker,1 indicates recombinant β-1,3-1,4-glucanase;b.Bacteriostatic test result of recombinant β-1,3-1,4-glucanase
由图10可见,重组β-1,3-1,4-葡聚糖酶对大丽轮枝菌孢子萌发具有显著的抑制效果,未经重组β-1,3-1,4-葡聚糖酶处理的对照组孢子萌发正常且菌丝生长旺盛,重组β-1,3-1,4-葡聚糖酶处理的试验组孢子萌发受到显著抑制,大部分孢子无法正常萌发,部分孢子出现孢壁破裂的现象。可见,β-1,3-1,4-葡聚糖酶是菌株HT-7发挥生防作用的重要毒力因子,由DNS法测得纯化后的重组β-1,3-1,4-葡聚糖酶活高达23.5 U/mL。

图10 重组β-1,3-1,4-葡聚糖酶对大丽轮枝菌孢子萌发的影响
3 结论与讨论
棉花黄萎病是典型的土传维管束病害,病原菌大丽轮枝菌寄宿植物种类繁多[31],微菌核抗逆性强,能在土壤中长时间存活,轮作和倒茬很难降低土壤中微菌核的数量;再加上大丽轮枝菌的致病能力强、变异性大,一般的抗病棉品种又难以获得,故很难通过物理手段来防治黄萎病[32]。化学农药对减轻黄萎病对棉花的危害虽然有一定的效果,但带来的环境问题也日益严重。近年来,以生物防治为主的综合防治措施逐渐受到人们的重视,该方法具有绿色环保、不易产生抗性、发展潜力大等优势,在黄萎病的防治中具有非常重要的意义[33]。其利用生防菌株的竞争作用、拮抗作用和诱导系统抗性等机制发挥生物防治效果,是防治棉花黄萎病的重要途径之一。
芽孢杆菌因具有耐受能力强、繁殖速度快、分布范围广等多方面优点,成为防治棉花黄萎病的重要生防菌。目前发现多种芽孢杆菌对棉花黄萎病具有拮抗效果,金利容等[34]从棉花植株内分离筛选出了对棉花黄萎病具有拮抗作用的恶臭假单胞菌(Pseudomonasputida);翟枫[35]从棉花土壤中筛选得到的解淀粉芽孢杆菌对棉花有一定的促生作用;文雨婷等[36]从土壤中筛选得到多株酵母菌对棉花黄萎病具有拮抗作用。随着研究的不断深入,拮抗芽孢杆菌的部分毒力因子也不断被发掘出来,如徐婷等[37]成功地从贝莱斯芽孢杆菌(B.velezensis)中分离到抑制大丽轮枝菌的毒力因子。宗英等[38]在1株贝莱斯芽孢杆菌抑制禾谷镰刀菌的研究中发现,其挥发性物质对病原真菌有一定的拮抗作用。袁洪水等[39]从分离的拮抗菌株中均纯化得到对大丽轮枝菌孢子萌发和菌丝生长都有较好抑制作用的毒力蛋白。此外,胡明[40]利用硫酸铵盐析的方法成功地从棉花黄萎病拮抗细菌BDT-25的发酵液中分离纯化出抗菌多肽类物质,此抗菌多肽能明显抑制大丽轮枝菌的菌丝生长及孢子萌发。
由于不同地区的地理环境、气候等差异,导致目前发现的黄萎病拮抗菌株未能大面积普及并投入应用。本研究从黄萎病抗性棉(海7124)根系土壤中分离得到1株对棉花黄萎病具有良好防治效果的菌株Bacillussp.HT-7,丰富了棉花黄萎病拮抗菌株的资源。通过平板对峙试验和盆栽试验,均验证了其对大丽轮枝菌具有较强的拮抗性能;通过混合孢子试验、毒力因子的热稳定性检测及抗菌蛋白活性跟踪等试验,最终确定β-1,3-1,4-葡聚糖酶是菌株HT-7发挥拮抗性能的主要毒力因子,并在重组β-1,3-1,4-葡聚糖酶抗菌试验中取得了不错的抑菌效果,为棉花黄萎病的生物防治提供了理论依据。
——谷物β-葡聚糖的最新研究进展

