两个玉米品种维管束鞘叶绿体的非光化学淬灭对干旱胁迫的响应
刘文娟,常丽娟,岳丽杰,宋君,张富丽,王东,吴佳蔚,郭灵安,雷绍荣
两个玉米品种维管束鞘叶绿体的非光化学淬灭对干旱胁迫的响应
刘文娟1,常丽娟1,岳丽杰2,宋君1,张富丽1,王东1,吴佳蔚1,郭灵安1,雷绍荣1
(1四川省农业科学院分析测试中心,成都 610066;2四川省农业科学院作物研究所,成都 610066)
【目的】光系统II的非光化学叶绿素荧光淬灭是高等植物响应环境变化最快速的光保护机制,玉米具备叶肉和维管束鞘2种叶绿体结构,本研究通过比较2个玉米品种的光合耐旱能力,探究维管束鞘叶绿体的非光化学淬灭对玉米耐旱性的意义。【方法】以成单30和仲玉3号2个玉米品种为研究材料,设置土壤相对含水量为70%—80%田间持水量(FWC)(充足浇水,对照)、50%—60% FWC(中度干旱胁迫)和35%—45% FWC(重度干旱胁迫)3个土壤水分梯度处理。测定玉米叶片的水分状况、叶绿素含量、活性氧积累、质膜透性和气体交换等参数;应用叶绿素荧光动力学显微成像观测,比较玉米叶肉和维管束鞘叶绿体的叶绿素荧光参数Fv/Fm和NPQ;通过免疫印迹法,分析玉米叶肉和维管束鞘细胞光系统II亚基S(PsbS)稳态水平的变化差异;采用蓝-绿胶温和电泳分离,检测玉米光系统II蛋白复合体的水平。【结果】干旱胁迫导致叶片气孔导度和蒸腾速率下降,2个玉米品种间没有明显差异。但成单30在重度干旱下表现出更好的水分状况、更低的活性氧损伤以及更高的光合速率。玉米叶肉和维管束鞘叶绿体的NPQ水平及PsbS蛋白含量受干旱诱导明显上升,维管束鞘中的上升更显著,成单30表现尤为突出。不同于仲玉3号光系统II蛋白复合体水平的下降,重度干旱胁迫后,成单30的捕光蛋白三聚体水平在叶肉和维管束鞘细胞中均有所升高。【结论】2个玉米品种的光合机构对干旱胁迫的气孔响应能力相当,但相较仲玉3号,成单30的维管束鞘叶绿体具备更优越的非光化学淬灭能力,这对其更强的非气孔限制的光合耐旱性具有积极意义。
玉米;干旱胁迫;维管束鞘细胞;光系统II;非光化学淬灭
0 引言
【研究意义】光合机构是植物响应环境胁迫最敏感的部位之一,土壤干旱导致叶片水分亏缺,通过气孔和非气孔限制,引起过剩光能对植物造成一定程度的光抑制,使光合机构受损,光合电子传递、光合磷酸化和CO2同化等过程受到影响[1-3]。光系统II(photosystem II,PSII)在高等植物对环境胁迫的应答中起着重要的作用,研究干旱胁迫下,植物光合机构,尤其是PSII的响应机理,对提高植物的耐旱能力具有重要意义[4]。当植物叶绿体能量平衡发生改变时,PSII上激发能的非光化学淬灭(non- photochemical quenching,NPQ)是光合膜系统对过剩光能最快速的分子适应机制,过剩光能通过NPQ以热能形式耗散,保护PSII免受光抑制和光损伤[5]。对光合机构光保护的有效调控,可以提高作物的光合效率和产量,为作物田间栽培育种提供有益帮助[6]。玉米是典型的C4植物,叶肉和维管束鞘细胞中均具备叶绿体结构,光合作用由2种细胞协同完成,具有较高的光合效率和较强的环境适应能力。探究玉米叶肉和维管束鞘叶绿体中是否均存在光保护的NPQ机制,了解NPQ水平对作物耐旱性的意义,可以为玉米光合耐旱机理的揭示和田间耐旱品种的选育提供数据支持和理论依据。【前人研究进展】自然条件下,土壤干旱通常伴随高温、辐射和营养亏缺等其他因子,对植物的影响复杂又多方面,气孔限制和非气孔限制可能相伴而行,也可能以某种形式占优[7]。短期干旱造成的非气孔限制中,PSII结构和功能的改变包括NPQ的升高[2, 8],叶绿素合成的调节[9],反应中心(reaction center II,RCII)的修复[2, 10]等,可能是高等植物对水分亏缺的适应性反应,防止植物受到光抑制及氧化损伤;而长期干旱胁迫会抑制蛋白合成[1],改变并降低基因转录[11],从而影响PSII的功能。叶绿素荧光动力学参数可以较好地反映PSII结构和功能的变化,逆境胁迫下,耐性作物品种可能具备较高的非光化学淬灭能力,抵御环境改变对PSII的影响,但由于光合器官响应环境变化的机制不同,也存在相反的研究结果[12-13]。【本研究切入点】玉米维管束鞘叶绿体中PSII蛋白复合物的发现,为其光合机理的研究提供了新的思路[14-16],尽管相较叶肉细胞,维管束鞘细胞中PSII含量很少,但其结构组成与叶肉中相似[15-16],会发生光强诱导的周转[16],也可能存在光能调节耗散和蛋白修复循环的光保护机制,但目前尚未有试验证实。【拟解决的关键问题】本研究通过对干旱胁迫下2个玉米品种叶片水分状况和光合能力的比较,发现成单30响应非气孔限制的光合耐旱性更强,进一步分析2种玉米叶肉和维管束鞘细胞中PSII的非光化学淬灭和蛋白复合体水平在干旱胁迫下的变化,以期了解玉米维管束鞘叶绿体是否存在过剩激发能的NPQ机制,明晰叶肉和维管束鞘叶绿体的NPQ水平受干旱诱导变化的差异,探究维管束鞘细胞的非光化学淬灭对玉米光合耐旱能力的意义。
1 材料与方法
1.1 试验材料
供试玉米(L.)品种为成单30和仲玉3号,由四川省农业科学院作物研究所提供。
1.2 材料种植与干旱胁迫处理
试验于2018年在四川省农业科学院高技术育种基地和四川省农业科学院分析测试中心实验室进行。供试玉米材料于基地温室盆栽(60 cm×20 cm×16 cm)种植,播种时间为4月11日。试验所用土壤为基地大田土,土壤类型为砂壤土,pH 6.2—6.9,偏酸性。土壤有机质含量18.7 g·kg-1,碱解氮157 mg·kg-1,有效磷9.7 mg·kg-1,速效钾177 mg·kg-1。播种前施用腐殖酸型水溶复合肥0.12 kg·m-2(N-P2O5-K2O=10-4-6≥20,腐殖酸≥3%)。为保证植株生长条件和干旱胁迫程度的一致性,试验盆中盛装相同重量的供试土壤,且同一试验盆内分区域同时种植2个品种的玉米材料。
玉米营养生长的6叶期(V6)至14叶期(V14),对高温、强光、干旱等影响后期籽粒数和穗大小的逆境胁迫较为敏感,并且苗期的耐旱性可以反映玉米品种的综合耐旱能力[17]。因此,本试验中,在玉米生长的V6期开始通过土壤自然控水进行干旱胁迫处理。干旱胁迫参照张仁和等[12]和郭艳阳等[18],设置3个处理,分别为中度干旱胁迫(moderate drought stress,MS),50%—60%的田间持水量(field water capacity,FWC);重度干旱胁迫(severe drought stress,SS),35%—45% FWC;充足浇水(70%—80% FWC)为对照。供试土壤的FWC为87.83%。每个处理设置4次重复。于开始干旱后的每隔2 d,通过烘干称重法测定各处理组土壤的相对含水量。到达设置的干旱胁迫程度后,通过每天称量盆重保持土壤水分状况[19],干旱持续7 d取倒数第一片完全展开叶测定各项指标。
1.3 测定指标与方法
1.3.1 叶片水分状况和叶绿素含量测定 玉米叶片水分状况通过测定相对含水量(relative water content,RWC)反映。称取1.0 g玉米叶片,称量鲜重(Wf);将叶片放入蒸馏水中浸泡至恒重,称量饱和鲜重(Wt);浸泡后的叶片于80—90℃下烘干至恒重,称量干重(Wd)。叶片相对含水量通过公式RWC =(Wf-Wd)/(Wt - Wd)×100计算。
玉米叶片叶绿素含量根据舒展等[20]的方法,将打孔器制备的1 cm2叶圆片剪成细丝后,用80%丙酮浸提过夜,在645 nm和663 nm波长下测量浸提液吸光值,叶绿素a(Chl a)(μg·mL-1)=12.7 A663-2.69 A645,叶绿素b(Chl b)(μg·mL-1)=22.9 A645-4.68 A663。总叶绿素含量Chl a+b (μg·dm-2)=(Chl a+Chl b)×0.5/S,式中,S为用于提取叶绿素的叶片面积(cm2)。
1.3.2 叶片活性氧测定 测定玉米叶片的超氧阴离子自由基(O2-)和过氧化氢(H2O2)的含量。O2-含量通过商品化试剂盒(泉州市科诺迪生物科技有限公司,中国),采用酶联免疫方法检测;H2O2含量通过商品化试剂盒(南京建成生物工程研究所,中国),采用分光光度计方法检测。
1.3.3 叶片质膜透性检测 测定叶片相对电导率和丙二醛(malondialdehyde,MDA)含量,反映质膜透性。使用电导率仪(DDS-307,成都瑞驰分析控制仪器有限公司,中国)测定叶片的相对电导率。采用硫代巴比妥酸(thiobarbituric acid,TBA)法测定叶片MDA含量。
1.3.4 叶片气体交换测定 采用开放式光合作用仪(CIRAS-3,PP system,英国)测量玉米叶片的气体交换参数,包括气孔导度(s)、蒸腾速率()、胞间CO2浓度(i)和净光合速率()。测量光强为300 µmol·m-2·s-1的人工光源。
1.3.5 叶片叶绿素荧光显微观测 采用叶绿素荧光动力学显微成像分析系统(chlorophyll fluorescence kinetic microscope,FKM)(Micro-FluorCam FC2000,Photon Systems Instruments,捷克)测定玉米叶肉和维管束鞘细胞PSII的叶绿素荧光参数,包括最大光化学效率Fv/Fm和非光化学淬灭NPQ。将玉米叶片切成细丝,以横切面放置于40×物镜下,通过470 nm蓝光激发后,采用FKM在695—770 nm下进行叶绿素荧光显微成像观测。荧光成像完成后,采用FKM分析软件,标定区域对叶肉和维管束鞘细胞的荧光参数进行分析。
1.3.6 类囊体膜蛋白的提取分离 玉米叶肉和维管束鞘细胞类囊体膜蛋白的提取分离参照Romanowska等[21]的方法。提取过程在4℃弱光下进行,提取缓冲液为50 mmol·L-1HEPES-NaOH(pH 8.0),5 mmol·L-1MgCl2,10 mmol·L-1NaCl,2 mmol·L-1EDTA,10 mmol·L-1NaF,0.2%(w/v)BSA,采用机械分离法分离叶肉和维管束鞘类囊体膜蛋白,将分离后的样品迅速冻存于-80℃备用。通过测量2种类囊体膜蛋白中叶绿素a/b比率(Chl a/b),检验分离纯度。
1.3.7 尿素-SDS-PAGE电泳和Western杂交分析 参照Pokorska等[16]的方法,稍加改进。分离后的玉米叶肉和维管束鞘类囊体膜蛋白中加入含0.05 mol·L-1Tris-HCl(pH 6.8),5%(w/v)SDS,8 mol·L-1尿素,5%(v/v)β-巯基乙醇和20%(v/v)甘油的样品缓冲液,通过加入3 mol·L-1尿素15%分离胶的尿素-SDS-聚丙烯酰胺凝胶电泳(尿素-SDS-PAGE)分离,各处理组样品以相同叶绿素含量(叶肉细胞1.0 μg,维管束鞘细胞1.5 μg)上样。
电泳分离后的蛋白,电转仪到PVDF膜(Immobilon,Millipore,美国)上,通过特异抗体(Agrisera,瑞典)的免疫印迹(Western blotting),分析蛋白的稳态水平。Western blotting信号通过化学发光法(ECL,GE Healthcare,英国)检测,定量结果通过Lane 1D凝胶软件(北京赛智创业科技有限公司,中国)分析。相同上样量电泳的考马斯亮蓝染色结果作为参照。
1.3.8 蓝-绿胶温和电泳 参照Pokorska等[16]的方法,略有改进,对分离后的玉米叶肉和维管束鞘细胞中类囊体膜蛋白复合体进行非变性的蓝-绿胶温和电泳(Blue native PAGE,BN-PAGE)分析。15 μg叶绿素含量的类囊体膜蛋白在4°C,7 000×下离心5 min后,重溶于25 mmol·L-1BisTris-HCl(pH 7.0),20%(v/v)甘油中,加入十二烷基-β-D-麦芽糖苷(DDM)增溶,使其在叶肉和维管束鞘类囊体膜蛋白溶液中的终浓度分别为1%和2%。增溶后的蛋白溶液在4 °C,18 000×下离心15 min后,上清液中加入含5%(w/v)考马斯亮蓝G250,100 mmol·L-1BisTris-HCl(pH 7.0),30%(w/v)蔗糖,500 mmol·L-1氨基己酸的样品缓冲液,于4%—12%丙烯酰胺梯度胶电泳下分离。电泳分离后的凝胶照相后,参照Witting等[22]的方法,对分离条带进行特异抗体的免疫印记分析,蛋白复合体定量结果通过Lane 1D凝胶软件分析。
1.3.9 数据统计分析 应用SPSS17.0统计软件,采用Duncan’s新复极差法的单因素方差分析,评估1个玉米品种在不同程度干旱胁迫下的差异;采用独立样本的t检验,评估相同干旱胁迫程度下,2个玉米品种间的差异。
2 结果
2.1 干旱胁迫对2个玉米品种叶片水分状况、叶绿素含量、活性氧积累和质膜透性的影响
通过土壤自然控水对成单30和仲玉3号玉米进行不同程度的干旱胁迫处理,包括充足浇水对照(CK),中度干旱胁迫(MS)和重度干旱胁迫(SS)。如图1所示,玉米叶片相对含水量(RWC)随干旱胁迫发生持续下降,重度干旱胁迫导致叶片叶绿素含量降低,O2-和H2O2明显积累,质膜透性显著增加,2个玉米品种的表现存在差异。重度干旱胁迫后,成单30和仲玉3号的RWC较对照分别下降了26.07%和35.62%(图1-B);相较成单30较稳定的叶绿素含量,仲玉3号的叶绿素水平受干旱胁迫影响下降更明显(图1-C);干旱胁迫会造成植物叶片活性氧(reactive oxygen species,ROS)(包括O2-,1O2,H2O2,.OH等)的积累,如图1-D和图1-E所示,重度干旱胁迫下,成单30 中O2-和H2O2含量较对照升高了213.99%和215.21%,仲玉3号中O2-和H2O2含量较对照升高了444.40%和264.60%,干旱导致仲玉3号中ROS的积累更显著;ROS积累造成膜脂过氧化,导致细胞质膜透性增加,相较成单30,仲玉3号叶片的相对电导率和MDA含量在干旱胁迫后上升更明显(图1-F和图1-G);干旱胁迫后,仲玉3号的叶片表型较成单30更萎蔫(图1-A)。
2.2 2个玉米品种叶片的气体交换对干旱胁迫的响应
干旱胁迫导致玉米叶片气孔导度和蒸腾速率下降,下降程度在2个品种间没有明显差异(图2-A,B);中度干旱胁迫没有造成叶片胞间CO2浓度的明显变化,但重度干旱胁迫下,2个玉米品种的胞间CO2浓度均明显增加,相较成单30,仲玉3号的增加程度更为显著(图2-C);干旱胁迫造成玉米叶片净光合速率下降,中度和重度干旱胁迫下,成单30的净光合速率较对照分别下降了22.55%和73.79%,仲玉3号下降了34.20%和87.08%,仲玉3号的净光合速率受干旱抑制更为明显(图2-D)。
2.3 干旱胁迫下2个玉米品种维管束鞘叶绿体的NPQ水平变化
叶绿素荧光显微成像结果(图3-A和图4-A)显示,干旱胁迫,尤其是重度干旱胁迫,导致玉米叶片中叶肉和维管束鞘细胞组成的“花环”结构排列发生一定程度松散,在仲玉3号中表现尤为明显。
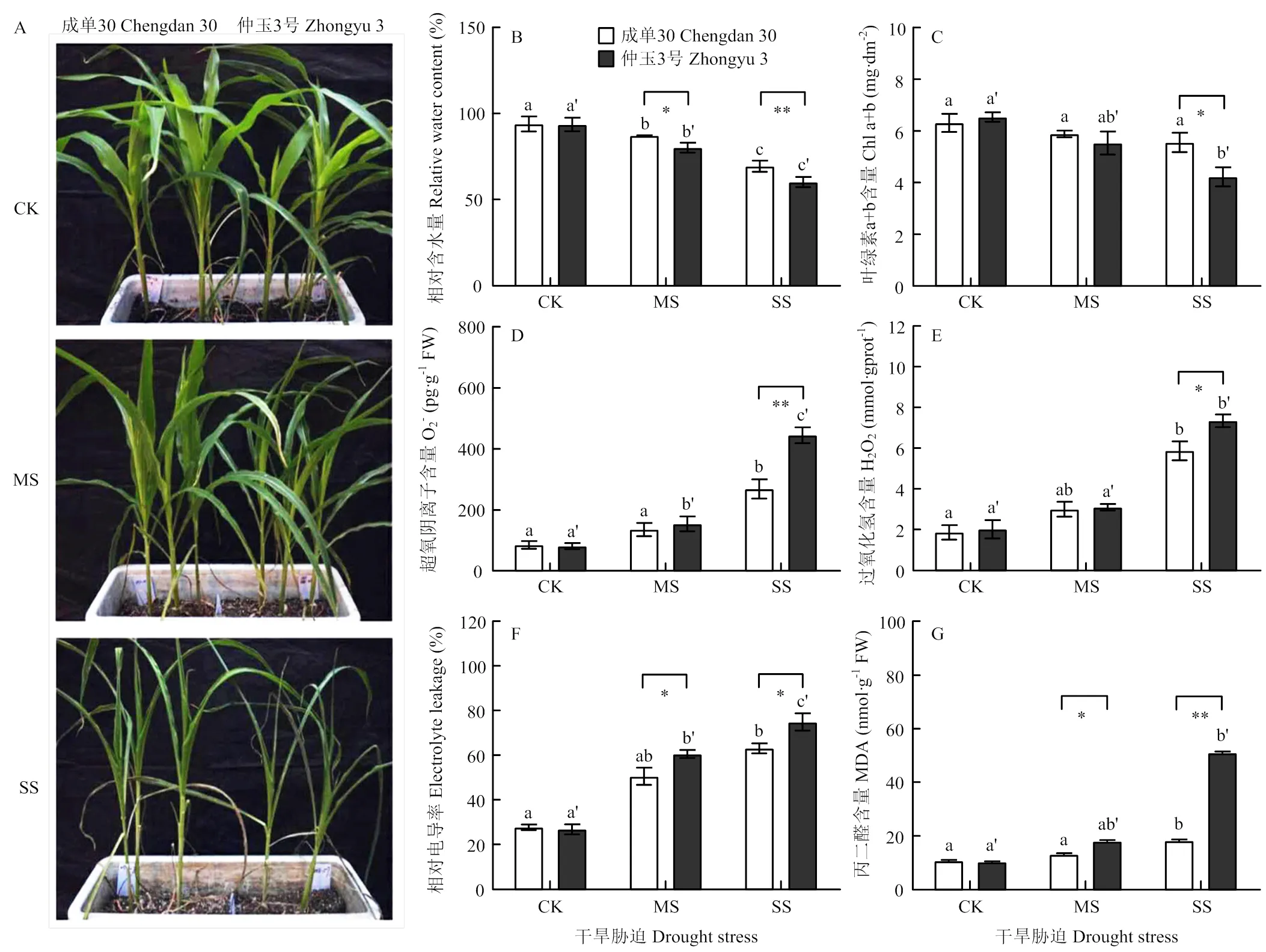
A:表型观察;B:相对含水量(RWC);C:叶绿素a+b(Chl a+b)含量;D:超氧阴离子(O2-)含量;E:过氧化氢(H2O2)含量;F:相对电导率;G:丙二醛(MDA)含量。CK,充足浇水对照;MS,中度干旱胁迫;SS,重度干旱胁迫。误差线代表4次测量平均值的标准差。不同小写字母表示一个玉米品种在不同程度干旱胁迫下,P<0.05时有显著性差异。*和**分别表示2个玉米品种间在相同程度干旱胁迫下,P<0.05和P<0.01时有显著性差异。下同
叶绿素荧光参数中,Fv/Fm表示PSII的最大光能转换效率,是反映植物光抑制程度最常用的指标。如图3-B所示,中度干旱胁迫没有造成叶肉叶绿体中Fv/Fm的明显变化,但重度干旱胁迫下,叶肉叶绿体中Fv/Fm水平显著下降,其中,仲玉3号的下降程度较成单30更为明显,表明仲玉3号叶肉细胞中PSII的光能转换受干旱抑制更为显著。维管束鞘叶绿体的Fv/Fm在中度干旱胁迫下即发生明显降低,与叶肉细胞中表现一致,干旱胁迫对仲玉3号维管束鞘叶绿体Fv/Fm的影响更明显。
图4显示,随着干旱胁迫程度的加重,玉米叶肉和维管束鞘叶绿体的NPQ水平均逐渐升高,其中,维管束鞘中的升高更为显著(图4-B)。2个品种间比较,重度干旱胁迫下,成单30叶肉叶绿体的NPQ水平较仲玉3号升高程度更明显,其维管束鞘叶绿体的NPQ水平在充足浇水时较仲玉3号高,干旱胁迫发生后,NPQ的上升也较仲玉3号更显著。
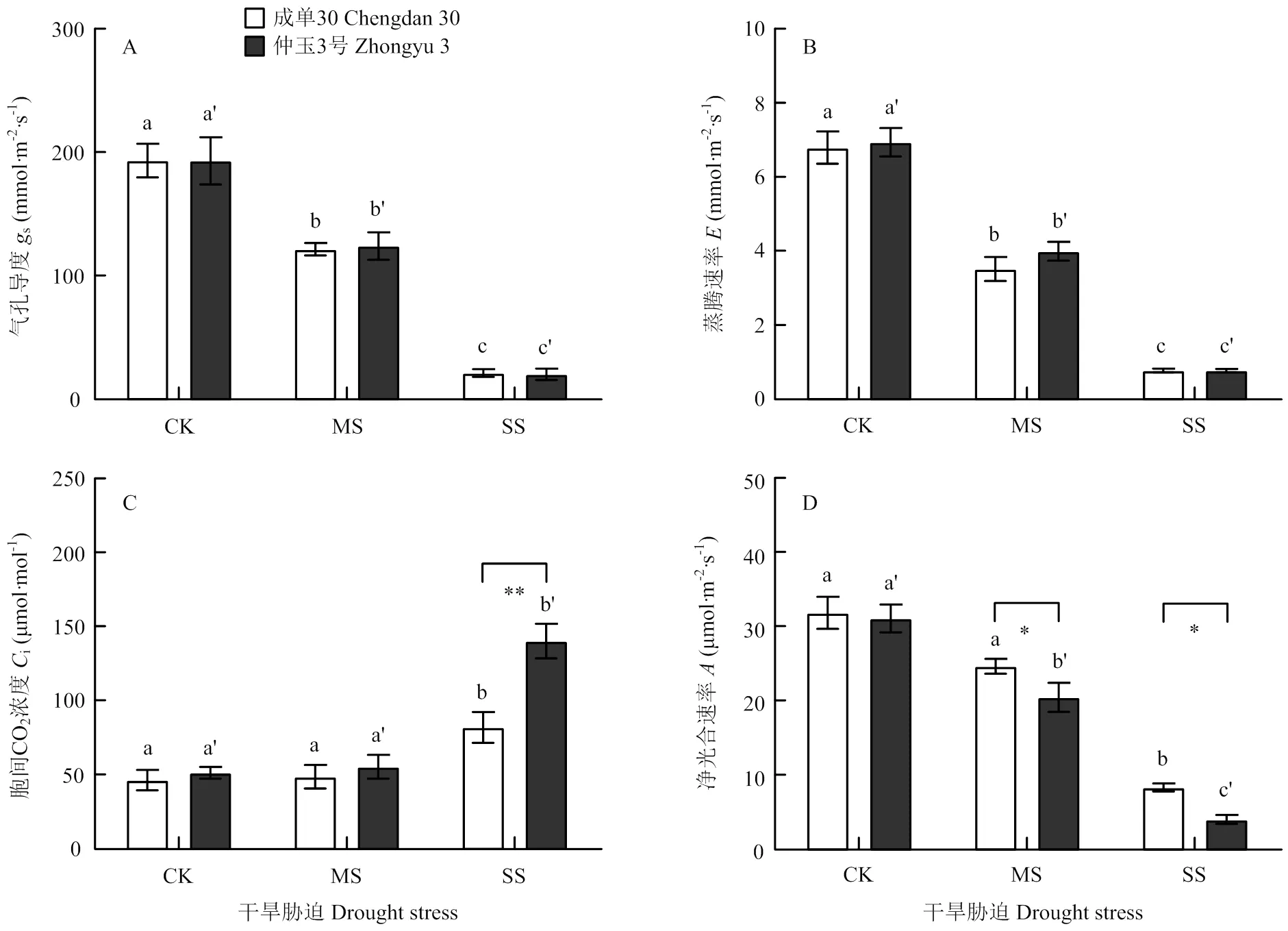
A:气孔导度(gs);B:蒸腾速率(E);C:胞间CO2浓度(Ci);D:净光合速率(A)
2.4 干旱胁迫对2个玉米品种PsbS蛋白稳态水平的影响
根据Romanowska和Parys的方法描述,分离了叶肉细胞的维管束鞘类囊体膜蛋白中Chl a/b应高于4.5[21]。本试验对2个玉米品种的叶肉和维管束鞘类囊体膜蛋白进行机械分离,测定2种类囊体中Chl a/b分别为2.62—3.25和4.70—4.90,表明蛋白分离结果有效。
类囊体膜蛋白提取分离后,特异抗体的免疫印迹分析结果(图5)显示,干旱胁迫导致玉米2种类型细胞中PSII亚基S(PsbS)蛋白稳态水平均有所升高,维管束鞘细胞中的升高更显著。比较2个玉米品种,充足浇水时,成单30维管束鞘细胞PsbS蛋白稳态水平较仲玉3号更高,干旱胁迫后PsbS蛋白增加也更明显;重度干旱胁迫下,成单30 2种细胞中PsbS蛋白含量均明显高于仲玉3号,维管束鞘尤为显著,2个品种较充足浇水对照分别增加了159.52%和127.32%。
2.5 干旱胁迫对2个玉米品种PSII蛋白复合体的影响
类囊体膜上,PSII以二聚体和单体形式存在。PSII二聚体连接至少2个LHCII三聚体,组成PSII-LHCII超复合体(PSII-LHCII supercomplexes)发挥功能。类囊体膜蛋白复合体的BN-PAGE电泳结果(图6)显示,与前人研究结果一致,玉米叶肉和维管束鞘细胞中PSII蛋白复合体组成类似,包括PSII-LHCII超复合体、PSII二聚体和单体以及LHCII三聚体和单体[15-16]。重度干旱胁迫导致PSII-LHCII超复合体发生一定程度的解聚,叶肉细胞中更为明显。仲玉3号叶肉细胞中,PSII二聚体和单体以及LHCII三聚体和单体水平均受干旱胁迫诱导明显下降,但成单30叶肉细胞中LHCII三聚体水平则在重度干旱胁迫后有所上升(图6-C);维管束鞘细胞中蛋白复合体水平较叶肉细胞稳定,重度干旱胁迫下,成单30的维管束鞘细胞也发生LHCII三聚体水平的升高(图6-D)。

A:叶肉和维管束鞘叶绿体NPQ成像;B:叶肉和维管束鞘叶绿体NPQ数据分析

A:叶肉细胞PsbS蛋白免疫印迹(1.0 μg叶绿素);B:维管束鞘细胞PsbS蛋白免疫印迹(1.5 μg叶绿素);C:叶肉细胞PsbS蛋白免疫印迹数据分析(充足浇水条件下成单30叶肉细胞的PsbS蛋白水平定义为100%);D:维管束鞘细胞PsbS蛋白免疫印迹数据分析(充足浇水条件下成单30维管束鞘细胞的PsbS蛋白水平定义为100%)。蛋白样品的考马斯亮蓝染色(CBS)结果作为参照
3 讨论
本文选择成单30和仲玉3号2个玉米品种,通过对不同程度干旱胁迫下玉米叶片水分生理、光合水平以及叶绿素荧光参数的分析,比较了2种玉米在营养生长时期的光合耐旱能力。结果发现,试验设置的中度干旱胁迫没有显著影响玉米叶片细胞膜的完整性和PSII的光能转换效率,气孔因素是中度干旱胁迫下玉米CO2同化速率下降的主要原因。成单30和仲玉3号的气孔导度及蒸腾速率的下降程度没有明显差异,表明2种玉米对干旱胁迫的气孔响应能力相似。而重度干旱胁迫下,相较成单30,仲玉3号叶片的色素水平、ROS积累以及PSII光能转换受干旱影响更为明显,胞间CO2浓度上升更为显著,净光合速率下降更为严重,显示干旱胁迫对仲玉3号光合效率的非气孔限制较成单30更显著,成单30的耐旱性更强。
当2个玉米品种的光合机构对干旱胁迫的气孔响应能力相当时,非气孔限制下的光保护能力可能对玉米的耐旱性具有重要意义。NPQ是PSII响应环境变化最快速的保护机制,玉米的叶肉和维管束鞘细胞中均含有叶绿体,分别考量2种类型叶绿体中NPQ水平对干旱胁迫的响应,是本文的研究重点。由于叶肉细胞致密包裹在维管束鞘细胞周围,因此以完整叶片为对象的叶绿素荧光分析,无法测量玉米维管束鞘叶绿体的叶绿素荧光[16];叶绿素荧光的体外测量,其准确性也可能受到叶肉和维管束鞘叶绿体的提取过程和分离纯度影响。叶绿素荧光动力学显微成像(FKM)目前主要应用于藻类研究[23],最近也有用以分析植物维管束鞘叶绿素荧光的报道[24]。本研究中,采用FKM技术比较了干旱胁迫下玉米2种细胞中的叶绿素荧光变化,不仅在维管束鞘细胞中检测到NPQ,并且发现,与叶肉细胞中相同,随着干旱胁迫程度的加重,维管束鞘细胞中NPQ水平显著上升。更加值得注意的是,相较叶肉细胞,维管束鞘NPQ受干旱诱导升高趋势更明显,表明该细胞中可能具有更优越的过剩光能的非光化学淬灭能力。并且,耐旱性更强的成单30NPQ水平高于仲玉3号,维管束鞘中更为突出,进一步提示维管束鞘叶绿体的NPQ机制可能对玉米非气孔限制的光合耐旱能力有积极的意义。
NPQ精准的淬灭位点和淬灭机制,目前尚有争议[25],最近的研究结果推断,其发生至少需要3个因素,分别为类囊体内腔质子梯度(ΔpH),LHCII以及PsbS蛋白[26]。由于在NPQ机制中的开关(switch)作用,PsbS蛋白被称为植物的光保护蛋白。研究表明,PsbS蛋白的表达受光强变化调控[27];其含量会显著影响NPQ中能量依赖性淬灭(energy-dependent quenching,qE)的水平[6];相较过表达PsbS的突变体,缺失PsbS蛋白的拟南芥在强光照射下光抑制程度更明显[28]。这些都为逆境下提高植物的光保护能力提供思路[29]。本研究发现,干旱胁迫诱导玉米PsbS蛋白稳态水平升高,这与之前在拟南芥[8]和小麦[13]中的发现一致,更重要的是,维管束鞘细胞中PsbS的升高更显著,成单30中尤为明显,体现出与NPQ水平一致的变化趋势,进一步反映成单30维管束鞘细胞可能具有更强的过剩光能非光化学淬灭能力。我们之前的研究表明,干旱胁迫下非气孔限制会造成PSII-LHCII超复合体解聚,PSII蛋白水平下调,进一步降低光能转换效率和CO2同化速率[3, 8, 10]。本研究发现,重度干旱胁迫下玉米PSII蛋白复合体水平下降,叶肉细胞中更为明显。有趣的是,耐旱能力更强的成单30,LHCII三聚体水平在重度干旱胁迫下发生一定程度的升高,由于LHCII被推测可能是非光化学淬灭的位点[26],因此该现象是否与成单30更强的NPQ能力相关,值得进一步探索。
玉米维管束鞘中更优越的NPQ能力与细胞结构和功能的关联,值得探讨。玉米的光合作用由2种细胞协同完成,维管束鞘细胞具有无机碳的浓缩机制,是CO2同化的主要场所[30]。研究证实,光能过剩时,至少部分非光化学淬灭,为阻止PSII中ROS释放而被调控[31-32]。因此,维管束鞘细胞的NPQ机制,一定程度上可能通过抑制ROS的积累,保持细胞膜的完整,有利于维持维管束鞘中CO2的浓度和同化速率,对逆境下玉米的光合效率有益。此外,维管束鞘细胞连接叶肉细胞与维管组织,其结构的完整和功能的稳定,对干旱胁迫下植物叶片水分和营养的保持与疏导,也具有重要意义。这一点表现在无论是中度还是重度干旱胁迫下,相较仲玉3号,成单30的叶片水分状况均更好。
4 结论
通过叶绿素荧光动力学显微观测,发现玉米叶肉和维管束鞘叶绿体中均存在过剩光能的非光化学淬灭(NPQ)。比较2个玉米品种,相较仲玉3号,成单30非气孔响应的光合耐旱性更强,其叶绿体,尤其是维管束鞘叶绿体的NPQ水平更高。干旱胁迫下,2种叶绿体中NPQ水平的上升均伴随着光保护蛋白PsbS含量的增加,但成单30维管束鞘细胞中PsbS的增加更明显,与NPQ的变化趋势一致,提示PsbS蛋白可能具备辅助叶绿素荧光等参数,作为耐旱作物选育分子标记的可行性。
[1] YUAN S, LIU W J, ZHANG N H, WANG M B, LIANG H G, LIN H H. Effects of water stress on major PSII gene expression and protein metabolism in barley leaves., 2005, 125(4): 464-473.
[2] LIU W J, CHEN Y E, TIAN W J, DU J B, ZHANG Z W, XU F, ZHANG F, YUAN S, LIN H H. Dephosphorylation of photosystem II proteins and phosphorylation of CP29 in barley photosynthetic membranes as a response to water stress., 2009, 1787(10): 1238-1245.
[3] CAMPOSA H, TREJOB C, PEÑA-VALDIVIA C B, GARCIA-NAVA R, CONDE-MARTINEZ F V, CRUZ-ORTEGA M R. Stomatal and non-stomatal limitations of bell pepper (L.) plants under water stress and re-watering: Delayed restoration of photosynthesis during recovery., 2014, 98(1): 56-64.
[4] KRAMER D M, EVANS J R. The importance of energy balance in improving photosynthetic productivity., 2011, 155(1): 70-78.
[5] TIKKANEN M, ARO E M. Thylakoid protein phosphorylation in dynamic regulation of photosystem II in higher plants., 2012, 1817(1): 232-238.
[6] KROMDIJK J, GLOWACKA K, LEONELLI L, GABILLY S T, IWAI M, NIYOGI K K, LONG S P. Improving photosynthesis and crop productivity by accelerating recovery from photoprotection., 2016, 354(6314): 857-861.
[7] GRIFFITHS H, PARRY M. Plant responses to water stress., 2002, 89(7): 801-802.
[8] CHEN Y E, LIU W J, SU Y Q, CUI J M, ZHANG Z W, YUAN M, ZHANG H Y, YUAN S. Different response of photosystem II to short and long term drought stress in., 2016, 158(2): 225-235.
[9] VIRGIN H I. Chlorophyll formation and water deficit., 1965, 18(4): 994-1000.
[10] BAENA-GONZALEZ E, BARBATO R, ARO E M. Role of phosphorylation in the repair cycle and oligomeric structure of photosystem II., 1999, 208(2): 196-204.
[11] LIU W J, YUAN S, ZHANG N H, LEI T, DUAN H G, LIANG H G, LIN H H. Effect of water stress on photosystem 2 in two wheat cultivars., 2006, 50(4): 597-602.
[12] 张仁和, 郑友军, 马国胜, 张兴华, 路海东, 史俊通, 薛吉全. 干旱胁迫对玉米苗期叶片光合作用和保护酶活性的影响. 生态学报, 2011, 31(5): 1303-1311.
ZHANG R H, ZHENG Y J, MA G S, ZHANG X H, LU H D, SHI J T, XUE J Q. Effect of drought stress on photosynthetic traits and protective enzyme activity in maize seeding., 2011, 31(5): 1303-1311. (in Chinese)
[13] CHEN Y E, SU Y Q, ZHANG C M, MA J, MAO H T, YANG Z H, YUAN M, ZHANG Z W, YUAN S, Zhang H Y. Comparison of photosynthetic characteristics and antioxidant systems in different wheat strains., 2018, 37(2): 347-359.
[14] ROMANOWSKA E, DROZAK A, POKORSKA B, SHIELL B J, MICHALSKI W P. Organization and activity of photosystems in the mesophyll and bundle sheath chloroplasts of maize., 2006, 163(6): 607-618.
[15] ROMANOWSKA E, KARGUL J, POWIKROWSKA M, FINAZZI G, NIELD J, DROZAK A, POKORSKA B. Structural organization of photosynthetic apparatus in agranal chloroplasts of maize., 2008, 283(38): 26037-26046.
[16] POKORSKA B, ZIENKIEWICZ M, POWIKROWSKA M, DROZAK A, ROMANOWSKA E. Differential turnover of the photosystem II reaction centre D1 protein in mesophyll and bundle sheath chloroplasts of maize., 2009, 1787(10): 1161-1169.
[17] 裴英杰, 郑家玲, 庾红, 王金胜, 丁起盛, 郭栋生, 郭春绒. 用于玉米品种抗旱性鉴定的生理生化指标. 华北农学报, 1992, 7(1): 31-35.
PEI Y J, ZHENG J L, YU H, WANG J S, DING Q S, GUO D S, GUO C R. The indexes of physiology and biochemistry used for appraisal and level determination of drought resistance in maize., 1992, 7(1): 31-35. (in Chinese)
[18] 郭艳阳, 刘佳, 朱亚利, 柏延文, 李红杰, 薛吉全, 张仁和. 玉米叶片光合和抗氧化酶活性对干旱胁迫的响应. 植物生理学报, 2018, 54(12): 1839-1846.
GUO Y Y, LIU J, ZHU Y L, BAI Y W, LI H J, XUE J Q, ZHANG R H. Responses of photosynthetic and antioxidant enzyme activities in maize leaves to drought stress., 2018, 54(12): 1839-1846. (in Chinese)
[19] 刘亚, 丁俊强, 苏巴钱德, 廖登群, 赵久然, 李建生. 基于远红外热成像的叶温变化与玉米苗期耐旱性的研究. 中国农业科学, 2009, 42(6): 2192-2201.
LIU Y, DING J Q, SUBHASH C, LIAO D Q, ZHAO J R, LI J S. Identification of maize drought-tolerance at seeding stage based on leaf temperature using infrared thermography., 2009, 42(6): 2192-2201. (in Chinese)
[20] 舒展, 张晓素, 陈娟, 陈根云, 许大全. 叶绿素含量测定的简化. 植物生理学通讯, 2010, 46 (4): 399-402.
SHU Z, ZHANG X S, CHEN J, CHEN G Y, XU D Q. The simplification of chlorophyll content measurement., 2010, 46 (4): 399-402. (in Chinese)
[21] ROMANOWSKA E, PARYS E. Mechanical isolation of bundle sheath cell strands and thylakoids from leaves of C4grasses., 2011, 684: 327-337.
[22] WITTIG I, BRAUN H P, SCHÄGGER H. Blue native PAGE., 2006, 1(1): 418-428.
[23] FERIMAZOVA N, FELCMANOVÁ K, ŠETLÍKOVÁ E, KÜPPER H, MALDENER I, HAUSKA G, ŠEDIVÁ B, PRÁŠIL O. Regulation of photosynthesis during heterocyst differentiation in Anabaena sp. strain PCC 7120 investigatedat single-cell level by chlorophyll fluorescence kinetic microscopy., 2013, 116(1): 79-91.
[24] GORECKA M, ALVAREZ-FERNANDEZ R, SLATTERY K, MCAUSLAND L, DAVEY P A, KARPINSKI S, LAWSON T, MULLINEAUX P M. Abscisic acid signalling determines susceptibility of bundle sheath cells to photoinhibition in high light-exposedleaves., 2014, 369(1640): 20130234.
[25] DUFFY C D P, RUBAN A V. Dissipative pathways in the photosystem-II antenna in plants., 2015, 152: 215-226.
[26] RUBAN, ALEXANDER V. Nonphotochemical chlorophyll fluorescence quenching: mechanism and effectiveness in protecting plants from photodamage., 2016, 170(4): 1903-1916.
[27] BALLOTTARI M, DALL'OSTO L, MOROSINOTTO T, BASSI R. Contrasting behavior of higher plant photosystem I and II antenna systems during acclimation., 2007, 282(12): 8947-8958.
[28] ROACH T, KRIEGER-LISZKAY A. The role of the PsbS protein in the protection of photosystems I and II against high light in., 2012, 1817(12): 2158-2165.
[29] GLOWACKA K, KROMDIJK J, KUCERA K, XIE J Y, CAVANAGH A P, LEONELLI L, LEAKEY A D B, ORT D R, NIYOGI K K, LONG T P. Photosystem II ubnit S overexpression increases the efficiency of water use in a field-grown crop., 2018, 9(1): 868.
[30] EL-SHARKAWY M A. Pioneering research on C4leaf anatomical, physiological, and agronomic characteristics of tropical monocot and dicot plant species: Implications for crop water relations and productivity in comparison to C3cropping systems., 2009, 47(2): 163-183.
[31] WARE M A, BELGIO E, RUBAN A V. Comparison of the protective effectiveness of NPQ inplants deficient in PsbS protein and zeaxanthin., 2015, 66(5): 1259-1270.
[32] ZULFUGAROV I S, TOVUU A, EU Y J, DOGSOM B, POUDYAL R S, NATH K, HALL M, BANERJEE M, YOON U C, MOON Y H, AN G, JANSSON S, LEE C H. Production of superoxide from Photosystem II in a rice (L.) mutant lacking PsbS., 2014, 14(1): 242.
Response of non-photochemical quenching in bundle sheath chloroplasts of two maize hybrids to drought stress
LIU WenJuan1, CHANG LiJuan1, YUE LiJie2, SONG Jun1, ZHANG FuLi1, WANG Dong1, Wu jiaWei1, GUO LingAn1, LEI ShaoRong1
(1Center of Analysis and Testing, Sichuan Academy of Agricultural Sciences, Chengdu 610066;2Crop Research Institute, Sichuan Academy of Agricultural Sciences, Chengdu 610066)
【Objective】 Non-photochemical chlorophyll fluorescence quenching (NPQ) of photosystem II (PSII) is the most rapid photoprotective mechanism of higher plants that responds to a changing environment. Maize has two distinctly different classes of chloroplasts in mesophyll and bundle sheath cells. In the present study, the drought tolerance of two maize hybrids was compared to explore the significance of non-photochemical quenching in bundle sheath chloroplasts to maize tolerance. 【Method】 The experiment was conducted with two maize hybrids, Chengdan 30 and Zhongyu 3, and consisted of three soil moisture regimes, including 70%-80% of field water capacity (FWC) (sufficient irrigation), 50%-60% FWC (moderate drought stress), and 35%-45% FWC (severe drought stress). Physiological and biochemical parameters of maize leaves, including relative water content, chlorophyll contents, reactive oxygen species (ROS) accumulation, lipid peroxidation, and gas exchange, were measured. Fv/Fm and NPQ of PSII in mesophyll and bundle sheath chloroplasts of two maize hybrids were investigated through a chlorophyll fluorescence kinetic microscope. The steady-state levels of PSII subunit S (PsbS) in mesophyll and bundle sheath cells were analyzed using method of western blotting. PSII complexes levels were detected by blue native PAGE. 【Result】 The stomatal conductance and transpiration rate of maize leaves decreased under drought stress. There were no remarkably difference in decline degree of stomatal index between Chengdan 30 and Zhongyu 3. However, under severe drought conditions, Chengdan 30 showed better leaf water status, lower ROS damages, and higher photosynthetic efficiency compared with Zhongyu 3. NPQ levels and PsbS contents in bundle sheath chloroplasts increased more markedly than that in mesophyll chloroplasts when maize plant suffered with drought treatment, which was especially outstanding in Chengdan 30. The PSII complexes contents of Zhongyu 3 reduced obviously under drought stress, while the steady-state levels of light-harvesting complex II (LHCII) trimer of Chengdan 30 enhanced after severe drought. 【Conclusion】 The responses of photosynthetic mechanism to stomatal limitation were no significant difference in two maize hybrids under drought stress. However, compared with Zhongyu 3, Chengdan 30 had a higher non-photochemical quenching capacity in bundle sheath chloroplasts, which might play a positive influence on its superior drought tolerance of non-stomatal limitation.
maize; drought stress; bundle sheath cells; photosystem II; non-photochemical quenching
2019-09-04;
2019-12-11
四川省科技计划项目“应用基础研究”(2018JY0153)、四川省农业科学院青年领军人才研究基金(2019LJRC025)、四川省财政基因工程青年基金项目(2018QNJJ-023)
刘文娟,E-mail:lwj19790628@sina.com
(责任编辑 杨鑫浩)

