熊果酸对甲状腺癌TPC-1细胞增殖的抑制作用
侯东升,张 静,冯 丽,张晶晶,王 颖
0 引 言
熊果酸又称乌索酸,是一种五环三萜类化合物,以游离或结合成苷的形式广泛存在于多种药用植物中[1],在镇静、抗炎、杀菌、降糖、抗溃疡等方面均有一定作用[2]。有研究发现熊果酸在抑制 HL-60细胞增殖、诱导其凋亡方面效果显著,能增强小鼠的巨噬细胞吞噬能力[3]。其抗肿瘤作用也逐渐引起人们的重视。目前在抗乳腺癌、肝癌、胃癌等方面的研究得到广泛开展并取得了一定的研究进展,已成为防治肿瘤的研究热点。 本研究旨在探究熊果酸对甲状腺乳头状癌TPC-1细胞增殖、凋亡途径方面的影响, 以期为甲状腺癌的防治寻找一种新的可行性方案。
1 材料与方法
1.1 实验材料及细胞株熊果酸(索莱宝公司);DMEM培养基(美国Gibco公司);胎牛血清(澳洲AusGeneX公司);二甲基亚砜(美国Sigma公司);0.25%胰蛋白酶消化液(美国Gibco公司);磷酸盐缓冲液(PBS,美国Gibco公司);CCK8试剂盒(日本同仁公司);细胞凋亡检测试剂盒(武汉联科生物公司);JC-1试剂盒(碧云天生物技术公司);活性氧检测试剂盒(碧云天生物技术公司);总RNA提取试剂盒(天根生化科技有限公司);PCR反转录试剂盒(宝日医生物技术有限公司);PCR扩增试剂盒(宝日医生物技术有限公司);甲状腺乳头状癌TPC-1细胞(武汉普诺赛生命科技有限公司)。
1.2 CCK-8试剂检测细胞增殖抑制率待细胞生长至对数期,胰蛋白酶室温消化3~5 min,加入适量培养液终止消化后离心收集细胞。将收集到的细胞用培养液重悬,调整细胞浓度为4000~6000个/mL,以每孔100 μL接种至96孔板,置于培养箱中继续培养。细胞贴壁后弃原培养基,分别加入不含胎牛血清的不同浓度的熊果酸培养基(浓度分别为0、2、4、8、16、32 μmol/L,其中以0 μmol/L为对照),再以不含细胞的培养基为空白组,每组设6个复孔,置于培养箱中继续培养。分别于24 h、48 h后终止培养,每孔加CCK-8溶液10 μL,继续孵育2~4 h。用酶标仪检测 450 nm 下的各孔吸光度(A)值,再根据所得到的吸光度值,细胞抑制率计算公式如下:
增殖抑制率=(对照组A-实验组A)/(对照组A-空白组A)×100%
以上实验重复3次,计算药物半抑制浓度(IC50)。
1.3 流式细胞术检测细胞凋亡将生长至对数期的细胞按6×104个/mL的浓度种植于无菌6孔板中培养,当细胞融合至70%~80%时,更换无胎牛血清的不同浓度的熊果酸培养基(浓度分别为0、4、8 μmol/L)处理24 h。用不含EDTA 胰蛋白酶消化细胞,离心收集细胞。按试剂盒使用说明书用Annexin V 及PI 标记细胞。采用流式细胞仪对样品进行检测,TPC-1细胞凋亡率计算如下:
TPC-1细胞凋亡率=[细胞总凋亡率(%)=B2象限细胞比例(%)+ B4象限细胞比例(%)
1.4 JC-1试剂盒测线粒体膜电位将生长至对数期的细胞按6×104个/mL的浓度种植于无菌6孔板中培养, 当细胞融合至70%~80%时,更换无胎牛血清的不同浓度的熊果酸培养基(浓度分别为0、4、8 μmol/L)处理24 h。按试剂盒使用说明书用JC-1染色缓冲液(1×)处理细胞。 采用荧光显微镜观察细胞。
1.5 活性氧检测试剂盒测细胞内活性氧水平细胞内活性氧的相对含量以 DCF的荧光强度表示。将生长至对数期的细胞按6×104个/mL的浓度种植于无菌6孔板中培养,当细胞融合至70%~80%时,更换无胎牛血清的不同浓度的熊果酸培养基(浓度分别为0、4、8 μmol/L)处理24 h。将DCFH-DA试剂用无血清培养液稀释1000倍至10 μmol/L,按试剂盒使用说明书用稀释好的DCFH-DA试剂处理细胞。采用荧光显微镜观察细胞并拍照。
1.6 流式细胞术测蛋白表达将对数期细胞胰酶消化后制备成单细胞悬液,加培养液将细胞浓度调整为6×104个/mL,接种于6孔板中继续培养,当细胞融合至孔底70%~80%时,弃去旧培养基,分别加入不含胎牛血清的不同浓度的熊果酸培养基(浓度分别为0、4、8 μmol/L)处理24 h。胰蛋白酶消化收集细胞,离心机(京立LDZ5-2型离心机)1000 r/min,离心5 min,离心半径15 cm。用75%冰乙醇将细胞固定20 min后离心,PBS洗两遍。3% BSA封闭细胞1 h,每半小时混匀一次。将处理好的细胞离心,PBS洗一遍,计数细胞。按抗体使用说明书加入比率一抗,做好阴性对照,室温孵育1 h,每半小时混匀一次。再次离心细胞去除上清液,PBS洗涤两遍。在光线较暗的房间用PBS按1∶1500比例稀释荧光素标记的二抗,每孔加150 μL,在暗室孵育1 h,每半小时混匀一次。离心细胞去上清,PBS洗一遍,加入150 μL的PBS混匀上机。 检测各组细胞的荧光强度。
1.7RT-PCR法测mRNA的表达情况用熊果酸对TPC-1细胞干预24h后,按提取试剂盒说明提取各组细胞RNA;按反转录盒使用说明书对提取的各组RNA进行处理,反转录生成cDNA,引物分别为:存活素上游:5′- GGACCACCGCATCTCTACATTC-3′,下游5′-CCGCAGTTTCCTCAAATTCTTTC-3′,VEGF上游5′- GAGGCTCCAGGGCATT AGAC-3′,下游5′-TCACCAAGGCCAGCA CATAG-3′,GAPDH上游5′-GGAAGCTTG TCATCAATGGAAATC-3′,下游5′-TGATG ACCCTTTTGGCTCCC-3′;利用7500荧光定量PCR仪检测各组细胞的存活素、血管内皮生长因子(vascular endothelial growth factor,VEGF) mRNA表达水平。
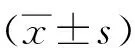
进行单因素方差分析,两两比较采用LSD法。不同时间点均值比较采用重复测量分析。以P≤0.05为差异有统计学意义。
2 结 果
2.1 熊果酸对细胞增殖的影响2、4、8、16、32 μmol/L熊果酸对TPC-1细胞抑制率较0 μmol/L 明显升高(P<0.01);48 h时熊果酸对TPC-1细胞抑制率较24 h明显升高(P<0.05)。TPC-1细胞抑制率与熊果酸浓度及时间呈正相关(P<0.05)。见表1。24 h及48 h熊果酸的IC50分别为(13.46±0.45)μmol/L、(10.69±0.41)μmol/L。
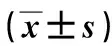
表 1 不同时间点不同浓度熊果酸对TPC-1细胞的抑制作用
2.2 熊果酸诱导细胞凋亡情况0 μmol/L、4 μmol/L、8 μmol/L熊果酸的细胞凋亡率分别为(4.13±0.61)%、(6.53±0.65)%、(13.13±1.59)%,且随熊果酸药物浓度的增加,TPC-1细胞凋亡率逐渐增加(P<0.05)。熊果酸可有效诱导TPC-1细胞凋亡,见图1。

a:0 μmol/L;b:4 μmol/L;c:8 μmol/L
2.3熊果酸对细胞线粒体膜电位的影响熊果酸 0 μmol/L时显示细胞有较强红色荧光,未见绿色荧光,随熊果酸药物浓度的增加,红色荧光逐渐减弱,绿色荧光逐渐增强。见图2。
2.4 熊果酸对细胞内活性氧含量的影响随熊果酸药物浓度的增加,细胞荧光强度逐渐减弱,说明随熊果酸药物浓度的增加,各浓度细胞中活性氧含量逐渐降低。见图3。
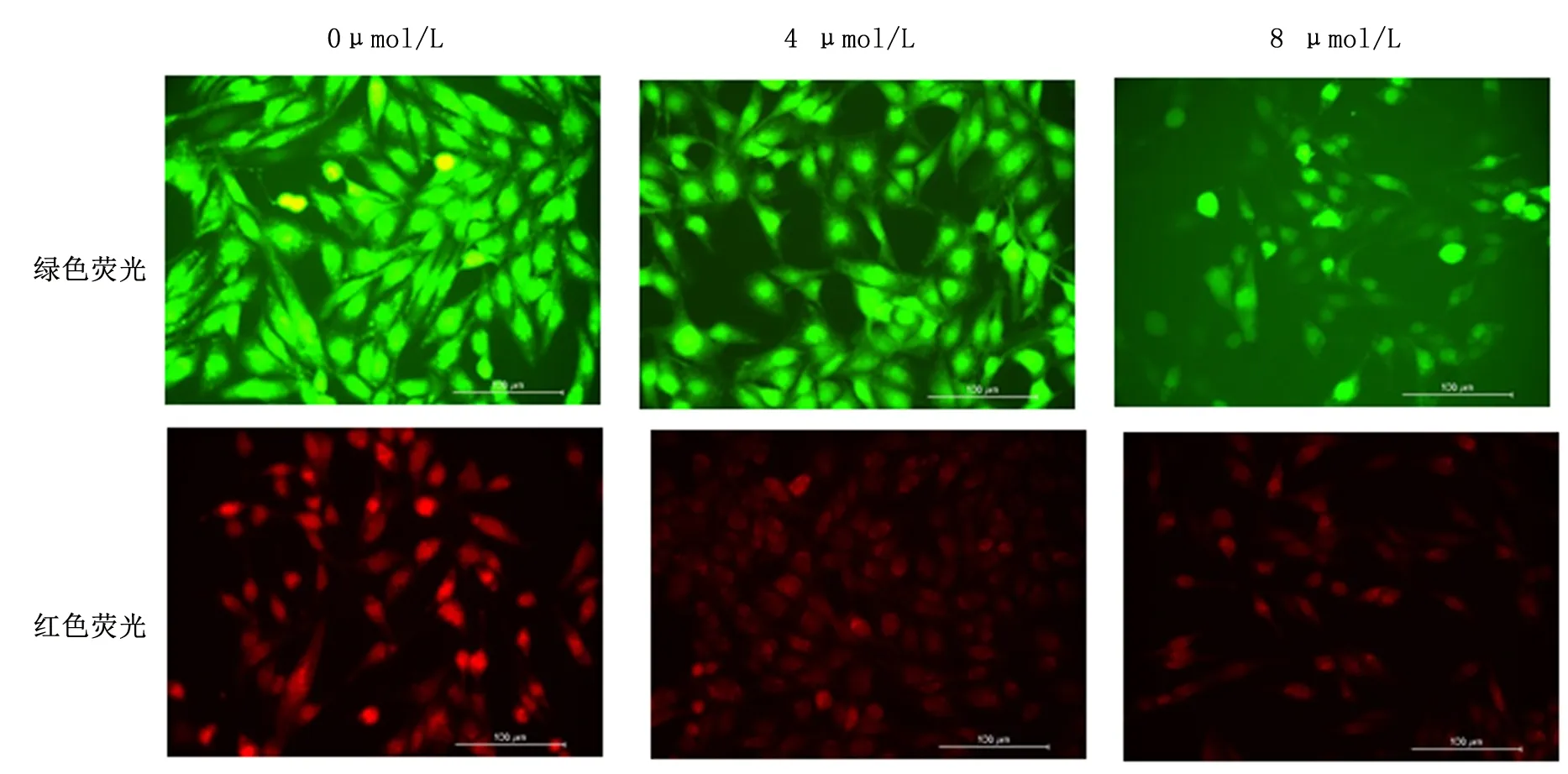
图示随着熊果酸浓度增加,荧光强度逐渐减弱

a:0 μmol/L;b:4 μmol/L;c:8 μmol/L
2.5 间接免疫荧光标记法测细胞中存活素及VEGF的蛋白表达情况4、8 μmol/L熊果酸存活素、VEGF的蛋白相对表达量较0 μmol/L明显降低(P<0.05),8 μmol/L较4 μmol/L明显降低(P<0.05)。见表2。
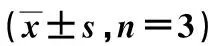
表2 各组细胞所得荧光强度值
2.6 qRT-PCR法测细胞中存活素及VEGF mRNA的表达情况4、8 μmol/L熊果酸存活素 mRNA的表达(0.53±0.07、0.71±0.09)较0 μmol/L熊果酸(1.00±0.00)明显降低(P<0.01),8 μmol/L熊果酸较4 μmol/L明显降低(P<0.05)。4、8 μmol/L熊果酸VEGF mRNA的表达量(0.68±0.04、0.42±0.07)较0 μmol/L熊果酸(1.00±0.00)明显降低(P<0.01),8 μmol/L熊果酸较4 μmol/L明显降低(P<0.05)。
3 讨 论
甲状腺乳头状癌是甲状腺癌中最常见的病理类型,属分化型,恶性度较其他类型低[4],但对放化疗不敏感,因此手术治疗仍是目前最有效的治疗方法[5]。近年来,甲状腺乳头状癌发病率逐年上升,占甲状腺癌发病率的90%以上[6]。 由于诊断水平的提高及诊断程序的改进,使更小的肿瘤(尤其是微小乳头状癌)的检测成为可能[7],甲状腺癌的年发病率在过去40年中几乎增加了2倍[8-9]。甲状腺乳头状癌发展缓慢,临床不适症状少见,因而其疾病性质易被忽视。给予本病患者适当手术干预及放射性碘治疗,部分患者加用促甲状腺激素抑制治疗均可获得良好预后。但本病早期易发生淋巴转移,有报道称约40%~60%的甲状腺乳头状癌病例在首诊时已发生颈部淋巴结转移,且淋巴结转移患者的复发率约是未转移病例的6倍[10]。因而研究甲状腺乳头状癌的发病机制并探寻新的防治方法成为研究的热点,如分子靶向治疗、中医药治疗等[11]。
熊果酸作为一种广泛存在于果蔬中的天然物质,近年来其抗肿瘤作用得到了国内外学者的普遍关注。目前与熊果酸及其衍生物相关抗肿瘤作用研究已涉及乳腺癌、肝癌、肺癌、胃癌等多个方面[12-15],并取得了实质性进展。范源等[2]对其抗肿瘤作用机制进行研究,发现熊果酸可通过多种细胞信号通路对肿瘤进行抑制作用,包括对肿瘤形成细胞毒作用、抑制其增殖、诱导其凋亡,并且在抗肿瘤细胞侵袭和抗肿瘤血管形成方面也具有一定作用。但其对甲状腺癌细胞有无作用及相关作用机制的研究暂未见报道。因此本研究对甲状腺乳头状癌TPC-1细胞进行 熊果酸干预,检测其对TPC-1细胞增殖的影响时发现,随熊果酸浓度的逐渐增加,TPC-1细胞的增殖抑制率逐渐增大,说明熊果酸对TPC-1细胞增值具有一定的抑制作用。应用流式细胞术检测熊果酸对TPC-1细胞的凋亡有无影响时发现,随熊果酸浓度的增加,TPC-1细胞的细胞凋亡率逐渐增大,说明熊果酸对促进TPC-1细胞凋亡具有一定的作用。
恶变发生后,肿瘤组织生长加速,需氧量增加,供氧血管需求增大。机体为适应缺氧环境分泌多种生物因子来促进血管生成。VEGF是促进肿瘤血管生成的关键因子,在促进血管内皮细胞分裂、增殖,促进血管生成以改善肿瘤组织缺氧方面起到关键性作用[16]。VEGF不仅在促进肿瘤新生血管形成方面作用显著,而且也是促进肿瘤细胞增殖的重要因素,因此VEGF已成为目前肿瘤诊治的重要研究对象。VEGF和VEGFR抑制剂已在晚期肿瘤的治疗中获得重大突破。存活素是一种凋亡抑制蛋白,为凋亡抑制蛋白 (inhibitor of apoptosis protein, IAP) 家族成员,具有肿瘤特异性,只表达于肿瘤和胚胎组织,正常组织中不表达或低表达。 存活素具有抗凋亡、调控细胞分化增殖等作用。本研究采用间接免疫荧光标记法及qRT-PCR法分别检测TPC-1细胞中存活素及VEGF的蛋白和mRNA表达情况及随药物浓度的变化,结果发现对照组中存活素及VEGF 的蛋白及mRNA呈高表达,随熊果酸药物浓度的增高,存活素及VEGF的蛋白和 mRNA 的表达均逐渐降低,说明熊果酸可有效抑制TPC-1细胞中存活素和VEGF的表达。Ma等[17]认为VEGF 可上调 存活素 的表达。Mesri 等[18]认为 存活素 是在VEGF介导下调节肿瘤细胞的增殖及血管生成,且认为VEGF的存在是存活素起调节血管生成作用的条件。结合本实验结论可知熊果酸可通过调节细胞中存活素及VEGF的表达来影响TPC-1细胞的增殖及组织血管生成。
在肿瘤细胞的凋亡过程中,存活素的表达增强可进一步抑制细胞线粒体内凋亡执行蛋白Caspase-3、Caspase-9的活化及凋亡活性物质的释放[19-20]。当肿瘤细胞受到内部凋亡刺激因子的作用时,可诱发钙超载、活性氧含量增加,进而导致线粒体跨膜电位降低甚至消失等现象[21],造成线粒体通透性转换孔不可逆性开放,进而释放细胞色素C和含半胱氨酸的天冬氨酸蛋白水解酶(Caspase-3)等一系列变化的发生,进而启动细胞凋亡程序。本研究利用JC-1试剂盒及荧光探针DCFH-DA检测熊果酸作用于TPC-1细胞后其线粒体膜电位变化及活性氧的变化情况。当线粒体膜电位较高时,JC-1在线粒体基质中结合为红色荧光的物质;当线粒体膜电位较低时,JC-1不能参与聚集,此时为带有绿色荧光JC-1单体物质。所以我们可根据荧光的颜色来观测线粒体膜电位的变化情况,由实验可见随熊果酸浓度的增加TPC-1细胞线粒体膜电位逐渐降低,DCF的荧光强度逐渐减弱。因此考虑熊果酸诱导TPC-1细胞的凋亡可能通过增加线粒体内活性氧含量,导致线粒体膜电位下降,进而启动线粒体途径导致细胞凋亡,但具体量化指标及相关检测有待进一步实验验证。
综上所述,本研究显示熊果酸可通过抑制甲状腺乳头状癌TPC-1细胞中存活素及VEGF的表达,进而有效抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡及影响肿瘤组织的血管生成;其诱导凋亡途径可能通过增加线粒体内活性氧含量,导致线粒体膜电位下降,进而启动线粒体凋亡途径来实现。

