木糖对L-酪氨酸发酵的影响
李国华,熊海波,陈宁,2,徐庆阳,2*
(1.天津科技大学 生物工程学院,天津 300457;2.代谢控制发酵技术国家地方联合工程实验室,天津 300457)
酪氨酸是一种人体重要的芳香族氨基酸[1],在食品、饲料、医药和化工等行业有广泛应用[2]。它不仅可以调节情绪,刺激神经系统,还可帮助加快身体新陈代谢,治疗慢性疲劳等。人体需要足够的酪氨酸用以生产多种重要的大脑化学物质,以便于帮助调节食欲、疼痛敏感性和人体对压力的反应。酪氨酸作为食品营养强化添加剂,已在乳制食品、肉制食品、烘焙食品、宠物罐头、动物饲料等方面得到应用。
随着大肠杆菌合成酪氨酸途径的解析,利用代谢工程技术构建生产酪氨酸的重组大肠杆菌为研究的热点[3-6]。前期的研究中[7],本实验室构建一株利用T7启动子过表达aroGfbr和tyrAfbrtyrB基因的大肠杆菌,T7启动子需要使用木糖诱导T7-RNA聚合酶的产生,使得T7启动子控制关键基因的高效表达[8,9]。由于大肠杆菌木糖异构酶基因[10](xylA)的存在,在发酵过程中将会不断消耗木糖[11]。本文从菌体生长、L-酪氨酸发酵、糖酸转化率和代谢副产物等方面进行分析,最终选定木糖添加量30 g/L、随流加葡萄糖一起流加木糖(木糖流加方式三)的方式为最佳方式。
1 材料与方法
1.1 材料与设备
1.1.1 菌种
大肠杆菌TYR-05(PT7-aroGfbr+PT7-tyrAfbrtyrB+PxylF-T7RNAP+ΔpheLA):由天津科技大学代谢工程研究室提供。
1.1.2 培养基
种子培养基:葡萄糖20 g/L,酵母粉[12]5 g/L,柠檬酸2 g/L,(NH4)2SO4·7H2O 2.8 mg/L,MgSO4·7H2O 9 g/L,VB13 mg/L,VH0.5 mg/L,115 ℃灭菌15 min。
发酵培养基:葡萄糖10 g/L,酵母粉5 g/L,柠檬酸2 g/L,(NH4)2SO44 g/L,K2HPO4·H2O 15 mg/L,MnSO4·7H2O 9 g/L, FeSO4·7H2O 2.5 mg/L, MgSO4·7H2O 1.5 g/L,VB11 mg/L,VH0.5 mg/L,115 ℃灭菌15 min。
1.1.3 仪器与设备
BT-457电子天平 深圳市博途电子科技有限公司;BIOTECH-5BG发酵罐 上海保兴生物工程设备有限公司;Aglient 1200高效液相色谱仪 美国安捷伦科技公司;SBA-40ES生物传感分析仪 济南延和生物科技有限公司;754PC紫外可见分光光度计 上海菁华科技仪器有限公司;S-433D全自动氨基酸分析仪 赛卡姆(北京)科学仪器有限公司。
1.2 实验方法
1.2.1 菌种活化
从-80 ℃冰箱中取出保菌管,于超净台上用移液器移取5 μL接种于装有5 mL LB液体培养基的摇管中,200 r/min、36 ℃培养12~14 h后,取1 mL接种于LB固体培养基的茄形瓶中,并用接种环涂布均匀,32 ℃培养12~14 h。
1.2.2 种子扩培
用无菌水将大肠杆菌从培养至布满菌苔的茄形瓶洗下,接种于2 L种子罐中,36 ℃培养6~8 h,取样待OD600至12~14 h,按照10%的接种量接入装液量为3 L的5 L发酵罐。
1.2.3 发酵
接种后36 ℃发酵开始,用质量分数为25%的氨水自动控制pH 为7.0,用质量分数为80%的葡萄糖流加控制发酵罐内葡萄糖浓度在2~5 g/L,调节搅拌转速和通风流量,控制溶解氧在20%~40%的范围内[13,14]。
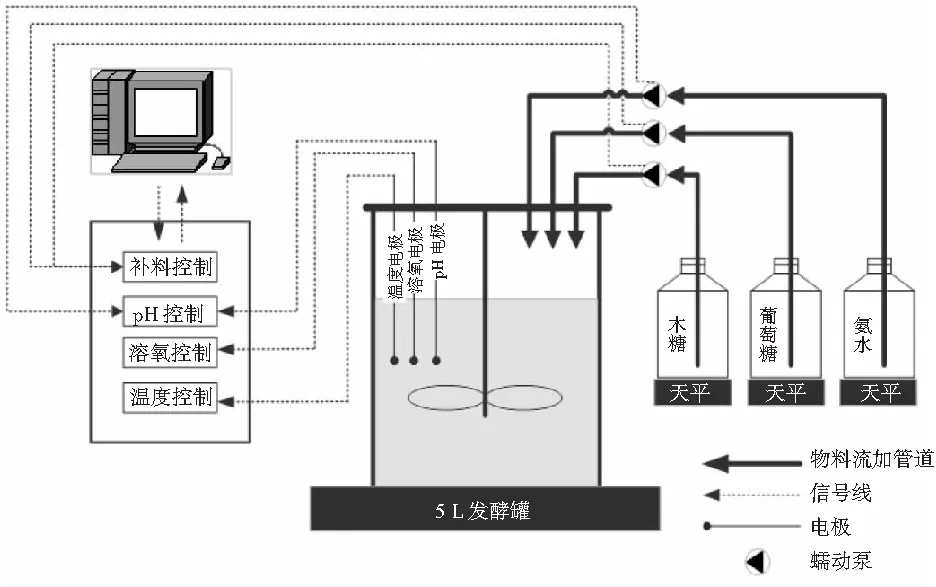
图1 木糖流加发酵L-酪氨酸结构示意图Fig.1 Structural diagram of L-tyrosine fermentation by xylose fed-batch method
1.2.4 L-酪氨酸质量浓度的测定
发酵液预处理:发酵液用pH 10~12的NaOH溶液稀释一定倍数后,0.45 μm膜过滤。
高效液相色谱测定:层析柱:Phenomenex C18 110A(250 mm×4.6 mm,5 μm);流动相:1 mL/min的10%乙腈;温度:30 ℃;检测波长:230 nm,进样量:20 μL。
1.2.5 乙酸质量浓度的测定
发酵液预处理:取发酵液1 mL于1.5 mL离心管中,13000 r/min离心3 min,上清液适当稀释过膜备用。
高效液相色谱测定[15]:层析柱:Bio-Rad Aminex HPX-87 h(300 mm×7.8 mm,5 μm);流动相:0.5 mL/min的0.005 mol/L H2SO4;温度:30 ℃;检测波长:210 nm;进样量:20 μL。
1.2.6 生物量的测定
采用浊度法,即在种子培养和发酵过程中取培养基样品,用分光光度计测定600 nm的吸光值,样品稀释至0.2~0.8 g/L范围内进行测定,生物量二稀释后的吸光值×稀释倍数。
1.2.7 微生物生长动力学和产物合成动力学公式

式中:X表示生物量;t表示时间;p表示产物浓度。
2 结果与讨论
2.1 木糖添加量对重组大肠杆菌生物量和L-酪氨酸发酵的影响
在酪氨酸发酵0 h时,一次性向发酵罐中加入不同浓度的木糖,30 h后发酵结束,观察其对重组大肠杆菌生物量和L-酪氨酸发酵的影响。在L-酪氨酸发酵过程中,木糖诱导T7-RNA聚合酶生成,控制T7启动子高效表达关键基因生产L-酪氨酸时影响显著,适量添加木糖可以有效地增加酪氨酸含量。
由图2可知,较低浓度(≤30 g/L)的木糖不会显著影响大肠杆菌的生物量,OD600为63;当木糖浓度超过30 g/L时,生物量降低了10%,说明过量的木糖会导致菌体代谢负担较大,影响菌体生长。在发酵培养基中不添加木糖(木糖添加量为0 g/L)时,L-酪氨酸能力合成较弱,含量为1.57 g/L;随着培养基中木糖浓度的增大,T7启动子激活关键基因表达,L-酪氨酸合成途径被强化,在发酵培养基中加入10 g/L的木糖时,L-酪氨酸含量为9.83 g/L,是不加木糖的6.26倍,影响显著;在木糖添加量为30 g/L时,L-酪氨酸在发酵结束时含量为17.5 g/L,生物量OD600为65.4。继续增加木糖浓度,L-酪氨酸浓度不再增加。

图2 木糖添加量对大肠杆菌生物量和L-酪氨酸发酵的影响Fig.2 Effect of xylose additive amount on Escherichia coli biomass and L-tyrosine fermentation
发酵结束时,在木糖添加量少于30 g/L的发酵液中未检测到木糖,木糖在发酵过程中被当作碳源逐渐消耗,导致木糖浓度下降,不能持续诱导T7启动子,导致发酵产L-酪氨酸发酵水平低;然而当木糖添加量≥30 g/L时,发酵结束时仍能检测到少量木糖,且L-酪氨酸浓度基本维持在17.5 g/L,木糖对T7启动子诱导作用达到“饱和”。考虑木糖成本的经济性因素,30 g/L木糖添加量为最合适的浓度。
2.2 不同木糖流加方式对L-酪氨酸发酵的影响
在发酵过程前期,通过控制发酵条件提高生物量,可以缩短发酵周期。若木糖添加时间过晚,前期诱导表达不充分,产酸过慢,造成发酵产酸水平低。因此,木糖的添加量和添加时间对L-酪氨酸含量具有较大的影响。本研究选择了3种木糖流加方式,探究不同流加方式对大肠杆菌生长和L-酪氨酸发酵的影响。
方式一:发酵0,10,20 h分别加入木糖30 g/L,共计90 g;
方式二:发酵0~20 h以1.5 g/(L·h)的速度恒速流加木糖,共计20 h×3 L×1.5 g/(L·h)=90 g;
方式三:木糖与流加葡萄糖同时流加,即90 g木糖和640 g葡萄糖定容至800 mL,流加进入发酵罐,木糖总量共计90 g。
由图3可知,木糖的流加方式对大肠杆菌的生长和L-酪氨酸的发酵产生了重要影响。图3(A和B)中,木糖流加方式三比方式一和方式二生长速率大,在发酵5 h达到最大生长速率7.43,最早到达稳定期,在发酵10 h时OD600为63。木糖流加方式三、方式二、方式一依次出现最大生长速度,并且最大生长速度递减。可见,发酵液中流加诱导剂木糖对大肠杆菌的生长产生一定的抑制。
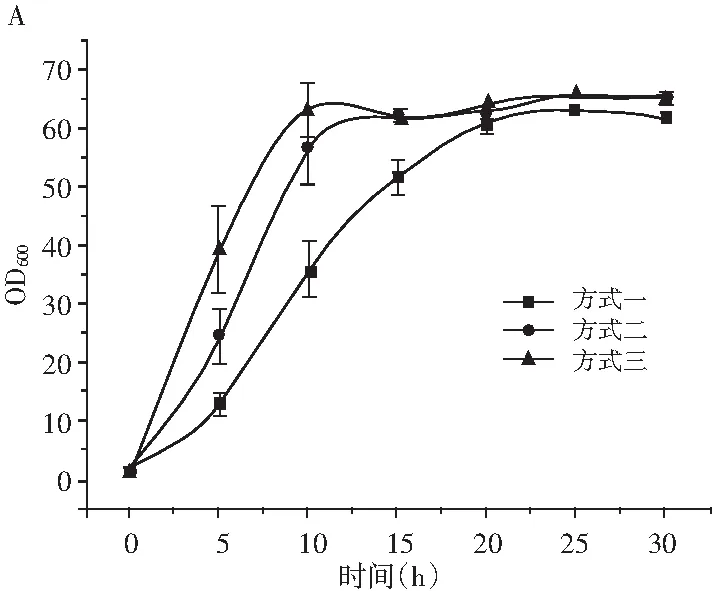
图3 不同木糖流加方式对大肠杆菌生长和L-酪氨酸发酵的影响Fig.3 Effect of different xylose fed-batch methods on the growth of Escherichia coli and L-tyrosine fermentation注:A为生物量;B为生长速率;C为L-酪氨酸浓度;D为L-酪氨酸合成速率。
由图3(C和D)可知,按照方式三流加木糖生产的L-酪氨酸含量高,发酵前期L-酪氨酸合成速率略低于方式一和方式二,在7.5 h左右方式三的合成速率接近并超过其他两种方式,且在发酵15 h左右达到最大L-酪氨酸合成速率2.38 g/(L·h),在30 h发酵结束时发酵罐内L-酪氨酸含量为33.5 g/L。这是由于按照方式三流加木糖,发酵过程前期大肠杆菌生物量较少,代谢葡萄糖速率较慢,只有消耗完发酵底糖后才会流加葡萄糖,造成随流加糖流加的木糖在发酵液内浓度较低,对大肠杆菌的诱导作用不明显;在发酵过程的中后期,按照方式三流加木糖的大肠杆菌优先到达平衡期且维持较大的生物量,又有流加木糖的积累效应,导致了L-酪氨酸合成速率的大幅增加,明显超过了方式一和方式二,在30 h发酵结束时积累了33.5 g/L的L-酪氨酸。
由于木糖偶联葡萄糖流加,有效地减少了菌体的代谢负担和对菌体生长的抑制效应。本研究证实了方式三是一种有效的诱导生产L-酪氨酸方式。
2.3 不同木糖流加方式对糖酸转化率和代谢副产物的影响
重组大肠杆菌在培养过程中往往会产生一定浓度的代谢副产物(尤其是乙酸)[16],会对菌体生长、发酵产酸产生重要影响,最终会使糖酸转化率降低,导致经济效益下降[17]。研究发现,L-酪氨酸发酵液的代谢副产物主要是乙酸(HAc)、组氨酸(His)等。由图5可知,采用方式三流加木糖诱导大肠杆菌生产L-酪氨酸在30 h发酵结束时乙酸含量最高达3.2 g/L,糖酸转化率最高达17%,比方式一和方式二乙酸含量分别增加30%和60%,糖酸转化率分别提高31%和75%;木糖流加方式一较方式二乙酸浓度高9.1%。在30 h发酵结束时,木糖流加方式二较方式一乙酸含量高,由于在发酵前期培养基中木糖含量较高,给菌体造成了较大的代谢负担,葡萄糖快速代谢产生较多的代谢中间体,不能及时用于菌体生长和产物合成,碳源积累导致乙酰辅酶A转化为乙酸[18]。
由图4和图5可知,木糖流加方式三乙酸含量过高与发酵初期细胞比生长速率和细胞摄氧速率有关[19],在发酵前期,细胞摄氧速率随细胞比生长速率升高,当细胞比生长速率达到一定数值之后,细胞摄氧速率不再升高,达到上限并成为限制因素,导致乙酸生成。结合图3~图5,随着乙酸的积累,加速菌体衰老,菌体生长速率、产物合成速率、葡萄糖消耗速率和氨水消耗速率下降,缩短产物合成期,导致发酵提前结束。在以后的研究中,控制发酵前期适当的代谢压力和细胞比生长速率,有助于抑制乙酸合成,延长产物合成期,防止细胞早衰。

图4 木糖不同流加方式对比生长速率的影响Fig.4 Effect of different xylose fed-batch methods on specific growth rates
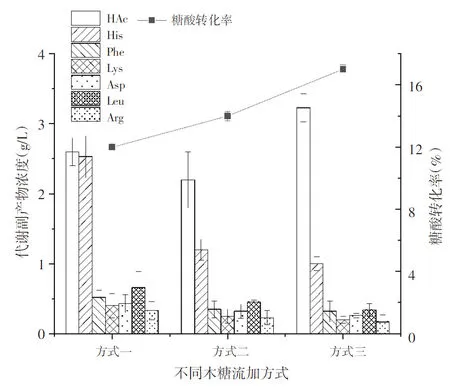
图5 不同木糖流加方式对糖酸转化率和代谢副产物的影响Fig.5 Effect of different xylose fed-batch methods on conversion rates of glucose and metabolic by-products
另外,采用木糖流加方式三较其他流加方式代谢副产物组氨酸、苯丙氨酸(Phe)、赖氨酸(Lys)、天冬氨酸(Asp)、亮氨酸和精氨酸均有明显减少,但是组氨酸相对含量较高,可能是木糖代谢强化了HMP途径,引起组氨酸积累[20]。
3 结论
酪氨酸作为重要的食品营养强化添加剂,在治疗抑郁症、调节情绪、舒缓压力等方面将日益受到广泛关注和应用,微生物发酵法生产L-酪氨酸具有广阔的前途。
研究结果表明,木糖作为诱导剂对L-酪氨酸发酵影响显著,木糖添加量、木糖流加方式对菌体生长、产物合成、糖酸转化率、代谢副产物等方面产生了重要影响。本文首先利用单因素实验,得出30 g/L的木糖添加量为最适添加量,比不添加木糖的L-酪氨酸含量提高11.1倍;之后探究了不同木糖流加方式对L-酪氨酸发酵的影响,研究发现木糖流加方式三(木糖随流加葡萄糖一起流加)最优:在30 h发酵结束时发酵罐内含量最高达33.5 g/L,糖酸转化率最高达17%,乙酸浓度达3.2 g/L。比较方式一和方式二,酪氨酸含量分别提高91%和40%,糖酸转化率分别提高55%和28%,但是乙酸浓度较高。

