桂西北喀斯特山区非共生固氮速率随退耕后生态演替变化特征
孙锡斌 ,张青山 ,肖孔操 ,李德军
(1. 中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室,湖南 长沙 410125;2. 中国科学院环江喀斯特生态系统观测研究站,广西 环江 547100;3. 中国科学院大学,北京 100049)
氮是大多数陆地自然生态系统的主要限制性营养元素,尤其是在植被恢复的早期阶段[1-2]。生物固氮是陆地自然生态系统外源氮输入的主要途径[3-4],在生态系统演替过程中具有重要作用。生物固氮分为共生和非共生固氮,但目前对生物固氮速率及控制机理的认识尚很不足,导致生物固氮已成为氮循环主要的不确定性环节,在生态模型中仍不能通过机理过程进行模拟[5]。尽管有研究已经对不同生态系统的生物固氮速率进行了测定,但是目前的研究相当有限,对任何生物区系(Biome)生物固氮速率的测定都远没有代表性。Reed等[3]搜集了全球生物固氮速率数据,发现共生与非共生固氮速率的实测数据分别有52个和114个;全球不同生态系统的共生固氮速率介于0.1~160 kg N/(hm2·a),而非共生固氮速率介于0.01~60 kg N/(hm2·a)。但是对于共生与非共生固氮对生态系统生物固氮总通量的相对贡献尚存在很大争议,其中一个重要原因是很少有研究同时测定了共生与非共生固氮[6]。传统观点认为共生固氮占主导地位,但是近年来的观点认为非共生固氮同样重要,甚至在许多生态系统中占主导地位[3,6]。这是因为固氮植物空间分布上不均匀,许多生态系统中固氮植物数量少甚至缺乏[7]。考虑到现有研究的局限性,无疑需要开展更多的研究以获取代表性数据及揭示生物固氮的控制机理,如揭示生物固氮随生态演替变化特征。
生物固氮可受多种因素影响,如pH、养分有效性、温湿度等[3,8-9]。在生态演替过程中,往往伴随着植物群落、土壤温湿度、养分有效性等环境因子的变化,这些都会深刻影响到生物固氮速率。研究发现,共生固氮速率往往会随着生态演替进程而降低[10-11]。如Pearson等[12]发现夏威夷Acacia koa林6年龄阶段的共生固氮速率为8 kg N/(hm2·a),而到了成熟林阶段共生固氮速率小于2 kg N/(hm2·a)。Augusto等[10]报道了6年龄海岸松林中的荆豆属植物(Ulex)固氮通量介于8.1~57.4 kg N/(hm2·a),而成熟海岸松林中的荆豆属植物固氮通量则降至
0.5~5.1 kg N/(hm2·a)。这可能与演替过程中生态系统氮水平升高而固氮植物丰度降低有关[11,13]。相对而言,目前关于非共生固氮速率如何随生态演替变化的报道较少,且结果不尽一致。例如,DeLuca等[14]发现在北方地区苔藓非共生固氮速率在生态演替后期显著降低。Vitousek[15]发现在夏威夷的一个生态演替序列中非共生固氮量(地衣、凋落物和腐木等)从0.3 kg N/(hm2·a)显著增加到2.8 kg N/(hm2·a)。总之,现有研究对非共生固氮速率随生态演替变化特征的认识仍很不足。
我国西南喀斯特山区生态环境十分脆弱,过去由于不合理的人为活动,大面积的喀斯特生态系统遭到破坏,导致生态退化[16]。近20年来,国家先后在西南喀斯特山区实施了一系列重大生态恢复工程,因此,目前大面积的喀斯特生态系统处于退耕后不同恢复阶段[17]。前期的研究表明,喀斯特山区退耕后土壤总氮和有效氮能快速累积[2,18],在退耕后自然演替过程中,草丛阶段受氮限制,灌丛阶段受氮和磷共同限制,而森林阶段则表现出明显的氮饱和特征[2,19]。然而目前我们对退耕后演替过程中土壤氮累积机理的认识尚很不足。由于非共生固氮是生态系统外源氮输入的重要途径[3],我们猜测非共生固氮对退耕后演替过程中土壤氮累积具有重要意义。然而,由于缺乏研究,我们尚不清楚西南喀斯特山区退耕后演替过程中非共生固氮速率如何变化。以往研究针对生态演替过程中土壤固氮菌群落数量与多样性方面作了探讨,例如,魏媛等[20]研究发现喀斯特山区生态演替过程中土壤固氮菌丰度持续上升,认为随着生态系统的正向演替,土壤从大气中获取氮素的能力也在不断增强。钟熙敏等[21]发现生态演替过程中土壤固氮菌种群数量增加,群落多样性也更加丰富。然而,固氮菌群落的变化并不能直接反映生物固氮速率的变化特征。
本研究基于桂西北喀斯特山区一条退耕后的演替序列(包括草丛、灌丛和次生林),研究了土壤、凋落物和苔藓的非共生固氮速率随演替变化特征,并分析了主控因素。由于前期研究表明氮状况随演替进程增加[2,18],而有效氮水平对非共生固氮速率具有抑制作用[14],我们猜测土壤和凋落物的非共生固氮速率随演替进程而下降(猜测1)。苔藓的养分主要来源于大气沉降,考虑到不同演替阶段距离较小,大气氮等养分沉降通量理论上应类似,因此,我们猜测苔藓的非共生固氮速率随演替无明显的变化特征(猜测2)。总之,本研究的主要目标包括:1)定量桂西北喀斯特山区典型生态系统非共生固氮速率;2)揭示桂西北喀斯特山区不同生态系统组分的非共生固氮速率随演替变化特征;3)探讨控制不同生态系统组分的非共生固氮速率随演替变化的主要因素。
1 材料与方法
1.1 试验地点
研究区位于广西壮族自治区环江县下南乡的古周 村(107°56′~107°57′ E,24°54′~24°55′ N),属 于典型的喀斯特峰丛洼地,海拔375~816 m。该地区的植被属于亚热带湿润常绿阔叶林,气候为亚热带季风气候。年平均气温为15.0~18.5 ℃,其中最低温出现在1月,约3.4~8.7 ℃,最高温出现在7月,约23.0~26.7 ℃。年平均降水量为1 530~1 820 mm,但降水季节分配不均,其中4月到8月为雨季,9月到次年3月为旱季。土壤为石灰土。
1.2 试验设计
本试验采用空间代替时间的方法选取退耕后不同演替阶段的草丛、灌丛和次生林,每个阶段设置3个20 m×20 m样地,样地之间距离大于20 m,不同演替阶段的最大直线距离小于3 km。草丛的主要优势种是斑茅(Saccharum arundinaceum),此外还有白茅(Imperata cylindrical(L.)Beauv.)、狗尾草(Setaria viridis(L.)Beauv.)等。灌丛的主要优势种是黄荆(Vitex negundo(L.)(VIT)),其他物种有伊桐(Itoa orientalisHemsl.)、毛桐(Mallotus barbatus(Wall.ex Baill.)Muell.-Arg.)、香叶木(Spermadictyon suaveolensRoxb.)和鸡仔木(Sinoadina racemose(Sieb.et Zucc.) Ridsd.)。次生林的主要物种为香椿(Toona sinensis),其他物种还有五角枫(Acer elegantulum(Fang et P. L.)Chiu)、斜叶榕(Ficus tinctoriaForst subsp. gibbosa(Bl.) Corner)和楤木(Aralia chinensis(L.))。所有样方中均无固氮植物分布。
1.3 样品采集
分别于2016年的非生长季和生长季在样方内采集表层土壤(0~10 cm)、凋落物和苔藓样品。在每个样方内,通过直径为2 mm的土钻按照“S”型取样法(8~10个点)采集土壤样品(剔除植物根系等杂物后充分混匀);分别通过20 cm×20 cm和10 cm×10 cm的正方形金属框,根据所需样品量采集一定面积的凋落物和苔藓样品。土壤样品一部分用于原位测定非共生固氮速率,另一部分带回实验室过孔径为1 mm筛后测定土壤铵态氮和硝态氮含量,最后一部分在室内风干后过孔径为1 mm或0.15 mm筛测定土壤理化指标。凋落物和苔藓样品一份用于原位测定非共生固氮速率,另一部分带回实验室65 ℃烘干粉碎后测定理化指标。
1.4 非共生固氮速率的测定
采用乙炔还原法在原位条件下测定土壤、凋落物和苔藓的乙烯产生速率[22]。采集一定质量的样品(其中土壤20 g、凋落物7 g、苔藓2 g)装入密闭性良好的330 mL具塞的玻璃培养瓶中,盖好瓶塞,用注射器抽出瓶中体积10%的顶空气体,随后往培养瓶中注入同等体积的高纯乙炔(已通过98%的浓硫酸和5 mol/L NaOH溶液进行纯化),将培养瓶置于树荫下避免阳光直射,在原位条件下培养24 h后用注射器抽取瓶中30 mL顶空气体注入到已预先抽好真空的12 mL玻璃储气瓶(Labco Exetainer,Labco Limited,UK)中,带回实验室使用气相色谱仪(GC-FID,Agilent GC 7890A,Agilent,USA)测定气体样品中的乙烯浓度。同步利用不注射乙炔的培养瓶和不装入样品的培养瓶分别检测样品本身和乙炔本身的乙烯产生情况。基于乙烯浓度和时间回归分析获得的斜率计算乙烯产生速率(nmol C2H4/(g·d))。随后,利用我们前期针对喀斯特生态系统土壤、凋落物和苔藓分别测定的乙烯产生速率与固氮速率之间的转换系数[23],将本研究测得的乙烯产生速率转换为固氮速率(ng N/(g·d))。
参照Reed等[24]的方法基于单位面积样品的储量和固氮速率估算非共生固氮年通量(kg N/(hm2·a))。单位面积土壤、凋落物和苔藓样品的储量通过质量-面积转换系数来估算,其中凋落物和苔藓的质量-面积转化系数分别通过20 cm×20 cm、10 cm×10 cm的正方形金属框中凋落物和苔藓干重来计算,土壤则结合土壤容重和岩石出露率计算其质量-面积转换系数。
1.5 土壤、凋落物和苔藓理化性质的分析
土壤、凋落物和苔藓的含水率采用烘干法测定,土 壤pH用pH计(FE20K,Mettler-Toledo,Switzerland)测定(液土比为2.5:1)。土壤有机碳采用重铬酸钾氧化-硫酸外加热法(油浴)测定(GB 8834—1988),土壤有效磷(AP)采用0.5 mol/L NaHCO3浸提-钼锑抗比色法测定,土壤总磷采用H2SO4、HClO4消煮-钼锑抗比色法测定,土壤全氮(TN)采用半微量开氏法-流动注射仪(Fiastar 5000)测定,土壤铵态氮(NH4+-N)和硝态氮(NO3--N)采用2 mol/L KCl溶液浸提-流动注射分析仪(AA3型)测定,凋落物和苔藓中的碳和氮通过碳氮元素分析仪(EA 3000,EuroVector,Italy)测定,凋落物和苔藓样品的全磷采用H2SO4-H2O2消煮-钼锑抗比色法测定[25]。
1.6 数据分析
运用SPSS 16软件(SPSS Inc.,Chicago,IL,USA)对数据进行统计分析。所有数据均进行正态性和方差同质性检验。采用多因素方差分析检验演替阶段、生态系统组分和季节以及它们的交互作用对非共生固氮速率的影响。采用单因素方差分析检验不同演替阶段之间非共生固氮速率、非共生固氮年通量和理化性质的差异是否显著。采用皮尔逊相关分析确定固氮速率与理化指标之间的相关性,采用多元线性回归分析确定非共生固氮速率的最强解释因子。
2 结果与分析
2.1 非共生固氮速率随生态演替的变化特征
多因素方差分析显示生态系统组分、演替阶段、季节及其交互作用对非共生固氮速率均有显著影响(表1,p< 0.05)。在非生长季,土壤和凋落物非共生固氮速率均表现为次生林最高,灌丛最低,随生态演替呈先降低后增加的趋势(图1a,图1b);苔藓固氮速率在草丛和灌丛阶段相当,次生林阶段最高(图1c)。在生长季,土壤和苔藓的非共生固氮速率在草丛和灌丛阶段没有显著差异,在次生林阶段最高(图1a,图1c)。但凋落物的非共生固氮速率草丛阶段最高,在灌丛阶段最低(图1b)。
全年总体来看,土壤的非共生固氮速率在次生林阶段最高((2.99 ± 0.10) ng N/(g·d)),比草丛阶段增加了50.19%;在灌丛阶段最低((1.31 ± 0.17) ng N/(g·d)),比草丛阶段下降了34.17%(图1a)。凋落物的非共生固氮速率在草丛阶段最高((3 914.90± 255.33) ng N/(g·d)),而在灌丛阶段最低((2.62 ±
0.23) ng N/(g·d)),灌丛和次生林凋落物的非共生固氮速率分别比草丛阶段下降了99.93%和96.92%(图1b)。次生林苔藓的非共生固氮速率((669.45± 60.08) ng N/(g·d))分别比草丛和灌丛阶段增加了
301.57%和329.31%(图1c)。

表1 生态系统组分、演替阶段、季节及其交互作用对非共生固氮速率的影响Table 1 Effects of ecosystem compartment, succession stage, season and their interactions on ANF rate
2.2 非共生固氮年通量随生态演替的变化特征
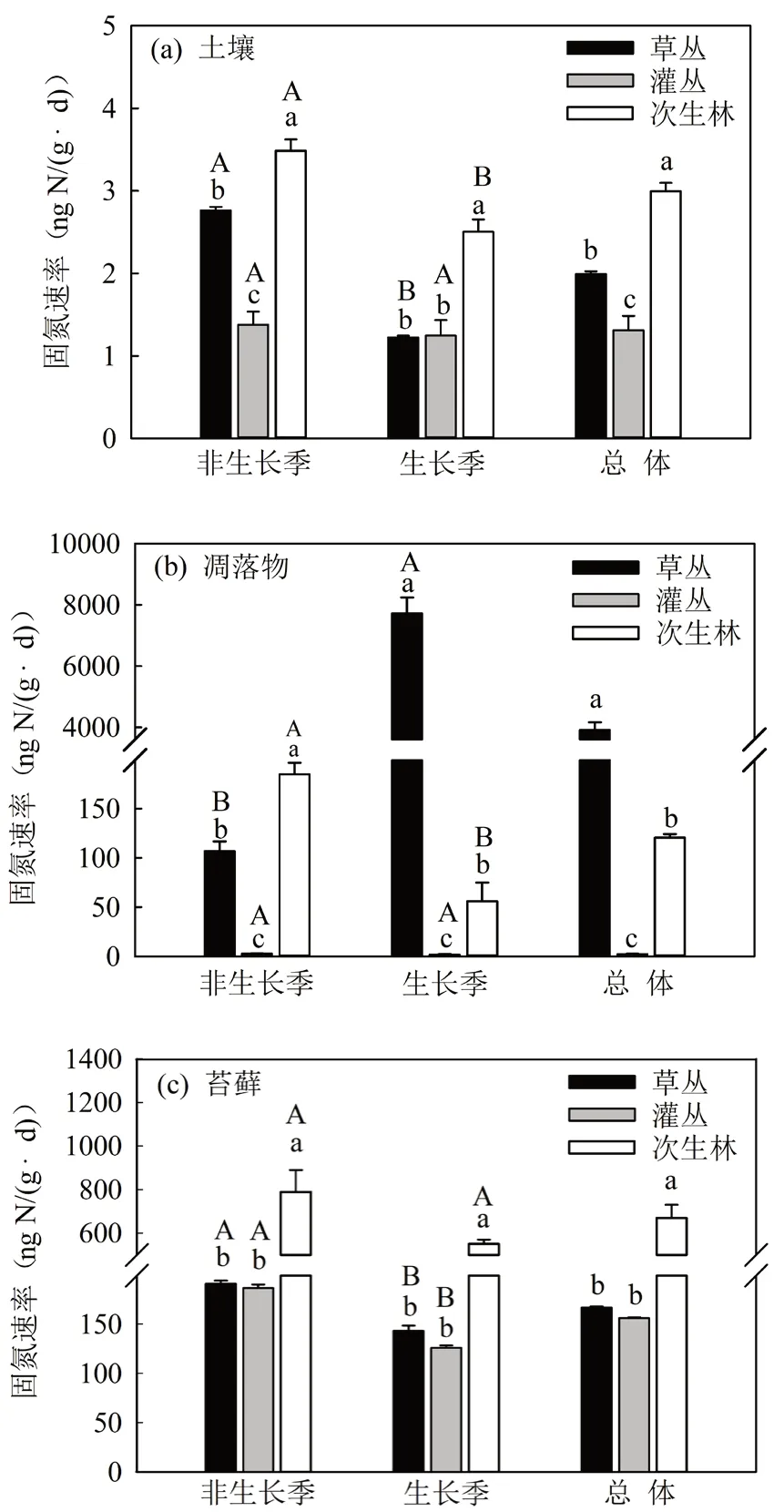
图1 土壤、凋落物和苔藓非共生固氮速率随生态演替变化特征Fig. 1 Changes of ANF rate in soil, litter and moss with ecological succession

图2 非共生固氮年通量随生态演替变化特征Fig. 2 Changes of annual ANF rate with ecological succession
不同生态系统组分的非共生固氮年通量随生态演替变化特征与各自的全年总体固氮速率变化特征类似(图1,图2)。土壤和苔藓的非共生固氮年通量随演替进程先小幅下降,随后显著上升,而凋落物的非共生固氮年通量随演替进程显著下降(图2)。基于上述三个组分得到的生态系统非共生固氮年通量随生态演替呈现先下降而后增加的特征,草丛、灌丛和次生林的非共生固氮年通量分别为(1.21± 0.06) kg N/(hm2·a),(0.23 ± 0.03) kg N/(hm2·a)和(0.65± 0.04) kg N/(hm2·a)(图2)。
不同组分对生态系统非共生固氮年通量的相对贡献随演替变化特征存在差异(图3)。土壤对生态系统非共生固氮年通量的相对贡献以灌丛最高(80.71%)而草丛最低(21.89%);凋落物的相对贡献则以草丛最高(70.71%)而灌丛最低(0.28%);苔藓的相对贡献随演替而增加,从草丛的7.40%增加到次生林的39.87%。不同组分对生态系统非共生固氮年通量的相对贡献在不同演替阶段也存在差异。在草丛阶段,相对贡献以凋落物最高而苔藓最低;在灌丛和次生林阶段,相对贡献则以土壤最高而凋落物最低。
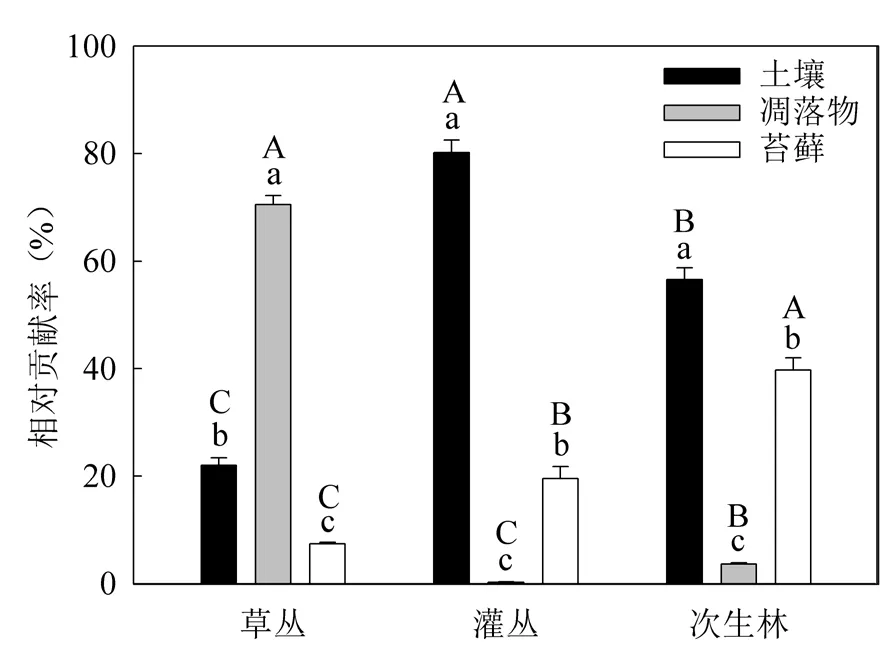
图3 土壤、凋落物和苔藓对不同生态系统非共生固氮年通量的相对贡献Fig. 3 The relative contributions of soil, litter and moss to annual ANF rate in different ecosystems
2.3 土壤、凋落物和苔藓理化性质及其与非共生固氮速率的相关性
土壤理化性质随生态演替的变化特征因指标而异(表2)。土壤有机碳和全氮含量在草丛阶段最低,但在灌丛和次生林二个阶段之间无显著差异。土壤全磷含量和C∶P比值在三个演替阶段之间无显著差异。土壤C∶N比草丛阶段最高,而次生林阶段最低;土壤N∶P比随演替的变化特征则与C∶N比相反。生长季和非生长季土壤含水率随生态演替变化特征相似,均是次生林阶段最高,且草丛和次生林在非生长季土壤含水率高于生长季。对于土壤无机氮含量,在非生长季时以次生林阶段最高,而在草丛阶段最低;生长季时三个阶段之间无明显差异;非生长季时的含量显著高于生长季。对于土壤有效磷含量,生长季和非生长季均以次生林阶段最低,但季节之间无显著差异。
凋落物单位面积质量因季节而异,在生长季以草丛最高,次生林最低,而在非生长季以灌丛最高,草丛最低;且二个季节之间质量也存在显著差异(表3)。凋落物含水率二个季节均以次生林最高而灌丛最低,且非生长季含水率高于生长季。凋落物碳含量在不同演替阶段或不同季节之间均无显著差异。凋落物氮和磷含量均表现为次生林最高,而草丛最低;草丛和灌丛凋落物氮和磷含量在生长季更高。二个季节凋落物C∶N和N∶P比值随演替变化特征类似,C∶N比以草丛阶段最高,而N∶P比在不同阶段之间无显著差异;草丛和灌丛凋落物C∶N比在非生长季更高。
二个季节苔藓单位面积质量随演替变化特征类似,草丛阶段最高而灌丛阶段最低;次生林苔藓单位面积质量在非生长季更高,而其他二个阶段则以生长季更高(表3)。生长季苔藓的含水率在不同演替阶段之间无显著差异,而非生长季则是灌丛阶段的含水率低于其他二个阶段;非生长季的含水率显著高于生长季。苔藓碳含量在生长季存在演替阶段之间的差异,即次生林高于其他二个阶段,但生长季苔藓氮和磷含量在演替阶段之间无显著差异。非生长季时苔藓碳含量在演替阶段之间无显著差异,但氮和磷含量均以次生林最高而草丛最低。C∶N比值在生长季时各阶段之间无显著差异,但非生长季时以草丛阶段较高。N∶P比均是次生林高于其他二个阶段。
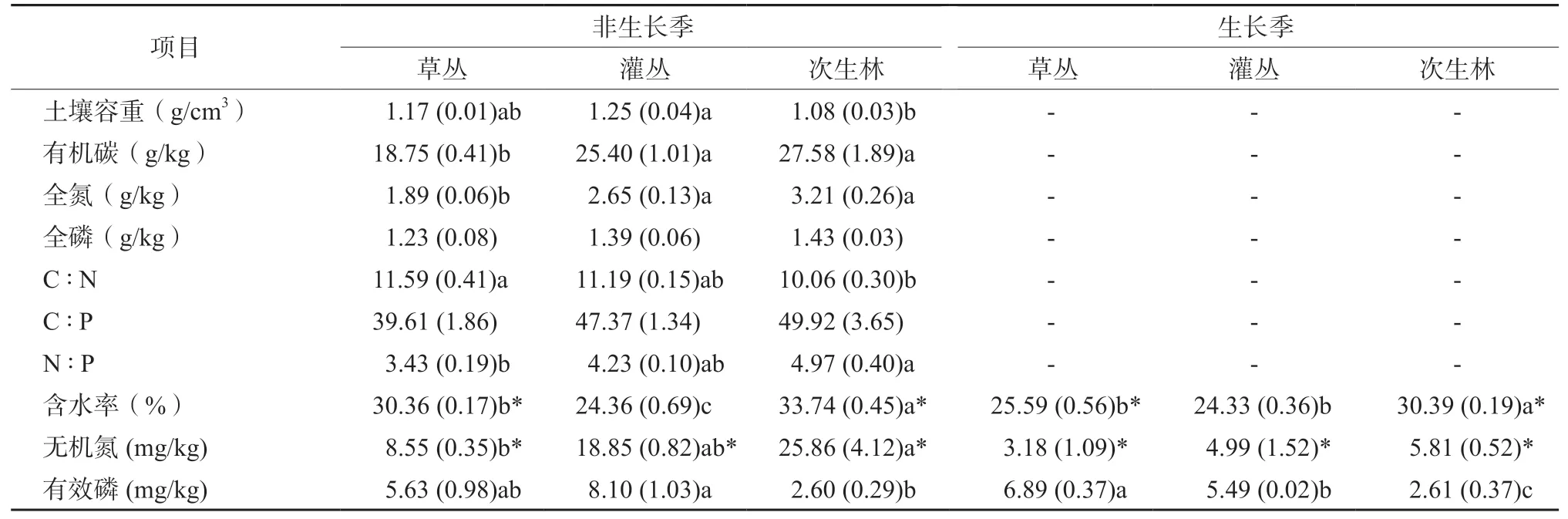
表2 三个不同演替阶段土壤理化性质Table 2 Physicochemical properties for soil in grassland, shrubland and forest

表3 三个不同演替阶段的凋落物和苔藓理化性质Table 3 Physicochemical properties for litter and moss in grassland, shrubland and forest
多元线性逐步回归分析结果表明,土壤的非共生固氮速率在生长季和非生长季的最强解释因子均为含水率,分别解释了非共生固氮速率变异的83.2%和94.9%(表4)。对于凋落物的非共生固氮速率,在生长季和非生长季的最强解释因子分别为C∶N比和含水率,分别解释了变异的86.9%和73.5%。对于苔藓的非共生固氮速率,在生长季和非生长季的最强解释因子分别是有机碳和全氮,分别解释了变异的84.3%和46.8%。此外,皮尔逊相关分析显示生长季时凋落物的非共生固氮速率与全氮呈显著负相关(R2=0.67,p<0.01)。
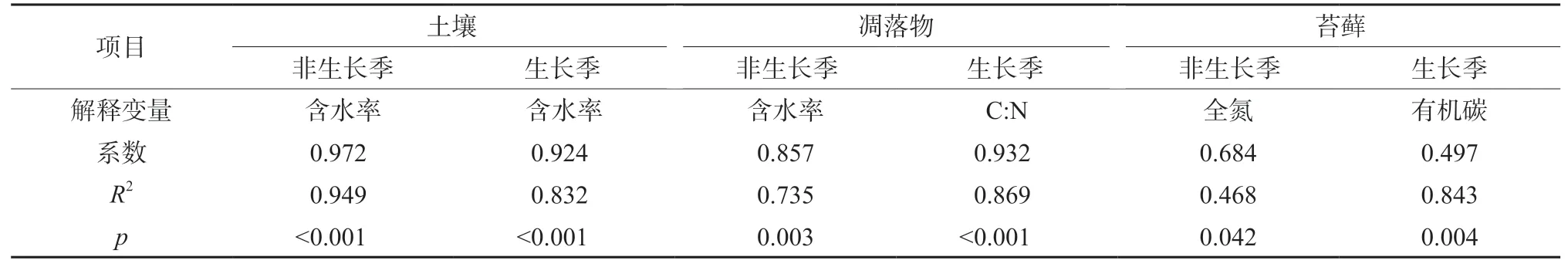
表4 多元线性逐步回归显示理化指标对非共生固氮速率的解释度Table 4 Results of stepwise multiple linear regression analyses showing the dependence of asymbiotic N2 fixation rate on physicochemical variables
3 讨论
本研究结果表明,桂西北喀斯特山区典型草丛、灌丛和次生林的非共生固氮年通量相比其他热带或亚热带地区较低。例如,有文献报道的热带或亚热带草丛、灌丛和次生林非共生固氮速率分别介于0.1~21.0、0.63~0.97和0.1~60.0 kg N/(hm2·a)[3,26]。这可能与我国西南地区大气氮沉降量以及土壤氮有效性相对较高,非共生固氮速率受到了抑制有关[18,27-28]。
我们发现喀斯特山区非共生固氮年通量随生态演替呈先降低后升高的趋势,有别于其他研究发现的非共生固氮速率随生态演替进程而降低[4,29-30]或升高[28]的现象。在本研究中非共生固氮年通量在草丛阶段较高,其中凋落物非共生固氮对草丛非共生固氮年通量贡献最大(70.71%),可能与草丛凋落物中氮含量低而C∶N比高有关,这两个条件在前期研究中均被证明对非共生固氮具有促进作用[3,31]。灌丛阶段非共生固氮年通量较低,这可能与灌丛阶段土壤、凋落物含水率均较低而氮含量较高有关。以往大量研究表明,在干旱和富氮环境条件下土壤和凋落物非共生固氮速率受到明显抑制[32-33]。相比于灌丛阶段,次生林阶段非共生固氮年通量略有增加。在以往的研究中也有类似发现[34],可能是因为次生林中土壤含水率以及苔藓碳氮含量较高促进了土壤和苔藓的非共生固氮速率。
不同生态系统组分非共生固氮速率和年通量随生态演替变化的趋势不同。首先,土壤的非共生固氮速率和年通量随生态演替呈先下降后上升的趋势,主要与土壤含水率随生态演替的变化有关。其次,凋落物非共生固氮速率和年通量在演替中后期下降,这与Pérez等[35]的研究结果一致。在本研究中凋落物C∶N比在演替过程中不断降低,可能是导致凋落物非共生固氮速率和年通量在演替中后期降低的主要原因。最后,苔藓非共生固氮速率和年通量在演替早期和中期无显著差异,在后期上升,以往的研究中也有类似的结果,且非共生固氮年通量与我们的研究处于同一水平(1~2 kg N/(hm2·a))[36-37]。可能与次生林中苔藓碳氮含量较高有关。我们发现含水率是影响土壤和非生长季凋落物非共生固氮的关键因子。以往的研究也表明了含水率对非共生固氮的促进作用[32,38]。例如,我们前期的研究也发现喀斯特森林土壤和凋落物非共生固氮速率随土壤含水率的增加而增加[32]。这一方面可能是因为固氮酶对氧气十分敏感,适当的水分条件可以为微生物创造厌氧条件,防止固氮酶被氧气破坏[8,33]。另一方面可能是因为含水率增加提升了土壤或凋落物固氮功能基因(nifH)的相对丰度[39]。与非生长季期间不同,我们发现C∶N比对凋落物生长季期间非共生固氮速率的影响程度最大。由于生物固氮过程需要消耗大量的能量用于打破N2中的化学键以及保持固氮酶活性[40],而凋落物中较高的C∶N比可以为固氮微生物提供更多固氮碳和能量,因此对非共生固氮具有促进作用。这与Zheng等[31]的研究一致。此外,我们还发现氮对凋落物和苔藓非共生固氮速率有显著影响,且存在不同效应。其中,在生长季期间凋落物的非共生固氮速率与氮含量呈负相关(R2=0.669,p<0.01)。以往许多研究也表明了环境氮水平的升高对非共生固氮的抑制作用[41-42],我们前期的研究也表明喀斯特森林中凋落物非共生固氮速率随氮添加浓度的增加而降低[23]。这是因为生物固氮极其消耗固氮微生物自身养分(碳、氮、磷等)和能量[30],固氮微生物在富氮环境中倾向于降低固氮速率而直接吸收利用环境中的氮[33,43]。研究表明,高氮条件会降低固氮菌和固氮基因的丰度[44],增加固氮基因扩增的困难性[45]。而苔藓在非生长季期间非共生固氮速率与氮含量呈显著正相关。Wang等[23]的研究也报导了喀斯特山区苔藓非共生固氮速率对环境氮状况的响应有别于土壤和凋落物。这与苔藓获取氮的方式有关,因为苔藓不从土壤中获取生长需要的氮,需要通过固氮来满足自身氮素需求[46]。由于固氮酶的合成需要消耗一定量的氮,苔藓氮含量更高意味着可以合成更多的固氮酶[33],因而对非共生固氮具有促进作用。意外的是,本研究中并未发现生态演替过程中磷对非共生固氮速率的影响,这与以往研究报导的磷对非共生固氮具有促进作用的结果不同[47-48]。可能是由于喀斯特山区非共生固氮速率受含水率、氮等的影响更大,导致磷的促进效应不明显。
4 结论
本文研究了桂西北喀斯特山区土壤、凋落物和苔藓的非共生固氮速率随退耕后生态演替的变化特征,发现从演替早期(草丛)到后期阶段(次生林),非共生固氮年通量呈现先下降后上升的变化趋势,且土壤、凋落物和苔藓非共生固氮速率和年通量随生态演替的变化趋势不一,主要受生态演替过程中土壤、凋落物和苔藓含水量、有机碳、全氮和C∶N比变化的影响。研究结果有助于深入认识喀斯特生态系统氮循环特征,并为生态恢复过程中氮累积提供了一种机理解释。

