淮山药粉-硬脂酸复合物制备及其理化性质研究
(闽南科技学院生命科学与化学学院,福建泉州362332)
淮山药(Dioscorea opposita),又称淮山,为多年生藤本植物薯蓣(Dioscorea opposita Thunb.)的块茎,在我国有两千多年的种植历史,是卫生部公布的药食两用食物[1-3],是福建省主要栽培经济作物之一[4]。淮山药富含淀粉,淀粉是由直链淀粉和支链淀粉组成的高分子化合物,是大多数谷物的主要成分[5]。根据淀粉在人体内不同消化速度,淀粉可分为快消化淀粉(rapidly digestible starch,RDS)、 慢消化淀粉(slow digestible starch,SDS)和抗性淀粉(resistant starch,RS)[6]。根据不同制备方法RS可分为RS1型(物理包埋法)、RS2型(天然抗性淀粉颗粒)、RS3型(老化淀粉)、RS4型(化学改性淀粉)。近年来,一些学者将淀粉与脂肪酸复合物定义为RS5型抗性淀粉,具有抗消化特性,其消化速率主要受淀粉中直链含量、支链淀粉侧链链长和食物中脂质的影响[7]。根据其熔融解旋温度,淀粉-脂质复合物分为I型复合物和II型复合物,I型复合物是在较低温度下形成的[8],II型复合物是在较高温度下形成的[9]。目前,制备淀粉-脂质复合物的方法主要有碱液分散法[10]、蒸煮喷射蒸煮法[11]、挤压蒸煮法[12]等。
本文以淮山药粉和硬脂酸为原料,在考察硬脂酸添加量、复合温度、复合时间对淮山药粉-硬脂酸复合物 (Chinese yam powder-stearic acid complex,CYPSAC)复合效果影响的基础上,通过正交试验优化其制备工艺;同时对比淮山药粉与CYP-SAC的消化率、透明度及凝沉稳定性等理化性质,为将淮山药粉-硬脂酸复合物作为低热量、低糖量等食品的良好原料提供一定的理论依据。
1 材料与方法
1.1 试验原料与试剂
淮山药粉:福建省山格农业综合开发有限公司。其制备流程为:去皮、护色、切片、烘干、打磨成粉。
硬脂酸(C18H36O2):西陇科学股份有限公司;胰α-淀粉酶(9 U/mg)、糖化酶(100 000 U/g):上海源叶生物科技有限公司;碘、碘化钾、盐酸:兰溪旭日化工有限公司;氢氧化钠、磷酸氢二钠、葡萄糖、五水硫酸铜、酒石酸钾钠、磷酸二氢钾、氢氧化钾:天津市福晨化学试剂厂;亚甲基蓝、乙醇、亚铁氰化钾:西陇科学有限公司;以上均为分析纯。
1.2 试验仪器与设备
HH4数显恒温水浴锅:国华电器有限公司;WFZ UV-2802SH型紫外可见光分光光度计:上海尤尼柯仪器有限公司;FA2004电子天平:上海衡平仪器仪表厂;101-1AB型电热鼓风干燥箱:天津市泰斯特仪器有限公司;TDL-60C低速台式离心机:上海安亭科学仪器厂。
1.3 试验方法
1.3.1 CYP-SAC的复合指数(composite index,CI值)测定
参考陈秉彦[9]上清液法测定CI值。

式中:CI为 CYP-SAC的复合指数,%;ABCcontrol为淮山药粉的吸光度;ABCsample为CYP-SAC的吸光度。
1.3.2 单因素试验设计
1.3.2.1 硬脂酸添加量
以等量的淮山药粉为底物配制料液比为1∶6(g/mL)的淮山药粉溶液8份,以淮山药粉质量为基准,分别加入硬脂酸的质量分数分别为0%、1%、2%、3%、4%、5%、6%、7%,置于60℃、100 r/min的恒温振荡器中糊化1 h。反应产物室温(25℃)冷却,用50%的乙醇溶液洗涤(3 000 r/min,10 min)离心 2次,以除去未与淮山药粉反应的游离硬脂酸,然后涂抹在培养皿上,于40℃烘箱中烘干过夜,用研钵磨粉过60目标准样筛,即得到CYP-SAC。取CYP-SAC 300 mg放在离心管中,加5 mL蒸馏水,混匀后置于沸水浴糊化20 min,冷却离心(3 000 r/min,10 min),用移液枪取 25 μL 的上清液与3 mL稀碘液 [0.1%(质量分数)碘单质和2%(质量分数)碘化钾]于离心管中混合显色后的溶液,采用紫外分光光度法测定结果,计算CI值。
1.3.2.2 复合温度
以等量的淮山药粉为底物配制料液比为1∶6(g/mL)的淮山药粉溶液26份,分为两组,一组不加硬脂酸作为对照组,一组加入质量分数5%的硬脂酸,置于100 r/min恒温振荡器中糊化1 h,反应过程中温度变量分别为 30、40、50、55、60、65、70、75、80、85、90、95、100℃。反应产物冷却至室温(25℃)后,用50%的乙醇溶液洗涤离心(3 000 r/min,10 min)2次,以除去未与淮山药粉反应的游离脂肪酸,然后涂抹在培养皿上,于40℃烘箱中烘干过夜,用研钵磨粉过60目筛即得到CYP-SAC。取CYP-SAC 300 mg放在离心管中,加5 mL蒸馏水,混匀后置于沸水浴糊化20 min后,冷却离心(3 000 r/min,10 min),用移液枪取 25 μL的上清液与3 mL稀碘液于离心管中混合显色后的溶液,采用紫外分光光度法测定结果,通过公式计算CI值。
1.3.2.3 复合时间
以等量的淮山药粉为底物配制料液比为1∶6(g/mL)的淮山药粉溶液8份,分为两组,一组不加硬脂酸作为对照组,一组加入质量分数5%的硬脂酸,置于100r/min恒温振荡器中糊化,温度为55℃,反应过程中时间变量分别为 0.5、1、1.5、2 h。反应产物冷却至室温(25℃)后,用50%的乙醇溶液洗涤离心(3 000 r/min,10 min)2次,以除去未与淮山药粉反应的游离脂肪酸,然后涂抹在培养皿上,于40℃烘箱中烘干过夜,用研钵磨粉过60目筛即得到CYP-SAC。取CYP-SAC 300 mg放在离心管中,加5 mL蒸馏水,混匀后置于沸水浴糊化20 min后,冷却离心(3 000 r/min,10 min),用移液枪取25 μL的上清液与3 mL稀碘液于离心管中混合显色后的溶液,采用紫外分光光度法测定结果,通过公式计算CI值。
1.3.3 正交试验设计
基于单因素试验基础,以CI值为指标,选取L9(43)正交表对A硬脂酸添加量(%)、B复合温度(℃)、C复合时间(h)进行优化试验,探究CYP-SAC的最优工艺参数,见表1。
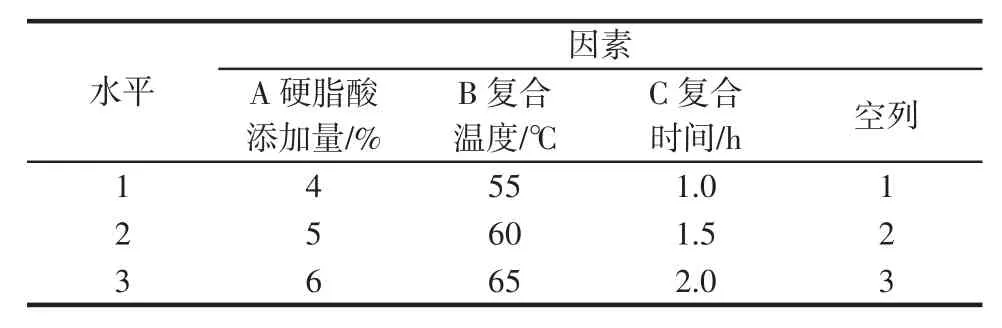
表1 正交因素水平表Table 1 Orthogonal factor level tables
1.3.4 CYP-SAC平均消化率的测定
1.3.4.1 葡萄糖含量的测定
参考王启军[13]方法,采用直接滴定法测定食品中的还原糖含量。
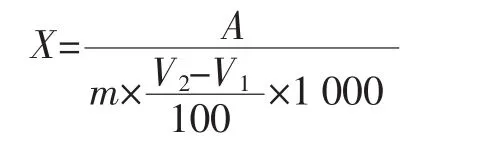
式中:X为试样中酶解葡萄糖的含量,g/g;A为碱性酒石酸铜溶液(甲、乙各5 mL)相当于葡萄糖质量,mg;m为样品的质量,g;V2为测定时平均消耗经酶处理样品溶液的体积,mL;V1为测定时平均消耗未经酶处理样品溶液的体积,mL。
1.3.4.2 平均消化率的测定
参考李涛等[14]、琚长霄[15]的方法,根据In-vitro消化模型模拟人体的内环境,进行适当修改。在37℃恒温水浴环境中模拟人体体温环境,用胰α-淀粉酶以及糖化酶同时酶解CYP-SAC,两种酶之间协同作用可抑制胰α-淀粉酶产物环糊精在模型中堆积导致酶活性的降低。再利用透析袋的半透膜特性使酶解的葡萄糖扩散于整个模型体中,以模拟人体肠道功能。再用直接滴定法测定烧杯中缓冲液葡萄糖含量以此计算CYP-SAC的消化率。
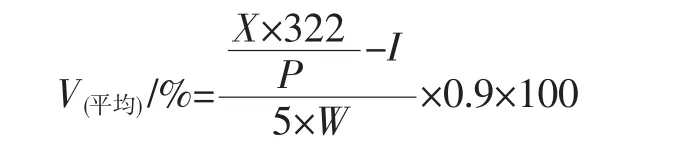
式中:V(平均)为平均每 1 h 样品消化量,%;I为未酶解的淮山药粉中还原糖含量,g/g;X为在整个模型取出的样品液中葡萄糖含量,g;P为模型中取出的样品液体积,mL;W为所用淮山药粉的质量(干基),g;0.9为葡萄糖质量与淀粉质量转换系数。
1.3.5 CYP-SAC理化性质的测定
透明度的测定:参考曾绍校等[16]的分光光度法测定最优组的CYP-SAC和原淮山药粉的透明度,以蒸馏水为空白组,在620 nm的波长下进行测定并记录读数,即为透光率。
参考李宏升透明度测定方法[17]测定3次,取其平均数,以百分数表示(%),即为CYP-SAC的透明度。按相同的方法测定淮山药粉的透明度。
1.4 数据分析
采用DPS2.0数据处理软件对正交试验结果进行极差分析和方差分析。
2 结果与分析
2.1 硬脂酸添加量对CYP-SAC的CI值影响
不同硬脂酸添加量对CYP-SAC复合指数的影响见图1。
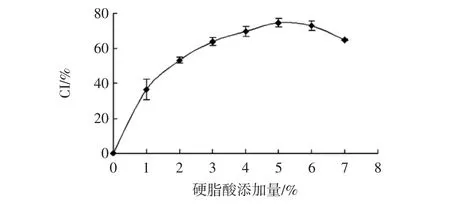
图1 不同硬脂酸添加量对CYP-SAC复合指数的影响Fig.1 Effect of different stearic acid additions on the composite index of Chinese yam powder
如图1所示,随着硬脂酸添加量的增加,硬脂酸与淮山药粉的复合指数呈先上升后下降的趋势,且添加硬脂酸量为淮山药粉质量5%时,CI值最大为(74.57±2.46)%。参考刘静娜等[18]研究可能是因为硬脂酸添加量的增大,提高了淮山药粉与硬脂酸分子结合的概率,减少淮山药粉结合碘的概率,从而使吸光度降低,CI值增加;在硬脂酸达到一定添加量时,淀粉分子内部螺旋结构与硬脂酸分子结合程度达到饱和;当硬脂酸浓度过高时,硬脂酸自身产生聚集作用,阻碍了CYP-SAC的形成,且空间位阻过大也会抑制硬脂酸进入淀粉的疏水性空腔,反而进入到淀粉螺旋结构的间隙,从而影响CYP-SAC的形成。
2.2 复合温度对CYP-SAC的CI值影响
不同复合温度对CYP-SAC复合指数的影响见图2。
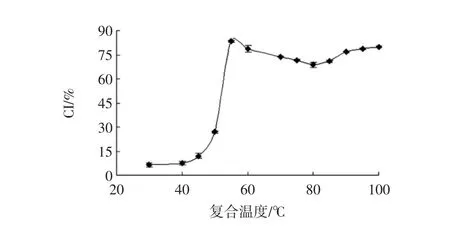
图2 不同复合温度对CYP-SAC复合指数的影响Fig.2 Effect of different compound temperature on the composite index of Chinese yam powder
如图2所示,随着复合温度的升高,CI值总体呈先上升后下降再上升趋势,当温度达到55℃时,CI值最大为(83.50±0.87)%。参考孟爽[19]研究可能是由于随着反应温度的升高,大米淀粉的结晶区和无定型易形成多孔结构,硬脂酸可与淮山药粉形成复合物,在30℃~55℃条件下,CYP-SAC因晶核的快速形成,CI值呈急剧增大趋势,直链淀粉的螺旋结构被快速固定,且呈随机分布,此反应温度下形成的复合物为I型;无定型复合物在80℃发生熔融现象,此时CYPSAC由I型无定型区向II型转变过渡,引起包合物结构不稳定造成CI值下降;在80℃~100℃条件下,形成的复合物为II型。
2.3 复合时间对CYP-SAC的CI值影响
不同复合时间对CYP-SAC复合指数的影响见图3。

图3 不同复合时间对CYP-SAC复合指数的影响Fig.3 Effect of different compounding time on the composite index of Chinese yam powder
如图3所示,随着复合时间的延长,CI值成增大后平稳趋势,复合时间1.5 h时,CI值达到最大为(86.12±0.62)%。参考曹世阳等[20]研究可能是由于当0.5 h时,因振荡时间过短、硬脂酸难溶于水,与淮山药粉不能充分有效接触,CI值较低;随着复合时间的延长,淮山药粉与硬脂酸能够充分接触,形成较多的CYP-SAC。
2.4 CYP-SAC制备工艺优化
CYP-SAC复合指数正交试验及试验结果见表2。
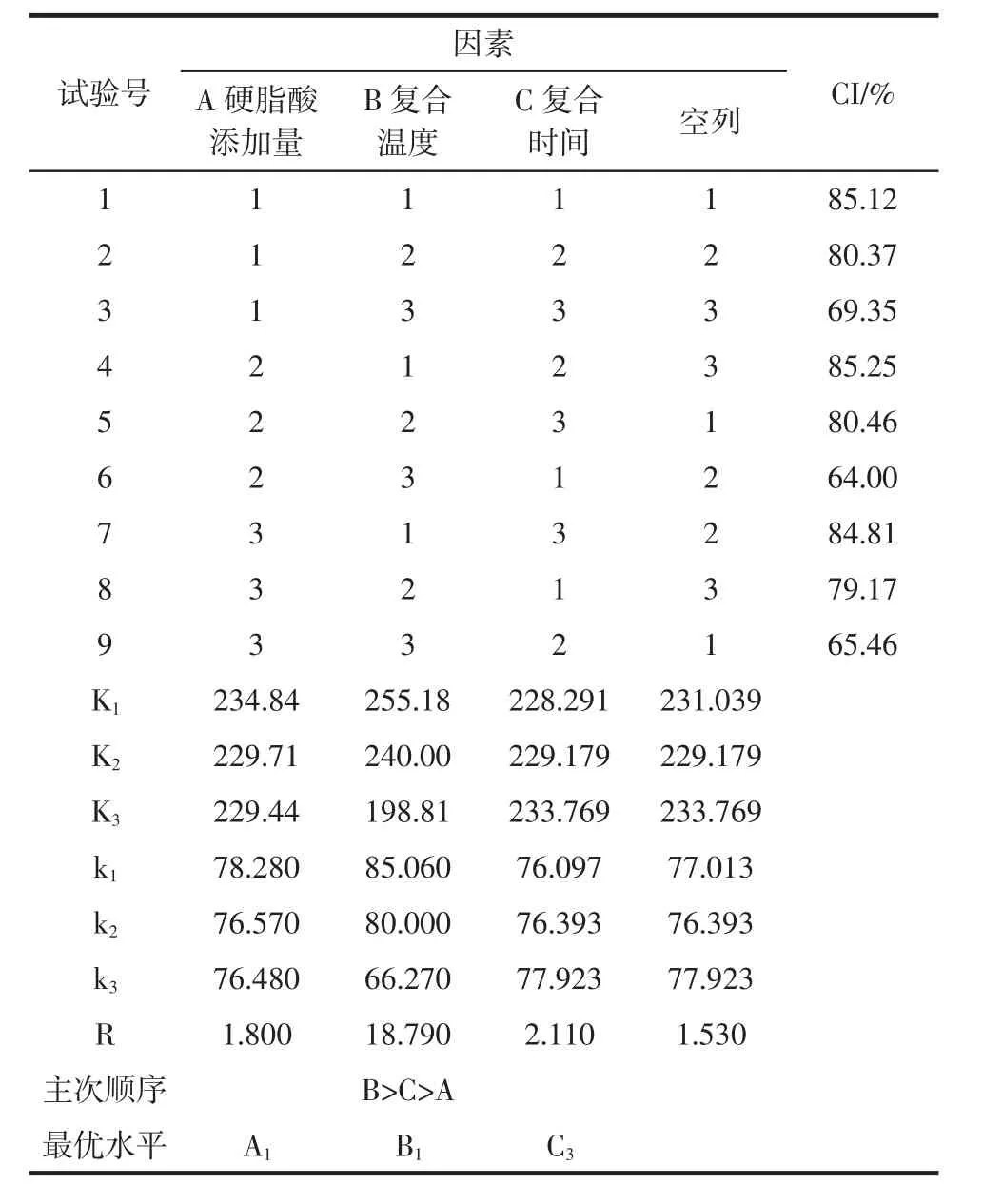
表2 CYP-SAC复合指数正交试验及试验结果Table 2 Composite index orthogonal test and test results
从表2可知,影响CYP-SAC的CI值因素主次顺序为B>C>A,即复合温度>复合时间>添加量,由极差分析得出优选工艺条件为A1B1C3,即添加硬脂酸量为淮山药粉质量4%,复合温度为55℃,复合时间为2 h。
CYP-SAC复合指数正交试验的方差分析结果见表3。
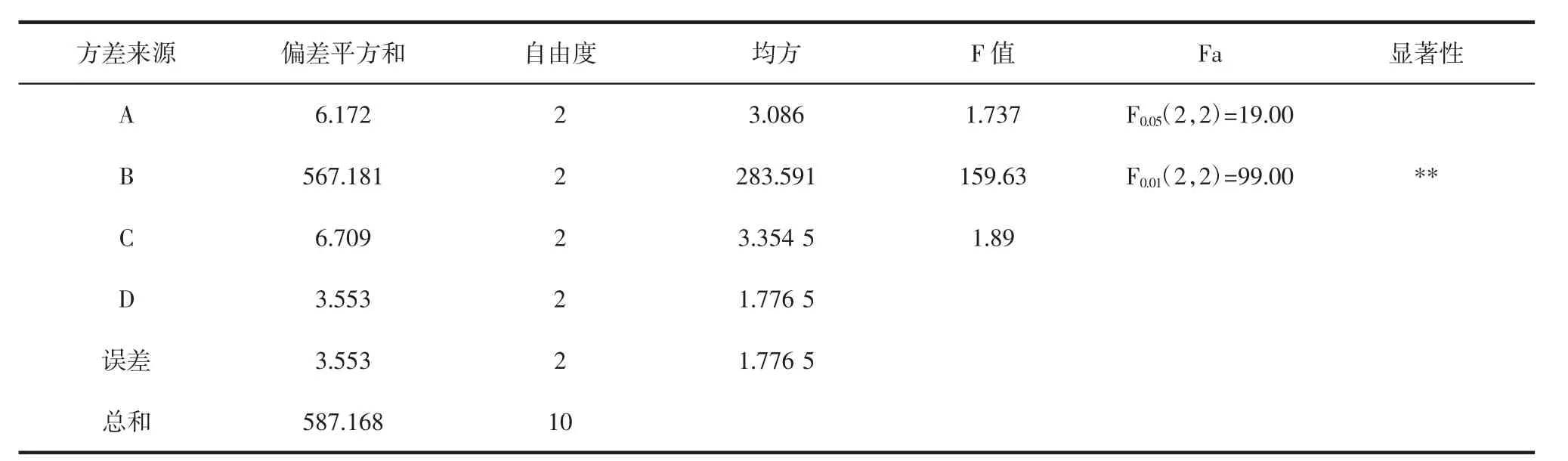
表3CYP-SAC复合指数方差分析Table 3 Analysis of variance of composite index of CYP-SAC
由表3方差分析可知,该CYP-SAC制备正交试验模型,其中复合温度因素(P<0.01)在试验水平内对CYP-SAC复合指数影响极显著。
采用正交试验最优工艺条件即添加硬脂酸量为淮山药粉质量4%、复合温度为55℃、复合时间为2 h进行验证,具体如下:以等量的淮山药粉为底物配制料液比为1∶6(g/mL)的淮山药粉溶液3份,以淮山药粉质量为基准,分别加入硬脂酸的质量分数4%,置于55℃、100 r/min的恒温振荡器中糊化2 h。反应产物室温(25℃)冷却,用50%的乙醇溶液洗涤(3 000 r/min,10 min)离心2次后涂抹在培养皿上,于40℃烘箱中烘干过夜,用研钵磨粉过60目标准样筛,即得到CYPSAC,经检测得CYP-SAC的CI值为(86.81±1.40)%。
2.5 CYP-SAC理化性质
2.5.1 消化率
淮山药粉与CYP-SAC的平均消化率见表4。
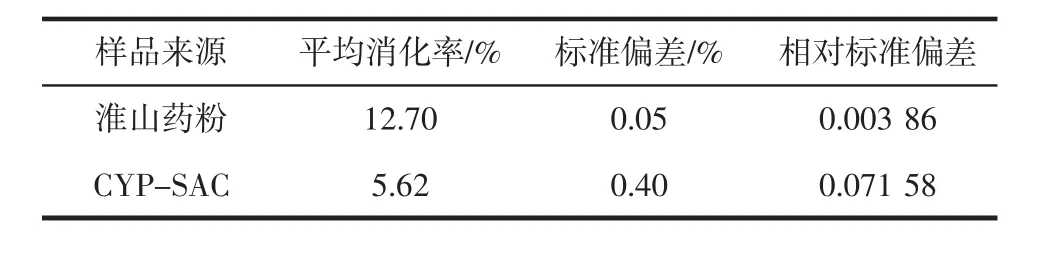
表4 不同样品的平均消化率Table 4 Average digestibility of different samples
如表4所示,CYP-SAC的平均消化率明显低于原淮山药粉。参考琚长霄[15]研究可能是因为硬脂酸与淮山药粉分子结合,由于硬脂酸分子比较大,主要结合在淮山药粉颗粒表面,淮山药粉颗粒表面的硬脂酸分子会在一定程度上影响酶与淮山药粉分子的结合位点;且这是最优组的CYP-SAC,CI值最大,复合的硬脂酸最多,颗粒表面被硬脂酸包围,淮山药粉与硬脂酸相互作用形成的空间网络结构最为密集,酶与淮山药粉结合的空间位阻最大,酶难于接近淮山药粉的分子链,从而使酶速率减慢。
2.5.2 透明度
淮山药粉与CYP-SAC的透明度见表5。

表5 不同样品的透明度Table 5 Transparency of different samples
如表5所示,CYP-SAC的透明度明显低于原淮山药粉。参考尚佳萃等[21]研究可能是因为淮山药粉在水中受热溶胀发生糊化,直链淀粉和支链淀粉溶于水中,而CYP-SAC不溶于水,且加热过程几乎不发生糊化。
2.5.3 凝沉稳定性
淮山药粉与CYP-SAC的凝沉稳定性见图4。
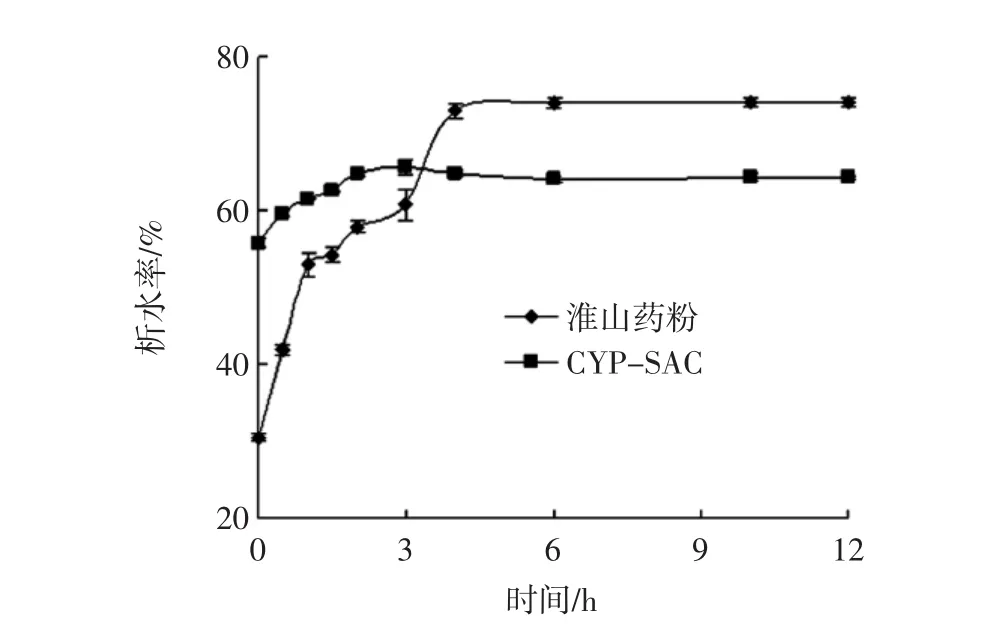
图4 不同样品的凝沉稳定性Fig.4 Condensation stability of different samples
由图4可知,经糊化处理的CYP-SAC经过约2 h静置后,析水率达65%左右后趋于稳定不变。经糊化处理的淮山药粉,析水率达到73%左右后趋于稳定不变。因此淮山药粉比CYP-SAC的凝沉稳定性差,CYPSAC的凝沉稳定性有所提升。根据李宏升[17]研究表明这可能是由于淮山药粉与硬脂酸形成的复合物组成的空间网状结构阻止了水分子的析出。
3 结论
CYP-SAC最优制备工艺条件为添加硬脂酸4%(淮山药粉质量计),复合温度为55℃,复合时间为2 h,在此工艺条件下CYP-SAC的CI值为(86.81±1.40)%、平均消化率为(5.62±0.4)%、透明度为(28.1±0.8)%,CYP-SAC相对于淮山药粉凝沉稳定性有所提升。本研究结果可为进一步提高淀粉在健康食品领域的应用提供参考。

