mtDNA氧化损伤在人视网膜血管内皮细胞高糖代谢记忆过程中的作用△
杨金波 谢琳
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病患者微血管病变的一种重要并发症[1],也是糖尿病患者视力下降和失明的主要原因[2-3]。由于DR发病率高、病情严重,其已成为我国盲症防治的重点。对DR并发症进行研究发现,患者组织存在一种特殊的代谢记忆现象[4]。这种现象是指患者经历一段时间的高血糖状态,即使血糖水平控制良好较长时间后,血管并发症仍然高发并进展的现象。对于DR患者来说,高糖代谢记忆现象可能是血糖控制后病情继续进展的重要原因[4]。既往研究表明,DR患者视网膜血管存在mtDNA损伤,受损细胞发生氧化应激时产生过量活性氧自由基(ROS),参与DR早期发病[5]。mtDNA一旦受损,将会导致线粒体膜电位降低,细胞凋亡增加,反过来又进一步促进ROS产生,形成恶性循环[6-11]。由于代谢性记忆现象是DR过程中难以克服的现象,我们推测这种恶性循环会不断促进代谢性记忆过程发生,导致视网膜血管mtDNA氧化损伤。
本研究我们利用人视网膜血管内皮细胞(hRECs)体外模拟代谢记忆,将hRECs暴露于高糖环境中作用不同时间后再转至正常培养基培养2 d,分别检测hRECs mtDNA氧化损伤的变化及其对视网膜细胞功能障碍的影响,进而探讨mtDNA氧化损伤在hRECs高糖代谢记忆过程中的作用。
1 材料与方法
1.1 实验分组选择生长良好的第3~5代hRECs用于本实验。根据前期对高糖作用hRECs的浓度筛选结果,选择30 mmol·L-1葡萄糖作为作用浓度,含浓度为5.5 mmol·L-1葡萄糖的DMEM培养基作为正常培养基。本研究将细胞分为4组:空白对照组对hRECs不做特殊处理,用正常培养基培养;高糖诱导3 h组用高糖作用hRECs 3 h,高糖诱导12 h组用高糖作用12 h,高糖诱导24 h组用高糖作用24 h,之后均转至正常培养基培养2 d。
1.2 试剂与仪器hRECs细胞株(美国ATCC),DMEM高糖和低糖培养基(中国Solarbio公司),澳洲胎牛血清(美国Gibco公司),ROS检测试剂盒(中国碧云天生物技术研究所),凋亡试剂盒、酶标仪、流式细胞仪(美国BD公司),RNA提取试剂盒、逆转录试剂盒、PCR试剂盒(日本TAKARA公司),线粒体提取试剂盒(美国Sigma公司),细胞色素C单克隆抗体(英国Abcam公司),电泳仪(美国Bio-Rad公司),PCR仪7900HT FAST(美国ABI公司)。
1.3 方法
1.3.1 流式细胞仪检测hRECs细胞凋亡情况将各组细胞培养液吸出后用PBS冲洗1遍细胞,用不含EDTA的胰蛋白酶细胞消化液消化细胞,轻轻吹打使贴壁细胞脱落,随后1000 r·min-1离心5 min,弃上清收集细胞,用PBS轻轻重悬细胞。取重悬的细胞,加入195 μL Annexin V-FITC结合液轻轻重悬细胞,之后再加入10 μL碘化丙啶染色液,轻轻混匀。室温避光孵育20 min,随后置于冰浴中。用流式细胞仪检测细胞凋亡率。
1.3.2 Western blot检测hRECs中细胞色素C蛋白表达提取hRECs总蛋白,常规定量和变性。制备SDS聚丙烯酰胺凝胶,上样、电泳、转膜及封闭,加入一抗 4 ℃ 孵育过夜,TBST 洗涤3次,37 ℃孵育二抗1 h,再次TBST洗涤3次,暗室添加ECL发光液孵育20 s,曝光拍照。以目的蛋白与GAPDH 蛋白产物条带灰度值之比作为其蛋白相对表达量。
1.3.3 实时荧光定量PCR检测线粒体呼吸链复合物COX1 mRNA的表达提取 hRECs 总RNA, 逆转录为 cDNA,以合成的 cDNA 作为模板在 ABI实时荧光定量PCR仪上进行定量实验。扩增循环条件:95 ℃30 s,95 ℃ 5 s,60 ℃ 34 s,共40个循环。采用SYBR GREEN1嵌合荧光法在ABI 7900HT快速实时PCR系统上进行实时荧光定量PCR。COX1引物:正向为5’-CCCCTCTTTCACCCACTTCC-3’,反向为:5’-CGCATGAGCATCTCTCGGAT-3’。以GADPH为内参,引物:正向为5’-GCAAGTTCAACGGCACAG-3’,反向为5’-CGCCAGTAGACTCCACGAC-3’。样本一式三份,采用2-ΔΔCt计算得出结果。
1.3.4 流式细胞仪检测hRECs内ROS含量用无血清细胞培养基洗涤各组细胞,先激发20 min后各组原位装载探针(按照11000无血清培养液稀释DCFH-DA),使得刚好盖住细胞。将细胞放入37 ℃细胞培养箱内孵育20 min。用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的探针。收集细胞后,用488 nm激发波长与525 nm发射波长,逐个时间点检测刺激前后荧光强度。
1.3.5 ELISA法检测hRECs线粒体内mtDNA氧化损伤标志物8-OHdG含量将各组细胞弃培养液,PBS洗1遍后用胰蛋白酶消化,1000 r·min-1离心5 min后收集细胞。采用线粒体提取试剂盒提取线粒体。将每组线粒体样本立即使用或置于-70 ℃保存。使用ELISA试剂盒检测线粒体内8-OHdG浓度。样本一式三份,于酶标仪450 nm读数,记录光密度(D)值,并绘制D值与浓度的标准曲线,根据D值计算各组8-OHdG浓度。
1.4 统计学方法用SPSS 19.0统计学软件进行数据处理,实验至少重复3次,数据以均数±标准差表示,多组均数比较采用单因素方差分析,方差齐时采用 SNK-q检验,方差不齐时采用Games-Howell 法。检验水准:α= 0.05。
2 结果
2.1 各组细胞凋亡率mtDNA氧化损伤与凋亡密切相关。流式细胞仪检测结果如图1所示,对照组细胞凋亡率为6.94%。高糖诱导3 h组、12 h组及24 h组细胞凋亡率分别为10.30%、12.08%、13.55%;高糖诱导24 h组细胞凋亡率高于高糖诱导12 h组,差异有统计学意义 (P<0.05),高糖诱导12 h组细胞凋亡率高于高糖诱导3 h组,差异有统计学意义(P<0.05);各高糖诱导组细胞凋亡率均高于对照组,差异均有统计学意义(均为P<0.05)。

图1 流式细胞仪检测各组细胞凋亡情况 A:对照组;B:高糖诱导3 h组; C:高糖诱导12 h组; D:高糖诱导24 h组
2.2 各组细胞中细胞色素C和COX1 mRNA的表达Western blot 结果显示,各高糖诱导组细胞线粒体氧化损伤相关蛋白细胞色素C相对表达量均高于对照组,差异均有统计学意义(均为P<0.05);高糖诱导3 h组细胞色素C相对表达量低于高糖诱导12 h组和高糖诱导24 h组,差异均有统计学意义(均为P<0.05)。见图2。而高糖诱导3 h组COX1 mRNA相对表达量高于高糖诱导12 h组和高糖诱导24 h组,差异均有统计学意义(均为P<0.05);各高糖诱导组COX1 mRNA相对表达量均低于对照组,差异均有统计学意义(均为P<0.05)。见图3。
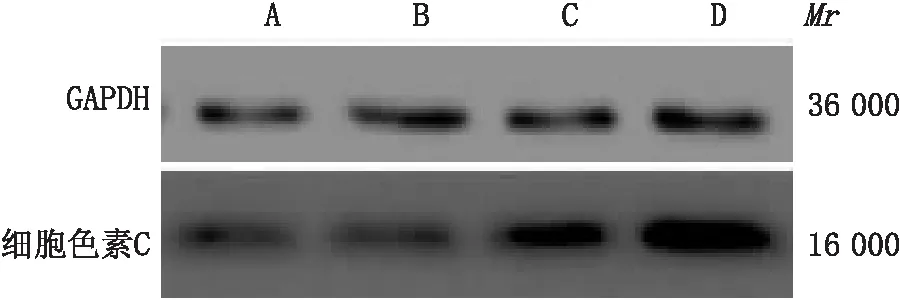
图2 各组细胞色素C相对表达量 A:对照组;B:高糖诱导3 h组;C:高糖诱导12 h组; D:高糖诱导24 h组

图3 各组线粒体呼吸链复合物COX1 mRNA相对表达量 A:对照组;B:高糖诱导3 h组; C:高糖诱导12 h组; D:高糖诱导24 h组。与对照组相比,*P<0.05
2.3 各组细胞ROS含量各高糖诱导组细胞ROS含量高于对照组,差异均有统计学意义(均为P<0.05);高糖诱导3 h组ROS含量低于高糖诱导12 h组,差异有统计学意义(P<0.05);高糖诱导12 h组ROS含量低于高糖诱导24 h组,差异有统计学意义(P<0.05)。即使hRECs转移至正常培养基培养2 d,ROS的产生仍然不断增加,说明代谢记忆现象存在。见图4。ROS的生成随时间逐渐增加,高糖诱导24 h组>高糖诱导12 h组>高糖诱导3 h组>对照组(均为P<0.05)。

图4 流式细胞仪检测各组细胞ROS含量 A:对照组;B:高糖诱导3 h组; C:高糖诱导12 h组; D:高糖诱导24 h组
2.4 各组细胞mtDNA氧化损伤标志物8-OHdG含量各高糖诱导组线粒体氧化损伤标志物8-OHdG含量均高于对照组,差异均有统计学意义(均为P<0.05);高糖诱导24 h组8-OHdG含量高于高糖诱导12 h组及高糖诱导3 h组,差异均有统计学意义(均为P<0.05)。见表1。
3 讨论
本研究结果表明,即使在细胞转移到正常葡萄糖环境后,高糖诱导的hRECs线粒体氧化损伤仍然存在,mtDNA氧化损伤仍在继续,细胞凋亡率和8-OHdG氧化应激水平升高,ROS生成增加,提示hRECs mtDNA氧化损伤中存在高糖代谢记忆现象。
由于糖尿病患者长期血糖控制依从性低,以及缺乏有效的早期干预药物,晚期患者激光手术及外科手术效果不佳,因此了解DR发病机制的早期机制对制定有效的防治策略具有重要意义。DR是糖尿病患者视力下降和失明的主要原因,是糖尿病的一种重要的微血管并发症[2]。它是一种进行性疾病,可能从无症状的非增生性毛细血管无灌注、小动脉瘤和视网膜出血,发展为视力威胁性疾病,如糖尿病性黄斑水肿和增生型DR[12]。以往的研究表明,高血糖和氧化应激与糖尿病视网膜血管损伤有关[13],但是其确切机制尚不清楚。长期血糖控制不良是血管并发症发生的主要危险因素之一。尽管采用强化治疗方案血糖控制良好,血管疾病仍可能发生并进展,这种现象被称为高糖代谢记忆[14]。研究发现,在链脲佐菌素诱导的糖尿病大鼠模型中,在良好控制血糖6个月后,凋亡的毛细血管细胞的数量较之前恢复良好,但仍继续增加,这表明高糖下视网膜细胞也存在着代谢记忆现象[15]。我们的研究表明,hRECs同样存在着代谢记忆现象,分别用高糖处理3 h、12 h、24 h,再转至正常培养基培养两天后视网膜血管内皮细胞功能受损、mtDNA氧化损伤仍然持续存在。
高糖会诱导氧化应激,导致线粒体产生过量ROS,从而导致血管损伤[16]。许多基础研究表明,ROS过量产生导致的氧化应激是早期DR发病的主要因素[17]。高糖还会通过激活多元醇途径形成晚期糖基化终末产物,激活蛋白激酶C 亚型,导致内皮功能障碍[16]。ROS被认为是内皮细胞功能障碍和细胞死亡的原因[18],内源性ROS主要产生在线粒体呼吸链上[19]。众所周知,线粒体是细胞的能量来源,电子传递链(electron transport chain,ETC)或呼吸链负责ATP的产生。线粒体的另一个独特特性是mtDNA,它不像细胞核DNA那样被染色质紧紧缠绕和压缩,而是以一种相当开放的构象存在,使其特别容易受到破坏[20]。mtDNA编码13个多肽,这些多肽都通过ETC参与氧化磷酸化。由于mtDNA与ETC接近,且缺乏组蛋白,它极易受到ROS介导的损伤[21]。mtDNA氧化损伤将会导致呼吸链线粒体蛋白、膜电位受损和ROS增加,导致恶性循环[5]。糖尿病发病过程中发生的代谢异常可刺激线粒体ETC产生ROS。一旦高糖引起氧化应激,线粒体受损将会导致ROS过量产生。即使控制了高糖,这些损伤仍在继续[22]。
此外,在高血糖控制后,线粒体基因组编码的DNA修复酶(包括糖基化酶)和其他蛋白在线粒体中的表达仍然低于正常水平。线粒体氧化应激增加后,mtDNA和DNA修复系统的损伤在葡萄糖水平正常化后仍至少持续6个月[23]。在实验室条件下,即使在葡萄糖正常化后,人的视网膜细胞和视网膜周细胞仍继续过量产生ROS[24]。这意味着线粒体异常是不可逆的,即使在高糖应激结束后,这些受损的线粒体也是过量产生ROS的永久性来源。
在本实验中,体外模拟高糖代谢记忆产生条件,检测hRECs mtDNA氧化损伤的变化及其对视网膜细胞功能障碍的影响。我们发现hRECs暴露在高糖环境中3~24 h后,ROS的产生呈时间依赖性增加,线粒体呼吸链复合物COX1 mRNA表达下调,提示高糖可增加线粒体ROS的产生,损害线粒体呼吸功能。由于在细胞转移到正常葡萄糖状态后观察到ROS产量的增加,所以ROS的不断产生很可能是由于代谢记忆损伤线粒体呼吸链而产生的。我们的研究还从mtDNA氧化损伤角度明确了DR代谢记忆时间点,细胞暴露于高糖环境3 h后转至正常培养基培养2 d,8-OHdG氧化应激水平已经开始升高,细胞色素C蛋白表达和细胞凋亡率增加,线粒体呼吸链亚基表达下降。
本研究表明,高糖下视网膜血管细胞存在着高糖代谢记忆现象,视网膜血管内皮细胞mtDNA氧化损伤可能是通过ROS的过量产生触发代谢记忆,可能是“高糖损伤”解除后氧化损伤可持续存在的 “源动力”。hRECs mtDNA氧化损伤是通过ROS的过量产生触发代谢记忆,从而促进DR的进展,利用线粒体靶向技术保护线粒体不受代谢记忆的影响,确定阻止ROS产生恶性循环的最佳时间点,可能成为防治高糖代谢记忆的新方法。

