容积旋转调强放疗治疗局部晚期胰腺癌的疗效观察
安召伟 宋雪晶 崔海靖 王敬然 张富同
近年来,“癌中之王”胰腺癌的发病率逐年上升,发病数量在不断的增加,已经成为我们常见的消化道恶性肿瘤之一[1-3]。其恶性程度很高,是预后最差的恶性肿瘤之一,胰腺癌的5年生存率<5%[4]。外科手术切除治疗是治愈胰腺癌惟一方法,但仅有15%患者能在最佳时间接受手术,且手术切除率不足20%[5]。由于其早期症状不明显,难以早期发现,胰腺癌侵袭性强,恶性程度高,预后差,发展迅速,而且其复杂的解剖以及病理特点导致其治疗效果不尽如人意,手术切除率低,初诊时80%患者已丧失了手术机会[6]。局部晚期胰腺癌在临床上是指不能进行手术切除而又没有发生远处转移的胰腺癌肿瘤。不能切除的局部进展期胰腺癌约占初诊患者的1/3[7],放射治疗就成为了局部晚期胰腺癌患者的重要治疗手段之一,其适应证为无法行手术治疗,并且没有发生远处转移的患者,能够延长其中位生存期[8],放射治疗在晚期胰腺癌的临床应用上日益广泛。容积旋转调强放射治疗(VMAT)术是现在国际上最先进的放射治疗技术,该技术能够在不增加危及器官剂量的同时提高肿瘤局部的剂量。此次研究的目的是局部晚期胰腺癌应用VMAT技术行放疗的不良反应和临床疗效观察,以探讨该治疗方法对胰腺癌患者的安全性及可行性。本研究以2016年6月至2017年12月我院收治的45例局部晚期胰腺癌患者为研究对象,探讨VMAT局部晚期胰腺癌患者的临床疗效及安全性,从而为临床治疗提供有效依据,报道如下。
1 资料与方法
1.1 一般资料 45例局部晚期胰腺癌患者,其中男31例,女14例;年龄42~72岁,中位年龄55岁;病灶部位:胰头41例,胰体4例;首发症状:腹痛39例,皮肤黄染13例;肿瘤最大径:<5 cm 25例,>5 cm者20例。诊断方法:经手术病理证实35例,依据影像学(CT、PETCT)诊断10例。治疗前疼痛评分:0分16 例,1~3分(轻度疼痛)17例,4~7分(中度疼痛)9例,8~10分(重度疼痛)3例;KPS评分:100分8例,90分13例,80分20例,70分4例。
1.2 纳入与排除标准
1.2.1 纳入标准:①经外科剖腹探查手术或经影像学检查引导穿刺后病理组织学证实的无远处转移的局部进展期胰腺癌;②KPS评分≥70分;③外科证实无法手术切除或患者拒绝行手术治疗;④具有可测量和可评价的病灶;⑤预计生存期≥3个月;⑥无放疗禁忌证;⑦患者及家属均在医师的告知下了解本次治疗研究的方法,并且均自愿签署知情同意书,同意参加本次治疗临床研究;⑧收集充足的患者临床资料,患者有良好的依从性。
1.2.2 排除标准:①有胰腺癌局部放疗史;②已经发生远处转移者,例如肺、脑、肝等其他器官;③年龄超过75岁,全身状况(KPS)评分≤60分;④合并有心脏、肝肾等重要脏器功能不全者;⑤依从性差,对研究疗效及安全性有影响;⑥因全身状况差而不能耐受放疗治疗者。
1.3 方法
1.3.1 体位固定及定位CT扫描:45例患者都经过双螺旋32排CT进行增强扫描,扫描前25 min均口服造影剂泛影葡胺150 ml加0.9%氯化钠溶液400 ml。扫描时患者仰卧于CT机平板床上,双手交叉抱头,三维激光定位系统进行定位,摆好定位位置,在皮肤上做好外标记。扫描层距5 mm,层厚为5 mm,扫描范围上界为膈肌顶,下界为髂嵴水平。必要时采用PETCT或者MRI图像与定位CT图像进行融合。应用计算机网络系统将CT扫描图象传输至飞利浦Pinnacle3治疗计划系统中,给予三维立体重建、射野、剂量计算及剂量优化;并对剂量体积直方图(DVH)进行评估、审核及确认。每次治疗前均给予CBCT验证。
1.3.2 靶区及重要器官的定义及勾画:在定位CT或融合图像上勾画靶区,肿瘤靶区(gross tumor volume,GTV)定义为影像学所显示的胰腺肿瘤区域,以及影像学所显示阳性腹腔淋巴结及腹膜后淋巴结。临床靶区(clinical target volume,CTV)为肿瘤靶区(GTV)、阳性腹腔淋巴结及腹膜后淋巴结外扩5 mm。PTV为CTV在头尾侧外扩10 mm,左右、前后方向外扩5 mm。
1.3.3 处方剂量及计划设计:放疗处方剂量PTV 50.4 Gy/1.8 Gy/28F,PGTV 59.4 Gy/1.8 Gy/33F,5次/周。正常器官的剂量限制为:肝V5<75%,V20<50%,V30<30%,平均剂量<28 Gy,双侧肾脏剂量V20<30%,脊髓Dmax≤45 Gy,十二指肠V30<50%。使用 Pinnacle计划系统设计每例患者的计划。95%PTV 接受的处方剂量为50.4 Gy。优化各个射野的权重使PTV达到均匀的剂量分布,同时尽量降低危及器官剂量。放射治疗所用X射线能量为6 MV。
1.4 观察指标
1.4.1 疗效评价:治疗结束后1个月给予行腹部、胸部CT等检查,然后根据实体瘤的疗效评价标准(RECIST)给予治疗的近期疗效进行评估。完全缓解(CR):是指所有肿瘤目标病灶消失;部分缓解(PR):是指基线肿瘤病灶长径总和缩小30%;病变进展(PD):是指基线肿瘤病灶长径总和增加20%或出现新病灶;病变稳定(SD):是指基线肿瘤病灶长径总和有缩小但是并未达到PR或者有增加但并未达到PD。 CR+PR为治疗有效,PD+SD为治疗无效。
1.4.2 疼痛疗效评价标准:按世界卫生组织疼痛程度分级法(VRS)评价,完全缓解(CR):疼痛消失;部分缓解(PR):治疗后疼痛明显减轻,睡眠基本不受影响,能正常生活;轻度缓解(MR):疼痛减轻,但仍明显,睡眠受干扰;无效(NR):疼痛无减轻。CR+PR为有效。
1.4.3 血清 CA199 水平疗效评价标准:参照Gllibter分级法将其分为四个水平:CA199 下降>75%为CR;CA199下降 25%~75%为PR;CA199下降24%~无变化为SD;CA199升高为PD。
1.4.4 放射反应评估:根据美国放射肺癌学协作组/欧洲癌症治疗研究组织(RTOG/EORTC)急性放射反应评估标准,将放射治疗毒性反应分为0~Ⅳ级。
1.4.5 生存期:从放射治疗第1天开始到患者死亡或者截止到随访最后时间计算为总生存时间。随访的截止时间为2019年12月。
1.5 统计学分析 应用SPSS 20.0统计软件,计数资料以率(%)表示。用Kaplan-Meier法计算生存率。
2 结果
2.1 随访 患者均得到有效随访,最后的随访日期为2019年12月,患者的随访率为100%。
2.2 疗效评价 放疗结束后1个月给予行CT复查。45例患者中,CR 10例,占22%,PR 27例,占60%,SD 5例,占11%,PD 3例,占7%,总的有效率(CR+PR)为82%。见表1。

表1 疗效观察 n=45
2.3 疼痛疗效评价 腹痛完全缓解38.5%(15/39),减轻41.0%(16/39),总缓解率79.5%(31/39);黄疸完全消退30.8%(4/13),减轻46.2%(6/13),黄疸消退率76.9%(10/13)。见表2。

表2 腹痛黄疸缓解
2.4 血清CA199水平 CR20.0%(9/45),PR 55.6%(25/45),SD 13.3%(6/45),PD 11.1%(5/45),总有效率75.6%(34/45)。见表3。

表3 血清CA199水平下降
2.5 生存率 用Kaplan-Meier法计算生存率12个月和24个月生存率分别为58.6%和13.0%。
2.6 放射治疗毒副反应 放疗反应的主要表现为恶心、呕吐、腹泻及白细胞下降等,经对症处理后均好转,并能够顺利完成治疗。见表4。
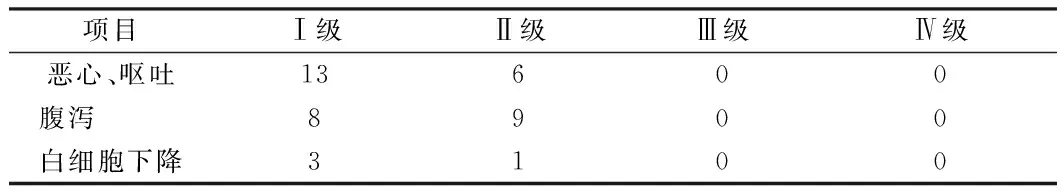
表4 放射治疗毒副反应 例
3 讨论
胰腺癌病死率占所有恶性肿瘤死亡率的第4位,胰腺癌的病死率基本等同于发病率,80%~85%的患者在就诊时就已处于局部晚期或发生远处转移[9]。目前普遍认为VMAT的效果优于最佳支持治疗和常规放射治疗[10]。胰腺比邻的胃、十二指肠在放疗接受一定剂量照射后,会造成胃、十二指肠黏膜放射性损伤,而表现出不同程度的消化道反应[11,12]。放射性引起的胃肠道损伤而发生的消化道症状与胰腺癌相关症状极易混淆,且缺乏评价指标,限制了放疗的安全性和局部控制率[13]。因此胰腺癌放射治疗的首要问题就是在提高胰腺肿瘤致死剂量的同时又能够保护好胰腺周围的重要器官少受或者免受射线的照射,从而提高肿瘤的局部控制率,减少放疗副反应及并发症的发生。
VMAT是一种具有旋转照射优点的动态的新IMRT技术,能够在照射的同时进行机架角度的改变,通过改变机架旋转速度和剂量率实现剂量的叠加和调整,达到缩短照射时间,减少散射线,克服一些传统放疗的缺点。具有靶区分布均匀性好、靶区适形度高以及治疗时间短等优点。多数研究表明,与传统放疗相比,VMAT可以在缩短照射时间的同时,不降低放射治疗计划的质量[14,15]。如今VMAT是目前国际上最先进的放射治疗技术,该技术能够在不增加危及器官剂量的情况下同时提高肿瘤局部剂量,并且不增加不良反应。VMAT具有高精度定位、高清晰度图象、三维立体显示肿瘤靶区和周围正常组织以及重要器官的解剖关系、能够利用等剂量曲线和剂量体积直方图(DVH)准确评估周围正常组织以及重要器官的照射剂量等优点,是晚期胰腺癌治疗的重要手段。
孙松韦等[16]报道调强放疗联合吉西他滨25例胰腺癌,1年生存率60%、2年生存率为28%,中位生存期分别为15个月,疼痛缓解率为80%,朱海文等[17]报道调强放疗45例局部晚期胰腺癌生存率:1、2 年生存率53.3%、26.7%,中位生存期为 14.2 个月。疼痛评分降低为最高 80%(36/45),总有效率(CR+PR)为73.3%,疾病控制率(CR+ PR+SD)为93.3%,CA199缓解率的 CR、PR缓解率为20%、60%,石玉生等[18]报道3D-CRT治疗67例晚期胰腺癌的临床研究报道,疼痛完全缓解率81.6%,肿瘤退缩率 67.2%,中位生存期12.5月。王光胜等[19]采用大剂量分割3D-CRT治疗23例晚期胰腺癌39个病灶,发现肿瘤缩小率63.1%;1年生存率60.8%,2年生存率33.3%,疼痛缓解率达87%,3例黄疸患者2例明显减退。在疼痛缓解率上,本组研究病例治疗结果与上述作者研究结果相近。本组研究病例治疗结果中,1、2 年生存率与上述作者研究结果相近,但稍低于上述作者研究结果,考虑为与联合化疗以及采用不同的大剂量分割方式等有关,多数研究表明,与传统放疗相比,VMAT可以在缩短照射时间的同时,不降低放射治疗计划的质量[14,15]。在不增加危及器官剂量的情况下同时提高肿瘤局部剂量,并且不增加不良反应。因此本研究未与常规放疗进行对照。本研究病例数较少,未对不同胰腺部位肿瘤进行分组,今后将一步增加样本进行分组,并收集长期随访证据以确认不同部位肿瘤对VMAT放疗的远期疗效。
CA199是一种黏蛋白型的糖类蛋白肿瘤标准物,为细胞膜上的糖脂质,由腺癌细胞分泌经胸导管入血,其异常升高可能与肿瘤细胞变性坏死后分泌物入血有关,研究显示其在多种肿瘤患者血清表达中均异常增高,尤其是胰腺癌、胆囊癌、胆管癌[20],CA199是胰腺癌最重要的标志物,与胰腺癌浸润、转移等相关,胰腺癌的诊断、治疗、预后评价等中,也发挥着重要的作用,有较高的临床应用价值[21,22]。本文患者血清CA199水平缓解率与胰腺癌治疗疗效有正相关,考虑为CA199在局部晚期胰腺癌中高表达有关,可以作为局部晚期胰腺癌疗效评价指标。对于临床观察局部晚期胰腺癌的疗效有较高的应用价值。
治疗过程中发生的毒副反应主要为恶心、呕吐、腹泻等症状,为1~2级,经对症治疗后缓解,胃肠道反应原因为胰腺吡邻胃部、十二指肠,尤其胰头肿瘤的患者,约50%左右的等剂量曲线包绕十二指肠,本组患者大部分为胰头肿瘤,因此在设计治疗计划时,应考虑到胃肠道反应,尽量降低十二指肠的受照剂量。4例出现白细胞减少,其中1级3例,2级1例,经药物治疗后缓解。本试验可以看出,VAMT放射治疗对胰腺癌的骨髓抑制很小。
综上所述,VMAT局部晚期胰腺癌姑息止痛效果好,退黄作用快,不良反应轻,可提高患者生存质量,延长生存,减少了治疗的时间和MU,能够减轻患者不适感,使患者分次内位移减少,从而提高了治疗的精度,显著提高了治疗的效率,值得临床推广运用。但局部晚期胰腺癌的容积旋转调强放射治疗现如今还处在起步阶段,对于怎样去界定肿瘤靶区,最佳的分割方式以及放疗总剂量等问题还有待今后的进一步观察及研究。

