重组鸡干扰素α 生物学活性测定方法的研究及其验证
高应瑞,刘珂飞,孟铁健,徐 鑫
(天津生机集团股份有限公司 300384)
干扰素(IFN)是一类具有抗病毒,影响细胞生长、分化和调节免疫功能等活性的蛋白质。 根据干扰素的氨基酸结构、抗原性和细胞来源,可将其分为三类:IFN-a、IFN-β 和IFN-γ。据资料报道,实验证明,重组的鸡α 干扰素在抵抗水泡性口炎病毒、劳斯肉瘤病毒、新城疫病毒、传染性法氏囊病病毒、传染性支气管炎病毒、马立克病毒、禽流感病毒等,都有明显的效果,能显著抑制病毒的生长[1-4]。
2014 年,程福亮等人在重组鸡α-干扰素的表达及其生物活性的初步研究中,应用在CEF/VSV 细胞系上测定了重组鸡α-干扰素的抗病毒效价为1.5×210 U/mg 左右[5];2018 年,赵泽在鸡、羊λ3-干扰素在家蚕中的表达及其抗病毒活性检测中,采用微量细胞病变抑制法在VSV-GFP 系统上检测所表达的重组干扰素抗病毒活性,根据Reed-Muench 法计算效价[6]。 范逸文在鸡INFγ-C3d 在毕赤酵母中的表达及抗病毒活性测定中将真核表达的重组蛋白chIFN-γ 和chIFN-γ-C3d 以及实验室保存的原核表达的重组蛋白chIFN-γ 和chIFN-γ-C3d 进行鸡胚内和鸡胚成纤维细胞(CEF)抗病毒活性比较[7];王朋在对鸭α、γ、λ 干扰素在家蚕中的表达及其抗病毒活性检测研究中, 同样采用的细胞病变抑制法来测定器干扰素的生物活性, 采用的病毒体系为VSV 病毒[8]。 邹欢在对鸭α-干扰素的真核与原核表达及生物活性的比较研究中,同样适用了VSV 病毒体系来测定干扰素生物活性[9]。
目前我国尚无重组鸡干扰素α 生物学活性测定方法国家标准,由农业农村部主编的《中华人民共和国兽用生物制品质量标准》(2001 版)猪白细胞干扰素[10]、《中国药典》“注射用重组人干扰素α1b”、“重组人干扰素α1b 注射液”都是采用细胞病变抑制法测定生物学活性[11]。 本研究参照采用目前公认的“微量细胞病变抑制法”(简称CPE 抑制法),采用鸡胚成纤维细胞(CEF)/水疱性口炎病毒(VSV) 系统以及鸡胚成纤维细胞(CEF)/新城疫病毒(NDV)系统测定了同批次的8 组不同浓度的rChIFN-α 样品生物学活性,现将结果报告如下。
1 材料和方法
1.1 材料
1.1.1 细胞和病毒
鸡胚成纤维细胞(CEF)参照《中国兽药典》中“细胞单层制备法”中“鸡胚成纤维(CEF)单层的制备” 方法[12],由SPF 鸡胚提取传代而来,SPF 鸡胚购买于北京梅里亚维通动物有限公司, 水泡性口炎病毒(VSV)购买于中国食品药品检定研究院、新城疫病毒(NDV F18)由中国农业大学动物医学院赠予。
1.1.2 试剂
DMEM 培养基、胰蛋白酶购自GIBCO 公司,小牛血清购自浙江天杭生物科技股份有限公司, 其他试剂均为进口或国产分析纯。
1.1.3 重组鸡干扰素α 样品
本实验测定用的重组鸡干扰素α 由本公司生产制备, 批号为20180501,效价标识为1.0×109IU/瓶,使用前采用生理盐水稀释成8 个不同浓度样本。
1.1.4 标准品
购自中国食品药品检定研究院, 重组人干扰素α2b 国家标准品,批号:270004-201301,效价为4.27×105IU/支,下称标化干扰素。
1.2 方法
1.2.1 CEF 细胞的原代、传代培养
1.2.1.1 原代培养
(1)将选好的9~10 日龄的发育良好的SPF 胚用5%的碘棉消毒蛋壳气室部位,再用酒精棉脱碘。
(2)无菌取出鸡胚,放入灭菌的玻璃皿内,用pH7.2 的PBS冲洗一次,去头,四肢和内脏。
(3)再用pH7.2 的PBS 冲洗两次。
(4)用镊子捏成小块(2~3mm3), 用pH7.2 的PBS 冲洗两次。
(5) 鸡胚约加4mL0.25%胰酶溶液,38℃消化30min, 期间15min 轻摇一次。
(6)消化结束,弃掉胰酶消化液,用pH7.2 的PBS 冲洗两次,再用细胞生长液冲洗一次。
(7)加入适量的细胞生长液,用刻度吸管反复吹打(使细胞充分分散)。
(8)将细胞分散液倒入带6~8 层纱布的100mL 烧杯中(过滤之前先用少许细胞培养液润湿纱布),加入适量培养液(40mL/胚),过滤。
(9)重复步骤⑨的操作重虑一遍。
(10)计数,要求每1mL 滤液中约含活细胞100 万~150 万个。
(11)分装置个培养瓶中(5~8ml/瓶),置37℃培养箱培养。
1.2.1.2 传代培养
在显微镜下观察细胞生长情况, 当细胞生长至铺满单层后,进行细胞传代,弃去细胞培养液,用PBS 液冲洗3 次,再加入0.25%的胰蛋白酶消化液消化3~5min,弃去消化液,加入适量的含10%小牛血清DMEM 培养基的营养液, 用吸管充分吹打,使之从瓶内壁脱落形成细胞悬液, 吸取一半细胞悬液移至另一细胞瓶内,置37℃、5% CO2培养箱中培养。
1.2.2 VSV/NDV 病毒滴度测定(TCID50 法)
1.2.2.1 单层细胞制备
将CEF 细胞消化后加入适量的营养液制成5×105/mL 的单细胞悬液, 用微量移液管将其加入96 孔细胞培养板的微孔中,每孔100μl,37℃,5% CO2培养箱培养24h,形成单层,做病毒滴定用。
1.2.2.2 接种病毒
将长好单层细胞的培养板各孔细胞液倾弃,用吸管把各稀释度的VSV 病毒(或NDV 病毒)从低浓度开始依次加入各孔中,每孔100μl,细胞对照孔不加病毒液,只加维持液。 置37℃,5%CO2培养箱中孵育。
1.2.2.3 结果观察
于孵育后每隔12h 在倒置显微镜下观察CPE,直至病变不再变化为止,终止培养,然后弃去细胞培养板中的上清液,每孔加入染色液50μl,室温放置30min 后,用流水小心冲去染色液,并吸干残留水分,每孔加入脱色液100μl,室温放置3~5min,混用后,用酶标仪以630nm 为参比波长,在波长570nm 处测定习惯度,记录测定结果。 以Reed-Muench 法[13]计算rChIFN-α 工作单位,并经重组人干扰素α2b 校正后得到国际单位的抗病毒活性。对所测样品进行重复测定,方法同上,重复4 次,并对所得结果进行统计学分析。
1.2.3 微量細胞病变抑制法滴定rChIFN-α 效价
1.2.3.1 供试品溶液的制备
将供试品溶液用测定培养液稀释至蛋白含量约0.1mg/mL,然后在96 孔细胞培养板中,从1∶100 开始依次做4 倍梯度稀释,每个稀释度做复孔,共做10 个稀释度(1~10 孔)。
1.2.3.2 标准品溶液的制备
取重组人干扰索α2b 国家标准品,按说明书复溶后,用营养液稀释至每lmL 含10000 单位, 在96 孔细胞培养板中, 做4倍梯度稀释,每个稀释度做复孔,共做10 个稀释度(1~10 孔)。
1.2.3.3 测定法
取孵育10 日龄发育良好的SPF 鸡胚。 参照《中国兽药典》中“细胞单层制备法”中“鸡胚成纤维(CEF)单层的制备”方法进行制备鸡胚成纤维细胞, 用完全培养液配制成每1mL 含5.0×105~6.0×105个细胞的细胞悬液。
CEF 细胞在培养条件下呈贴壁生长状态。 常规下细胞按1∶2~1∶4 传代,每周2~3 次,于营养液中生长。 具体操作简述为:将长满单层细胞瓶内培养液弃去, 用PBS 洗2 次后消化和收集细胞,将5.0×105~6.0×105个细胞的细胞悬液接种于96 孔细胞培养板中,每孔100μl。 于37℃、5%二氧化碳条件下培养18~24h。 将配制完成的供试品溶液移入接种CEF 细胞的培养板中, 每孔加入100μl。于37℃、5%二氧化碳条件下培养18~24h。弃去细胞培养板中的上清液。 将保存的水泡口炎病毒或鸡新城疫病毒(NDV,-70℃保存) 用攻毒培养液稀释至约100TCID50, 每孔100μl。 于37℃、5%二氧化碳培养24h 第11 号孔为病毒对照,不加干扰素保护,加病毒攻击;第12 号孔为细胞对照,不加干扰素保护,也不加病毒攻击。
1.2.3.4 结果观察
每隔24h 培养物置倒置显微镜下观察。 首先观察“细胞对照孔”和“病毒对照孔”,镜检病毒对照孔可见细胞圆缩脱落而细胞对照孔正常。 然后弃去细胞培养板中的上清液,每孔加入染色液50μl,室温放置30min 后,用流水小心冲去染色液,并吸干残留水分,每孔加入脱色液100μl[14],室温放置3~5min。 混匀后,用酶标仪以630nm 为参比波长, 在波长570nm 处测定吸光度,记录测定结果。
用Reed-Muench 法计算rChIFN-α 生物活性单位。 对所测样品进行重复测定,方法同上,重复4 次,并对所得结果进行统计学分析。
1.2.4 统计学分析
对所得数据进行相关性分析,并对两株病毒所测得的抗病毒活性及细胞与待测样品的不同加入方法所得结果进行配对t检验。
2 结果
2.1 VSV / NDV TCID5050 测定结果
分别将VSV / NDV 病毒进行TCID50 测定, 结果显示CEF细胞上VSV 病毒TCID50 为5.0×105/0.1mL,NDVTCID50 为1.0×106/0.1mL。
2.2 两株病毒检测rChIFN-α 生物学活性相关性结果
用结晶紫染色法分别在两种病毒株上(CEF/VSV 和CEF/NDV)对不同浓度干扰素样品测定了16 组数据,经统计学分析,2株病毒所测rChIFN-α 抗病毒活性具有很好的相关性,r=0.9999;经配对t 检验分析,2 组数据差异无显著意义(P=0.993726>0.05),见图1。
2.3 两株病毒测rChIFN-α 生物学活性重复性检测结果
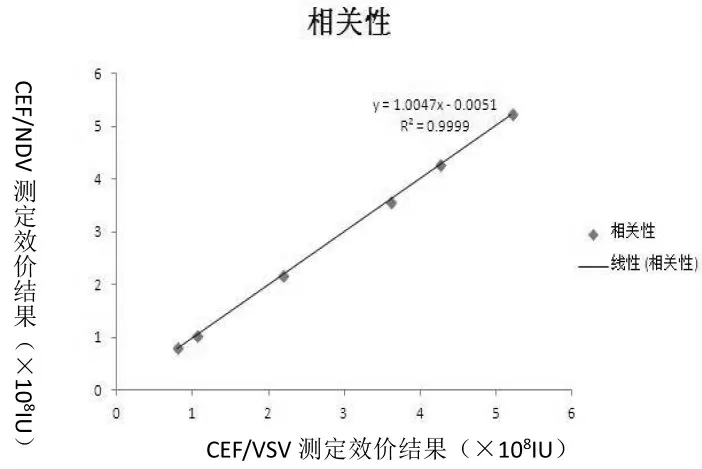
图1 两株病毒株测定rChIFN-α 效价的相关性结果
用微量细胞病变抑制法,分别在两种病毒株上(CEF/VSV 和CEF/NDV)对不同浓度干扰素样品进行重复性试验,检测4 次结果,两种病毒株重复性均较好,CV 值均<10%,但CEF/VSV 系统测定的rChIFN-α 生物学活性结果cv 值要低于CEF/NDV 系统,详细结果分别见表1 和表2。
3 结论与讨论
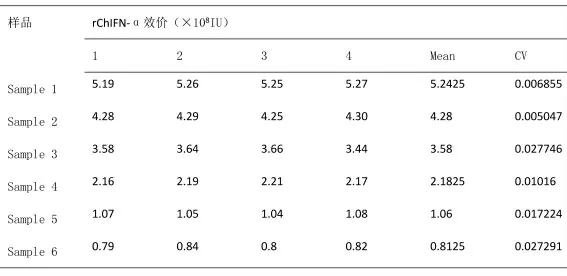
表1 CEF/ NDV 系统测定rChIFN-α 生物学活性重复性检测结果

表2 CEF/ VSV 系统测定rChIFN-α 生物学活性重复性检测结果
目前我国尚无重组鸡干扰素α 生物学活性测定方法国家标准,干扰素的效价取决于检测所用的细胞、病毒系统以及被测样品的类型。 而细胞病变抑制法无疑使测定干扰素小效价的唯一方法。
目前在已经报道的重组鸡干扰素α 生物学活性测定研究中,均采用的是细胞病变抑制法,主要是两类,一类是以NDV 病毒作为细胞病变的攻毒毒株, 如岳敏杰在对鸡干扰素α 在枯草芽孢杆菌中的表达及活性检测中,用的攻毒病毒为NDV 病毒[15],魏双施也在其对重组鸡α 干扰素的高效表达、 复性纯化和抗病毒研究中采用了CEF/NDV 检测系统[16];另外一类是以VSV 病毒作为病变系统的攻毒毒株, 如李皓洋在鸡干扰素α 和γ 在家蚕中的表达及其抗病毒活性检测中采用的CEF/VSV 系统等[17]。
本研究针对两个病毒体系进行了比较研究,表明,rChIFNα 在CEF/VSV 和CEF/NDV 两个系统中所测的效价基本一致,测定rChIFN-α 样品效价的重复性较好。 以上结果说明了rChIFNα 的测定中CEF/VSV 系统测定结果的CV 值要低于CEF/NDV系统,且用VSV 作为攻毒株作为病变毒株更符合干扰素测定标准,因此更适用于实验室对rChIFN-α 的生物学活性检测。

