艾叶提取物对凝血因子Ⅻ的作用机制和药效物质研究
王珊珊,徐 昊,陈 青,谭开云,凌 云,葛金文,
(湖南中医药大学 1.中西医结合心脑疾病防治湖南省重点实验室,湖南 长沙 410208,2.第一附属医院医务科,湖南 长沙 410008;3.中西医结合学院,湖南 长沙 410208)
血栓性疾病包括缺血性脑卒中、心肌梗塞、下肢深静脉血栓等。在中国,40岁以上中风患病率为2.21%,其中IS占病例总数的69.6%~70.8%[1-2]。随着血栓性疾病发病率的日益增加,呈年轻化趋势,其发病机制和新的防治药物开发仍是研究的热点。
目前认为,血栓性疾病是血栓形成与炎症反应互为因果的恶性循环结果。其中,凝血因子Ⅻ(coagulation factor Ⅻ,FⅫ)是一个关键的蛋白。其作为内源性凝血系统的启动蛋白,无论是先天缺陷者还是基因工程鼠均提示其未参与正常的生理止血过程。又由于在脑缺血模型和深静脉血栓模型中,基因敲除FⅫ的工程鼠造模处表现出更不明显的血凝块生成,因此,认为FⅫ与血栓性疾病密切相关。然而,进一步的研究提示FⅫ对血栓形成的作用与其特殊蛋白结构有关[3-4],但其机制并不明确。
艾叶为菊科植物艾ArtemisiaargyiLevl.et Vant.的干燥叶,《本草纲目》记载其具有“温中、逐冷、除湿”的作用。《本草从新》中将其功效拓展为“逐寒湿,暖胞宫,止诸血,温中开郁,调经安胎”。尽管医书记载和现代药理研究均表明艾叶有止血功效,但临床上,艾叶除了用于小的外伤止血外,还广泛应于血栓性疾病后遗症期和淤血疼痛患者中,以帮助病人缓解症状、恢复功能。大量动物基础研究显示,艾叶在体内、外实验中均表现出抗凝、止血、活血的调节效应,其可能与特殊的炮制手段密切相关[5-6]。这种抗凝、促凝的双向调节作用可能有利于治疗血栓性疾病而不引起不可控出血的发生。本课题组前期研究也证实,在体外实验中,艾叶提取物有效缩短了健康人血浆复钙时间,其主要与FⅫ激活有关[7],而艾叶对FⅫ的激活位点目前并不清楚。同时,前期研究还发现,尽管艾叶提取物有促凝活性,但其明显延长了健康人和新西兰白兔血浆的活化部分凝血活酶时间(activated partial thromboplastin time,APTT),提示该提取工艺下可能存在抗凝、促凝两种物质,基于此,本研究通过检测艾叶提取物对脑缺血病人血浆凝血的影响、对FⅫ的激活作用,同时,对该种提取工艺的艾叶提取物进一步分离,对不同提取组分的活性作用进行研究,试图阐明其促凝、抗凝的所用机制及其可能的活性物质基础。
1 材料与方法
1.1 试剂与耗材干艾叶 1 kg(湖南中医药大学第一附属医院药房提供);缺乏FⅫ人血浆(113406,STAGO,法国)、APTT(114145,STAGO,法国)、凝血酶原时间(prothrombin time,PT,112978,STAGO,法国)、凝血酶时间(thrombin time,TT,113668,STAGO,法国)、纤维蛋白原(fibrinogen,FIB,119255,STAGO,法国)、His标签抗体(CST,12698P)、鼠抗羊荧光二抗(Abcam,ab6785)。
1.2 血浆制备脑缺血病人全血(纳入标准:45~65岁,以脑缺血急性发病期为诊断,无阿司匹林、华法林等抗凝药物服用史,临床暂未使用抗凝、溶栓药物处理的入院首次抽血)来源于湖南中医药大学第一附属医院神经内科。于湖南中医药大学中西医结合心脑疾病防治实验室离心制备成血浆。
1.3 FⅫ、FⅫ-2蛋白制备FⅫ全长载体,FⅫ-2突变载体构建于上海吉满公司。质粒转染、慢病毒制备、转入HEK293细胞,提取细胞上清液,上样His-tag柱,5%咪唑洗脱,得到纯化FⅫ、FⅫ-2蛋白。
1.4 艾叶提取物制备取1 kg干燥艾叶,制备为终浓度1 mg·L-1的艾叶提取物,C18柱分离层析艾叶提取物,分别用超纯水、10%、30%、50%、70%、100%甲醇洗脱、烘干。在每个组分中加入5 mL超纯水溶解样本,编号LODB1、LODB2、LODB3、LODB4、LODB5、LODB6。
1.5 艾叶提取物体外凝血实验取脑缺血病人血浆与125 g·L-1的艾叶提取物1 ∶1充分混匀后检测凝血4项(APTT、PT、TT、FIB)及FⅫ活性,记录数值。
1.6 艾叶提取物干预凝血因子活性实验参照文献处理[8],取45 μL FⅫ-2纯化蛋白分别与45 μL超纯水、高岭土试剂(FⅫ特异性激活剂)、0.062 5、0.125、0.25、0.5 mg·L-1艾叶提取液混合,编号:阴性对照组、阳性对照组、FⅫ(FⅫ-2)低(8 ∶1)、中(4 ∶1)、高(2 ∶1)、超高剂量(1 ∶1)艾叶组。37 ℃孵育5 min,10 000 r·min-1离心5 min,进行Western blot实验,检测灰度值。
1.7 艾叶分离成分活性实验取脑缺血病人血浆分别与0.125 mg·L-1的LODB1、LODB2、LODB3、LODB4、LODB5、LODB6,充分混匀后检测APTT、PT、TT,记录数值。
取45 μL FⅫ纯化蛋白分别与45 μL超纯水、高岭土试剂、终浓度为0.125 mg·L-1LODB1-6混合,编号:空白组、高岭土组、LODB1组、LODB2组、LODB3组、LODB4组、LODB5组、LODB6组。37 ℃孵育5 min,10 000 r·min-1离心5 min,进行Western blot实验,检测灰度值。
取45 μL FⅫ纯化蛋白分别与45 μL超纯水、高岭土试剂、终浓度分别为0.012 5、0.062 5、0.031 3、0.015 6 mg·L-1的LODB5或LODB6混合,编号:阴性对照组、阳性对照组、LODB5(LODB6)高剂量组、LODB5(LODB6)中剂量组、LODB5(LODB6)低剂量组、LODB5(LODB6)超低剂量组。37 ℃孵育5 min,10 000 r·min-1离心5 min,进行Western blot实验,检测密度值。
1.8 艾叶有效成分分析实验将艾叶提取液LODB5过滤除杂。以流动相水 ∶乙腈=90 ∶10的条件上样5 μL样本入超高效液相-质谱(LC-MS)跑样20 min,洗柱保存数据。比对Batman数据库及有关文献报道的艾叶提取液已知的单体成分,分析推断可能的物质基础。

2 结果
2.1 艾叶提取物对脑缺血病人凝血功能的影响如Fig 1所示,艾叶提取物延长了脑缺血病人血浆PT、APTT、TT时间,差异有显著性(P<0.01),但其不影响纤维蛋白含量,差异无统计学意义。此外,艾叶提取物降低了FⅫ活性,差异有显著性(P<0.01),提示艾叶提取物抑制了高岭土对FⅫ的激活。
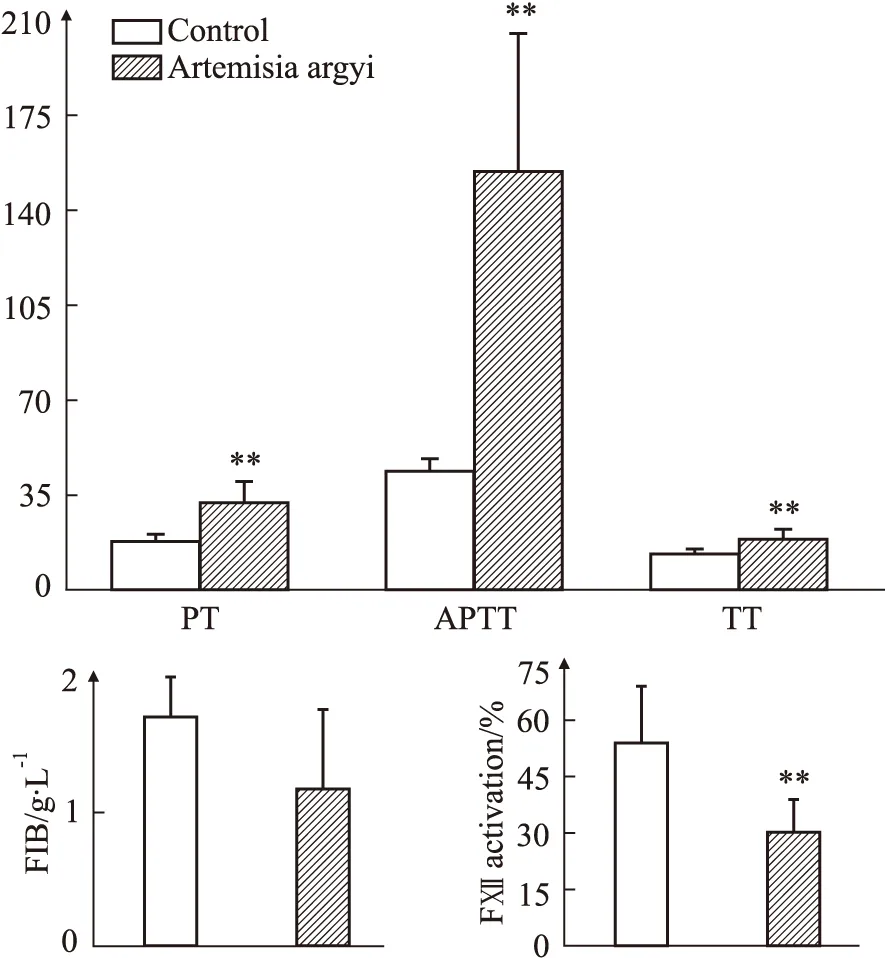
Fig 1 Intervention effect of Artemisia argyi extract on blood coagulation and factor activity in plasma of patients *P<0.05,**P<0.01 vs control
2.2 艾叶提取物对不同结构的凝血因子(Ⅻ)蛋白活性的干预作用如Fig 2所示,在FⅫ蛋白激活实验中,相比于空白组,艾叶低、中、高、超高剂量组的FⅫ密度值明显降低,差异有显著性(P<0.01);在FⅫ-2激活实验中,相比于空白组,艾叶中、高剂量组的FⅫ-2密度值明显降低,差异有统计学意义(P<0.05),在相同艾叶提取物剂量下,相比于FⅫ,在艾叶低、中、高、超高剂量组的FⅫ-2密度值明显高于FⅫ,差异有统计学意义(P<0.05),提示了艾叶对FⅫ的激活强于对FⅫ-2。
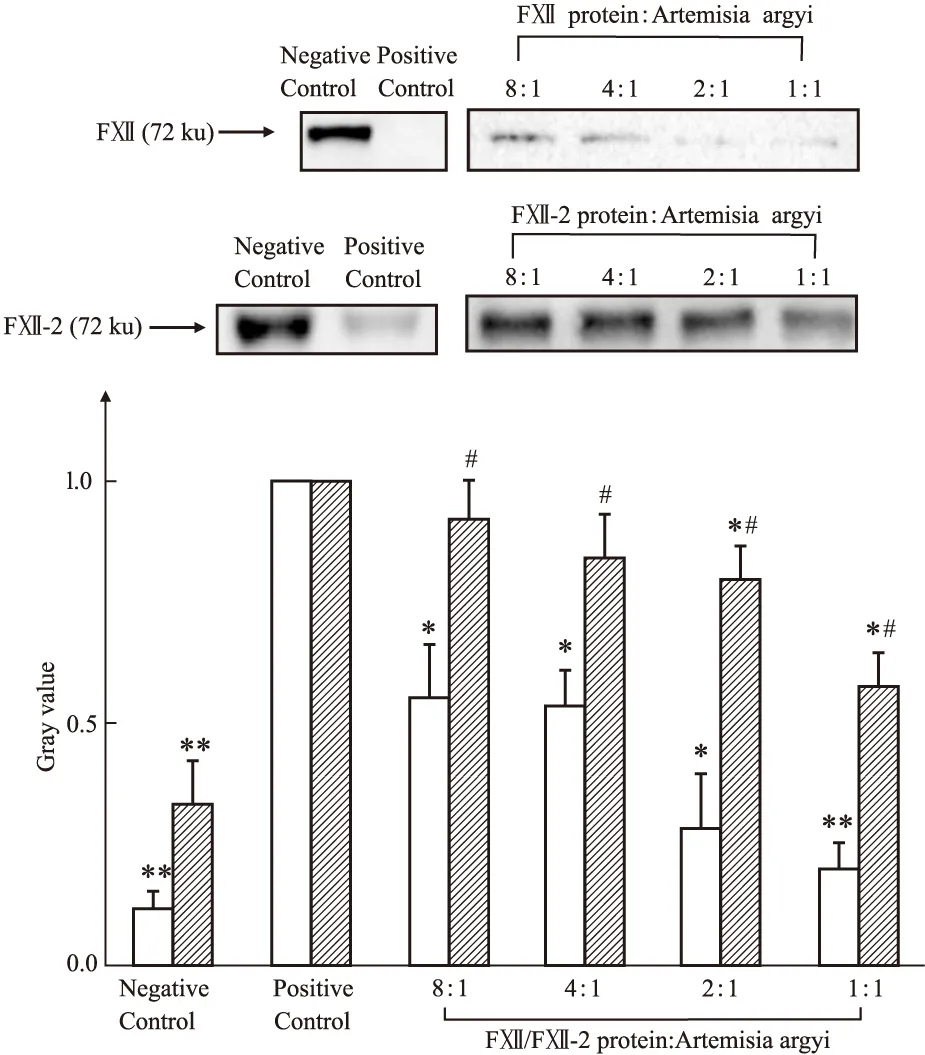
Fig 2 Activation of FⅫ and FⅫ-2 in Artemisia argyi extract *P<0.05,**P<0.01 vs control;#P<0.05 vs FⅫ
2.3 艾叶提取物不同组分对凝血功能的干预作用如Fig 3所示,在脑缺血病人血浆中,相比于空白组,LODB1组、LODB2组、LODB3组的APTT、PT、TT值没有明显改变,差异无统计学意义(P>0.05)。LODB4组的APTT值延长,差异有统计学意义(P<0.05)。LODB5组的APTT、PT、TT均有明显延长,其中APTT延长最为明显,差异有显著性(P<0.01)。在连续监测血浆凝固实验中,LODB6的OD值从第5 min起即明显增加,差异有显著性(P<0.01)。
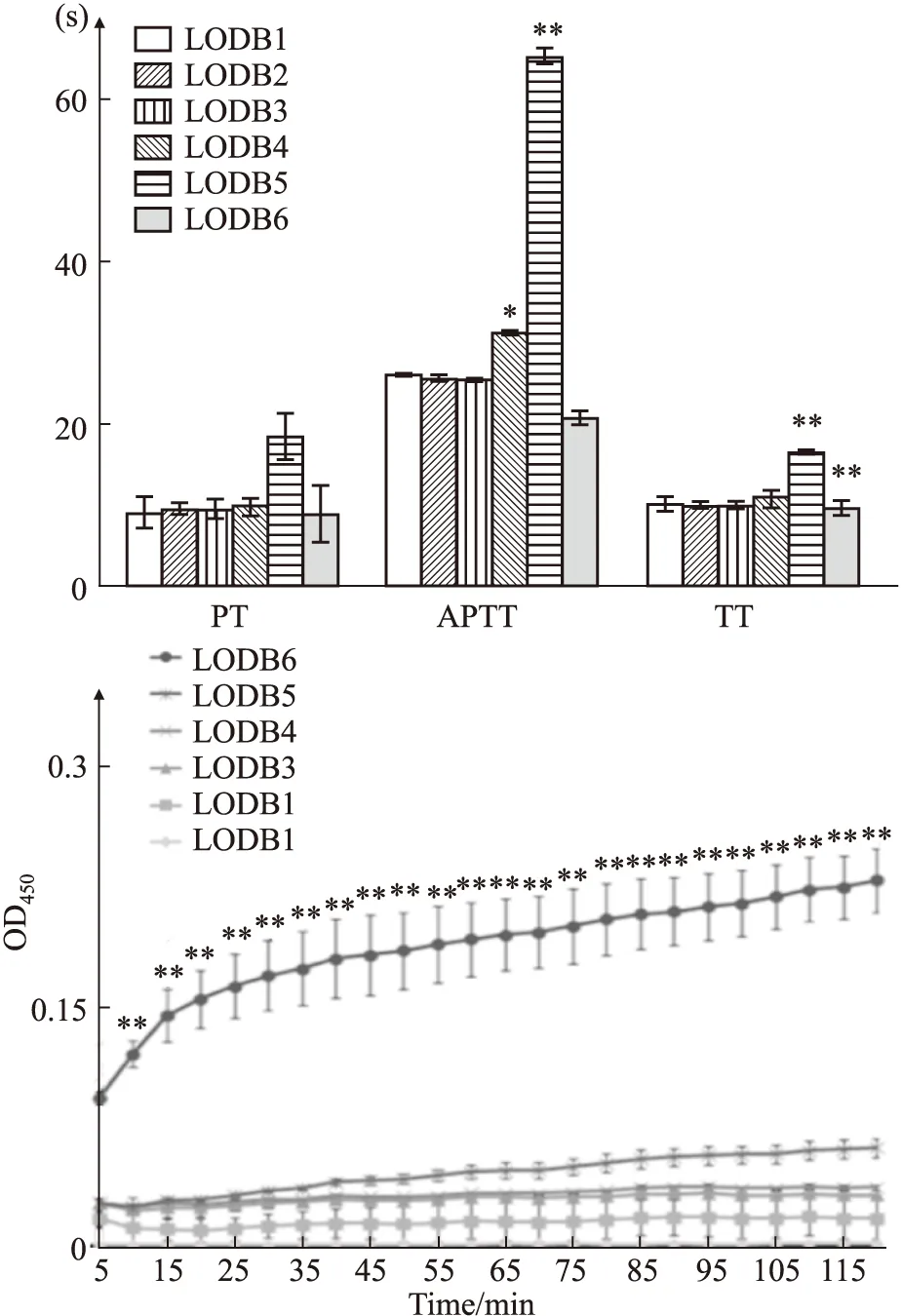
Fig 3 Intervention effect of LODB1-LODB6 on blood coagulation in plasma of patients with *P<0.05,**P<0.01 vs LODB1.
2.4 艾叶不同组分对FⅫ的激活作用Fig 4所示,LODB1,LODB2、LODB3对FⅫ的密度值没有明显影响,无统计学意义。而LODB4组、LODB5组、LODB6组明显降低了FⅫ的密度值,差异有显著性(P<0.01),其中LODB6组减少得最为明显,提示LODB4-6对FⅫ有激活作用。
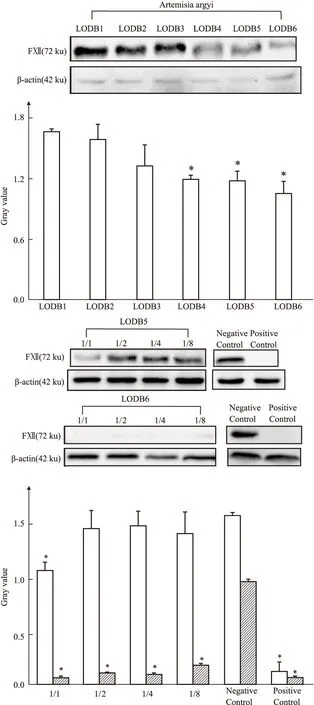
Fig 4 Activation of FⅫ in LODB1-LODB6 *P<0.05 vs control.
2.5 艾叶提取物LODB5成分分析如Fig 5所示,在LC-MS检测中,共发现17种主要物质,通过Batman数据库,并结合目前文献报道对已知艾叶90种成分进行比较,得到分子量相近的6种含量较高化合物,如Tab 1所示,分别为:异戊酸冰片酯、棕矢车菊素、5,6,4′-三羟基-7,3′-二甲氧基黄酮、伞形花内酯、丁香酚、紫花牡荆素。
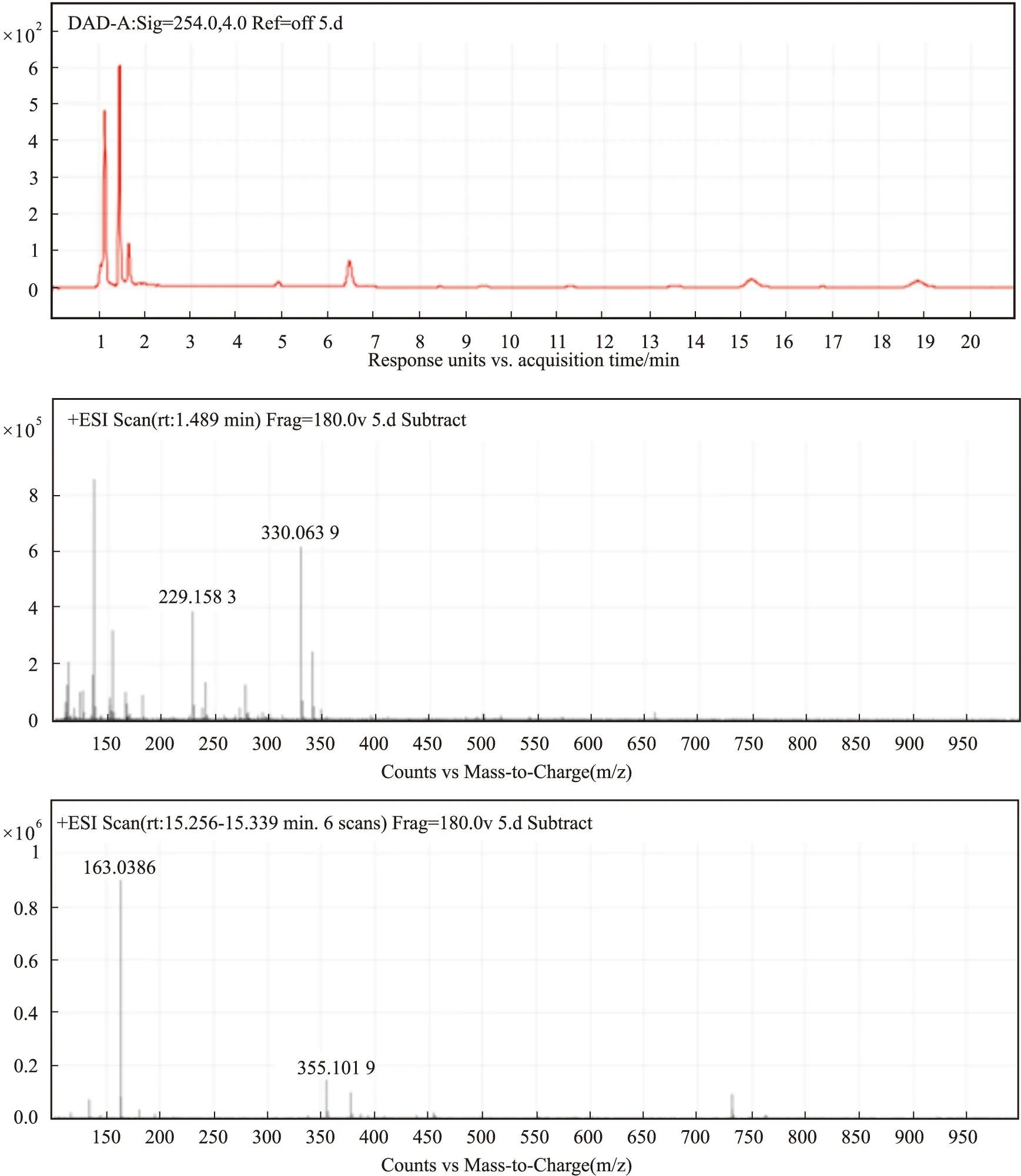
Fig 5 Liquid chromatography-mass spectrometry analysis of LODB5
Tab 1 Substances 'molcular and structural characteristic of LODB5 n=3)
3 讨论
IS是一种典型的动脉血栓性疾病,其高发病率、高致残率、高死亡率使得其一直是研究的热点。尽管抗凝新药日益增多,但其主要针对凝血酶及FⅩa产生抑制或灭活,不可控出血一直是难以解决的副作用[3]导致临床运用受限。
艾叶相比与临床常用的抗凝药物,如阿司匹林、华法林等其优势在于不会引起不可控出血。本项目组前期在正常人和兔血浆中发现,在经过一系列提取工艺后,艾叶提取物对兔血浆具有促凝-活血双向调节作用,但其机制仍未能阐明。基于此,本项目在脑缺血病人血浆基础上进一步开展了相关研究,试图阐明其对FⅫ的作用机制及其可能的物质基础。
本课题前期在健康人血浆中确定了该种提取工艺下的艾叶提取物具有促凝-活血双向调控药效作用,其有效延长了人血浆PT、APTT时间。为研究其变化规律,对57例IS病人的凝血功能和因子活性也进行了分析,结果显示脑缺血病人血浆的凝血功能和因子活性与健康人相比,虽然整体统计学上没有意义,但却有更大的波动,提示了脑缺血病人有不同程度的凝血因子功能紊乱。因此,本项目针对脑缺血病人进一步验证艾叶提取物的作用,得到了与健康人一致的结果。提示该种艾叶提取物对内源性凝血和外源性凝血途径均有明显的抑制作用,其很可能作用于凝血通路的共同途径,即FⅩ(a)、凝血酶(原)和纤维蛋白(原)。在TT、FIB、FⅩ活性实验中,艾叶提取物还明显延长TT,但对FⅩ没有影响,也不会导致FIB的减少,因此,本项目推测其抗凝药效作用是限制了凝血酶活性。然而,艾叶提取物对APTT的作用更明显,这可能是因为艾叶提取物和高岭土间可能存在竞争性抑制关系,导致高岭土激活作用被艾叶提取物取代,而艾叶提取物对FⅫ的激活较高岭土更缓而温和,从而,导致了APTT的明显延长的原因。FⅫ特殊的蛋白结构使其有不同的激活位点,不同位点的激活的FⅫ对下游底物有不同的激活效应[9-10]。为了检测艾叶提取物对FⅫ的作用位点,本项目通过截断FⅫ的EGF-Like2结构域,合成了缺EGF-Like2的FⅫ-2截短蛋白。结果显示,在相等浓度下,艾叶提取物对FⅫ-2的激活效应明显弱于对FⅫ,提示艾叶提取物中的有效成分对FⅫ的激活位点可能位于FⅫ的EGF-Like2结构域上。
艾叶含有挥发油、黄酮类、鞣酸类、桉叶烷类、三萜类等多种成分[11],因此,关于艾叶的凝血-抗凝血双向调节作用很多研究者认为与艾叶的成分密切相关。例如,鞣酸类就是最强的促凝物质,而萜类、黄酮类物质是艾灸与擦剂的主要药物成分,有通经活络,化瘀活血之功,其中,5,6,2′,4′-四羟基-7,5′-二甲氧基黄酮和eupatilin 7-O-β-d-吡喃葡糖苷就可明显延长TT时间[12]。
在各组分活性实验中,本项目组发现50%~100%甲醇组分中包含着关键的活性物质。其中,70%甲醇提取组分(LODB5)有明显的抗凝效应,显著延长了健康人血浆APTT、PT、TT提示其可能含有抑制凝血酶活性的成分。而100%甲醇提取组分(LODB6)虽然对APTT、PT、TT没有影响,但在连续血凝检测中,在没有CACl2的条件下,LODB6即有显著凝血反应,导致了纤维蛋白的持续性生成。提示其可能含有激活FⅫ的物质。在FⅫ激活实验中,高浓度的LODB5对FⅫ也有激活效应,提示了LODB5是艾叶提取物凝血-抗凝血的关键的组分。通过LC-MS分析,本项目组在LODB5中发现了6种主要物质,这可能与艾叶提取液的双向调节作用有关。
艾叶提取物可激活FⅫ产生促凝活性,该作用与其EGF-Like2结构域有关。但艾叶提取物对脑缺血病人血浆整体表现出抗凝活性。其促凝、抗凝的药效物质基础可能是异戊酸冰片酯、紫花牡荆素、棕矢车菊素、伞形花内酯、5,6,4′-三羟基-7,3′-二甲氧基黄酮、丁香酚。