FKBP38蛋白对人源子宫内膜癌细胞增殖及侵袭的调控
闫云静,王 帅,穆云萍,赖姨梅,李芳红
(1.广东工业大学生物医药学院,广东 广州 510006;2.赣南医学院第一附属医院病理科,江西 赣南 341000)
子宫内膜癌(endometrial carcinoma,EC)是源于子宫内膜上皮的妇科恶性肿瘤,其发病率在女性肿瘤中位于第六位[1]。如能早期诊断,子宫内膜癌病人具有良好的预后结果,但仍有15%~25%患者就诊时已是晚期,诊断晚期或复发病例的中位生存时间不超过1年[2]。因此,对于EC的筛查、诊断以及治疗的分子新靶点及机制的研究尚有许多问题有待解决。
FK506结合蛋白38(FK506-bindingprotein 38,FKBP38)作为免疫亲和素的一员,与癌症发生可能有密切关系。FKBP38是哺乳动物的雷帕霉素靶标(mammalian target of rapamycin,mTOR)内源性抑制剂,可通过与mTOR 相结合来抑制mTOR的下游通路[3]。研究表明[4],在高转移乳腺癌细胞4T1及黑色素瘤细胞B16-F10中,FKBP38发挥着抑制肿瘤转移的作用。此外,前期研究发现,FKBP38蛋白与多种癌症发生发展具有一定相关性[5-6],进一步表明FKBP38蛋白可能在抑制癌细胞增殖活性或抑制细胞转移等方面发挥着重要作用。
本研究首次检测了不同分级、不同分期子宫内膜癌细胞中FKBP38蛋白表达水平变化,并通过在细胞水平过表达FKBP38研究其对子宫内膜癌细胞AN3Ca的影响。为进一步探讨FKBP38对于癌症的作用机制奠定基础。
1 材料与方法
1.1 材料
1.1.1细胞及病毒 人源子宫内膜癌细胞Ishikawa(Grade 1),RL95-2,Hec-1-A,Hec-1-B(Grade 2),AN3Ca (Grade 3) 均购美国细胞研究库(American Type Culture Collection,ATCC)。FKBP38过表达慢病毒载体购自广州赛业公司,慢病毒载体为LV-EF1a>hFKBP38 [NM-012181.4]-CMV>eGFP/T2A/Puro 和LV-CMV>eGFP/T2A/Puro(以下分别标为FKBP38及Vector)。慢病毒中包括FKBP38全长cDNA,所有结构都经DNA测序验证,转染效果经实时定量PCR(real-time quantitative PCR,RT-qPCR)及免疫印迹(Western blot)验证。
1.1.2试剂 RPMI1640(Lot:1976019),DMEM(Lot:2105326),DMEM-F12(1973914),McCoy’s 5A(Lot:SLBN4158V),胎牛血清和胰酶(Lot:2120649)均购自美国Gibco公司,E.Z.N.A.Total RNA KitⅠ购自美国OMEGA公司,ProteinK选自美国Sigma 公司,Power SYBR Green PCR Master Mix选自Vazyme公司。Pierce BCA Protein Assay Kit选自美国Thermo公司,引物由上海生工生物有限公司合成。FKBP38、蛋白激酶B( Protein kinase B,Akt)、核糖体蛋白S6( Ribosomalprotein S6,S6)抗体购自R&D 公司,真核起始因子4E结合蛋白1(Eukaryotic translation initiation factor 4E-binding protein 1,P-4E-BP1)、P-4E-BP1、p-Akt、P-S6抗体购自CST公司。Edu检测试剂盒购自广州锐博生物科技有限公司。Transparent PET Membrane 24 Well 8.0 μm pore size及 Invasion Chambers with 8.0 μm PET Membrane in two 24 Well Plates 购自美国Corning公司。
1.1.3仪器 AC2-4S1型二级生物安全柜(ESCO,新加坡);CLM-170B-8-NF型二氧化碳培养箱(ESCO,新加坡);TDZ5-WS型多管架自动平衡离心机(上海卢湘仪离心机仪器有限公司);ChemiDoc+XRS化学发光凝胶成像系统(Bio-Rad,美国);Leica倒置显微镜(Leica德国);CMAXPLUS+酶标仪(美国);-80 ℃冰箱(中国美菱)。
1.2 方法
1.2.1细胞培养 Ishikawa细胞于RPMI 1640+10%FBS培养基进行培养,RL95-2细胞于DMEM+10%FBS培养基进行培养,Hec-1-A细胞于McCoy's 5A+10%FBS培养基进行培养,Hec-1-B细胞于DMEM-F12+10%FBS培养基进行培养,AN3Ca细胞于MEM+10%FBS培养基培养,所有细胞均于37 ℃,5% CO2培养箱培养。待细胞长至培养皿70%~80%进行传代。
1.2.2细胞分组及感染 将AN3Ca细胞分为对照组(Vector)及过表达FKBP38组(FKBP38),将细胞接种于6孔板,待细胞长于60%时进行病毒感染实验,收集细胞抽提RNA及蛋白进行RT-PCR及Western blot检验病毒干扰效率。
1.2.3细胞mRNA水平检测 将培养的子宫内膜癌细胞利用E.Z.N.A.Total RNA Kit试剂盒提取RNA,再通过逆转RNA得到cDNA,Vazyme公司的Power SYBR Green PCR Master Mix为体系对相应的目的基因进行进行RT-RCR。FKBP38 上游引物:5′-TCCAGCGCCAAAGTG GACAT-3′,下游引物:5′-GAGCTCTGCGTGGATCG TCT-3′;β-actin上游引物:5′-GATTACTGCTCTGGC TCCTAGC-3′,下游引物:5′-GACTCATCGTACTCCTG CTTGC-3′。
1.2.4细胞蛋白水平检测 取10 cm细胞培养皿加入100 μL添加有PMSF的RIPA裂解液,用无菌细胞刮刮下,于95 ℃金属浴变性5 min,超声破碎,12 000 r·min-1离心5 min取上清,将提取的蛋白用BCA测浓度,Western blot检测各细胞中FKBP38表达。
1.2.55-乙炔基-2′-脱氧尿苷(5-Ethynyl-2′-deoxyuridine,Edu)检测细胞增殖 将细胞消化制成细胞悬液,将细胞以1 000/孔的密度均匀加入96孔板,48 h后根据Edu检测试剂盒说明书进行Edu染色,荧光倒置显微镜检测细胞染色情况并进行拍照统计。
1.2.6平板克隆实验 将AN3Ca细胞以600个/孔密度均匀铺于35 mm培养皿,每孔加入2 mL培养基,放于37 ℃细胞培养箱培养10 d,10 d后去除上清,每孔加入800 μL 4%多聚甲醛固定15 min,结晶紫染色10 min,无菌水洗3遍去除背景色,晾干统计形成克隆的数目,实验重复3遍。
1.2.7Transwell小室实验[7]取对数生长期细胞换为无血清培养基进行饥饿10 h,10 h后制成细胞悬液。迁移实验:细胞计数,AN3Ca细胞以1.5×105密度加入Tranwell 小室上室中,下室中加入800 μL含20%FBS培养基,37 ℃培养箱培养24 h。侵袭实验:将冻存于-20 ℃带有Matrigel胶小室提前2 h放于37 ℃融化,细胞计数,AN3Ca细胞以2×105密度加入带有基质胶的小室上室中,下室中加入800 μL含20%FBS完全培养基,37 ℃培养箱培养24 h。24 h后取出上层小室,弃内侧废液,用棉签轻轻擦拭微孔膜内侧,PBS清洗内侧3遍,4%多聚甲醛固定150 min,结晶紫染色10 min,清洗,倒置晾干,于倒置显微镜下观察拍照。
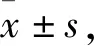
2 结果
2.1 不同病理分级子宫内膜癌细胞中FKBP38表达情况Realtime quantitative PCR(RT-qPCR)结果显示(Fig 1A),与病理分级较低Ishikawa细胞相比,Hec-1-A、Hec-1-B、RL95-2及AN3Ca病理分级较高子宫内膜癌细胞中FKBP38 mRNA表达较低,对比Ishikawa细胞,差异具有统计学意义(P<0.01)。此外,Western blot检测FKBP38蛋白的结果显示相同趋势(Fig 1B)。实验表明不同病理分级子宫内膜癌细胞中FKBP38表达不同,并且随着病理分级的增加,FKBP38表达量降低。
Fig 1 FKBP38 expression in each group of five human endometrial cancer cellsA:The mRNA expression in five endometrial cancer cell lines Protein levels in five endometrial cancercell lines.**P<0.01 vs Ishikawa
2.2 稳定过表达FKBP38的子宫内膜癌细胞株的建立利用携带FKBP38的病毒感染人子宫内膜癌细胞AN3Ca。随后,我们利用RT-qPCR手段检测FKBP38的表达水平。结果显示(Fig 2),与对照病毒感染组相比,FKBP38过表达病毒使AN3Ca细胞中FKBP38的mRNA水平升高(P<0.01)。Western blot检测两组中FKBP38蛋白的结果与RT-qPCR分析的结果相符,即在AN3Ca细胞中感染过表达FKBP38病毒后,FKBP38蛋白水平上调。以上结果表明稳定过表达FKBP38的AN3Ca细胞株构建成功。
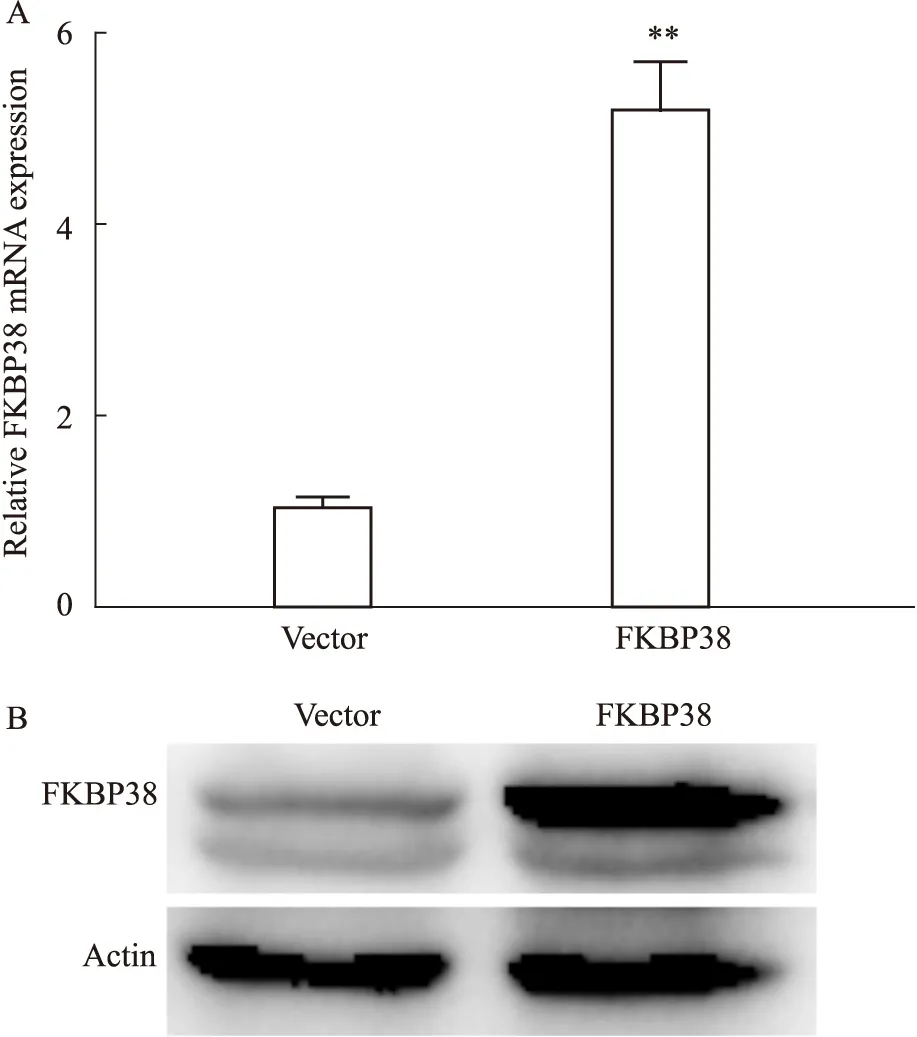
Fig 2 FKBP38 expression in vector and FKBP38 overexpression groupsA:The mRNA expression in Vector and FKBP38 ;B:Protein levels in Vector and FKBP38.**P<0.01 vs vector
2.3 FKBP38对子宫内膜癌细胞体外增殖能力影响Edu实验结果显示,过表达FKBP38后AN3Ca细胞增殖能力降低(P<0.01)(Fig 3),结果表明,过表达FKBP38可抑制子宫内膜癌细胞AN3Ca体外增殖活力。
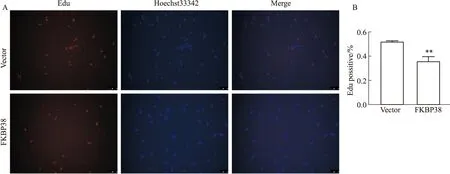
Fig 3 Effect of FKBP38 over expression on cell proliferation of AN3Ca vs vector
平板克隆实验可检测细胞增殖能力及群体依赖性。Fig 4实验结果显示,与Vector相比,AN3Ca细胞过表达FKBP38后细胞克隆的数目明显减少(P<0.01)。实验进一步表明FKBP38可抑制子宫内膜癌细胞AN3Ca的增殖能力。
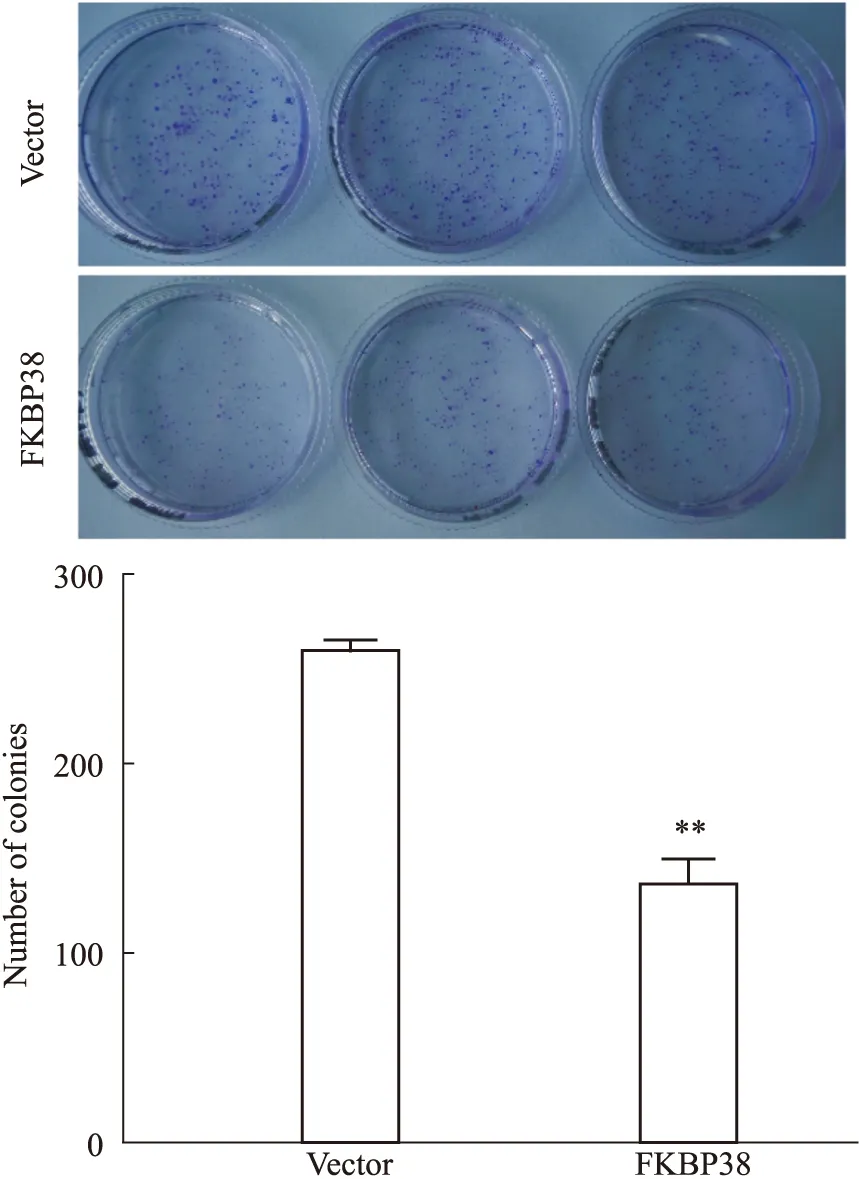
Fig 4 Effect of FKBP38 over expression on plate colony assay of AN3Ca cells n=3)**P<0.01 vs vector
2.4 FKBP38对子宫内膜癌细胞迁移及侵袭能力影响通过(无/有)基质胶的Transwell小室检测过表达FKBP38后子宫内膜癌细胞AN3Ca的迁移及侵袭能力变化,Fig 5结果显示,过表达FKBP38后细胞穿过微孔膜的细胞个数显著减少(P<0.01)。以上实验表明,FKBP38可抑制子宫内膜癌细胞AN3Ca的迁移及侵袭能力。

Fig 5 Effect of FKBP38 over expressionon migration(A) andinvasion (B) of AN3Ca cells n=3)**P<0.01 vs vector
2.5 FKBP38过表达对子宫内膜癌细胞AN3CAmTOR通路影响通过Western blot检测子宫内膜癌细胞AN3CA过表达FKBP38对mTOR通路的影响,结果表明,细胞过表达FKBP38后P-S6、P-4E-BP1、4E-BP1蛋白无明显变化,但S6总蛋白表达增加(Fig 6)。这提示子宫内膜癌细胞中可能存在反馈系统,在细胞S6相对磷酸化水平降低时通过过表达S6总蛋白来增加P-S6含量。此外,过表达FKBP38蛋白可降低Akt蛋白磷酸化水平,说明FKBP38蛋白可能是通过调控Akt磷酸化水平来调控信号通路。
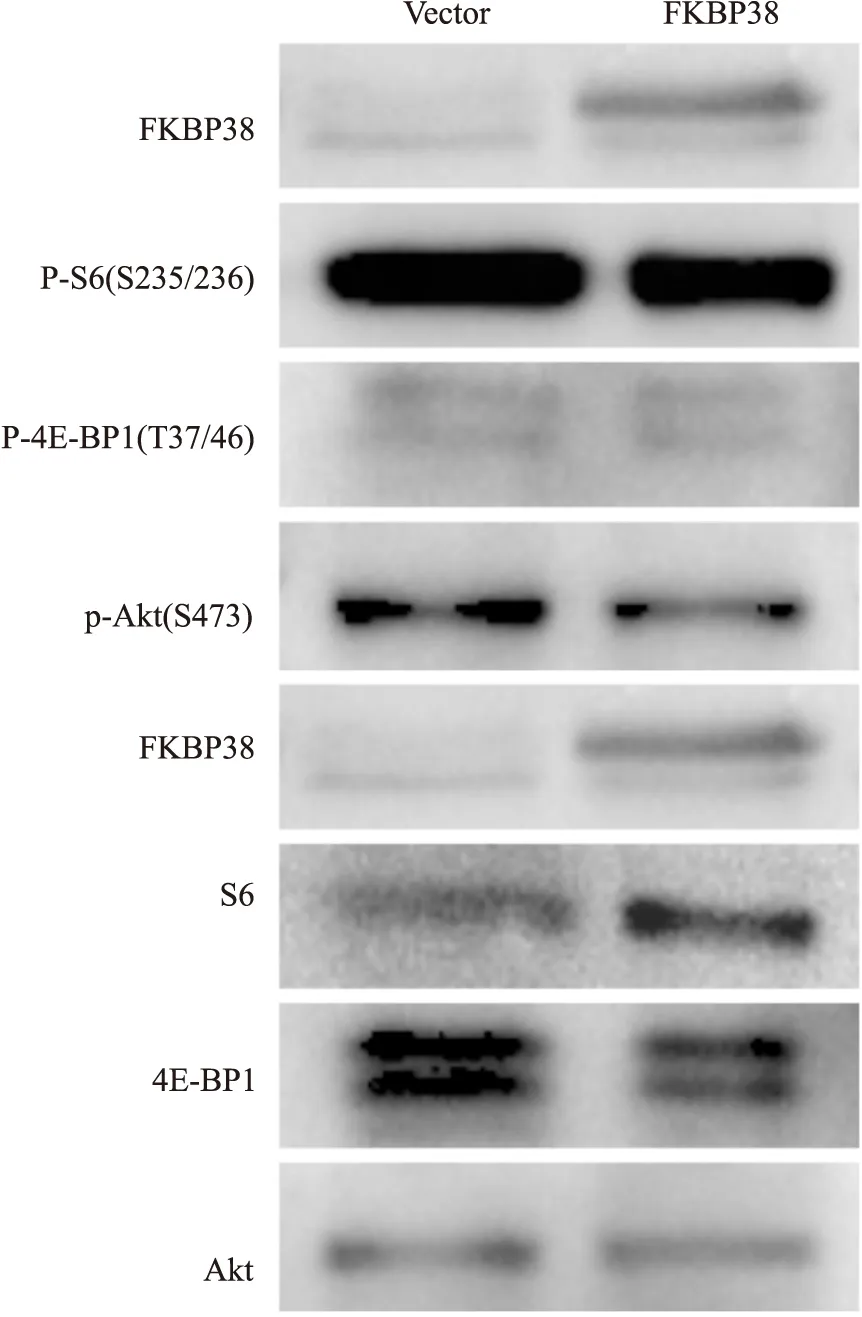
Fig 6 Effect of FKBP38 over expression on mTOR pathway of AN3Ca cells
3 讨论
子宫内膜癌是最常见的女性生殖系统的恶性肿瘤,其死亡率仅次于宫颈癌[1]。子宫内膜癌的治疗主要是通过手术切除子宫、卵巢、输卵管或辅以化疗。为更好评估子宫内膜癌的生物学个体疾病行为并最终改善治疗决策和结果,领域内专家已提出将分子特征与子宫内膜癌分类及风险评估结合起来[8]。其中包括磷脂酰肌醇-3激酶(phosphatidyli-nositol 3-kinase,PI3K)/Akt/mTOR、RAS-RAF-MEK-ERK 等信号通路。其中mTOR通路为关键性通路之一。mTOR是细胞生长增殖的中心调控分子。mTOR存在两种生化和功能不同的复合物,mTORC1和mTORC2,其中mTORC1通过作用于底物核糖体S6激酶1(ribosomal protein S6 kinase beta-1,S6K1)和4E-BP1的磷酸化水平来调节细胞生长和增殖。mTORC2可通过磷酸化Akt来调控Akt的活性[9]。
mTOR通路在多种肿瘤类型(包括子宫内膜癌)的发生发展中起关键作用[10]。研究发现骨化三醇联合雷帕霉素可协同抑制人子宫内膜癌细胞株Ishikawa的增殖[11],临床研究表明,mTOR抑制剂在子宫内膜癌中表现出临床活性,抑制mTOR通路可能是一个可行的治疗靶点[12]。前期的文献报道中已经证明,FKBP38蛋白是通过结合Rheb1从而成为mTOR内源性抑制剂,也可与mTOR以类似FKBP12-mTOR结合方式结合从而抑制mTOR的活性[9]。另外,FKBP38为线粒体膜蛋白,可招募BCL-2至线粒体上抑制凋亡[13]。FKBP38在多种癌组织中均有不同程度的下调,说明FKBP38可能在抑制癌细胞增殖的过程中发挥着重要作用[6]。此外Sylvia Fong等[4]发现FKBP38可抑制乳腺癌细胞4T1 及黑色素瘤细胞B16-F10转移能力,进一步表明FKBP38可能与癌细胞增殖或转移相关。
为研究FKBP38对子宫内膜癌细胞增殖及侵袭的影响,本实验检测了不同分级的子宫内膜癌细胞中FKBP38表达水平,并通过过表达FKBP38来检测其对于子宫内膜癌细胞的影响。我们的研究结果发现,不同病理分级,不同分期子宫内膜癌细胞中FKBP38表达不同,随着病理分级升高FKBP38表达水平逐渐降低。为研究不同病理分级子宫内膜癌细胞FKBP38的表达,我们选取了5株不同病理分级的子宫内膜癌细胞进行研究。为进一步研究FKBP38对于子宫内膜癌的影响,我们选取FKBP38表达量显著降低的子宫内膜癌细胞系,AN3Ca,来过表达FKBP38检测其表型变化。在子宫内膜癌细胞AN3Ca中过表达FKBP38后发现细胞增殖活力显著降低,说明FKBP38可能在子宫内膜癌发生发展过程中发挥着抑制细胞增殖的作用。虽然这可能与前期研究中FKBP38可招募Bcl-2至线粒体抑制凋亡作用相矛盾,但Huang等[14]指出,死亡的肿瘤细胞可利用凋亡过程产生强有力的生长刺激信号,以刺激肿瘤细胞的再生,表明某一基因可能同时存在增强细胞增殖及凋亡的作用。此外,本研究发现FKBP38可有效抑制AN3Ca细胞的迁移及侵袭能力。为研究FKBP38对于子宫内膜癌细胞AN3Ca细胞的作用机理,我们检测mTORC1的直接下游底物,通过验证S6和4EBP-1 的磷酸化水平来间接地验证mTOR 的激活水平,此外,我们还检测mTOR的重要调控靶点Akt的磷酸化水平。
综上表明,子宫内膜癌细胞AN3Ca过表达FKBP38后,mTOR下游基因S6磷酸化水平对比对照组无明显变化,但S6总蛋白表达增加,这提示我们子宫内膜癌细胞中可能存在反馈系统,在细胞S6相对磷酸化水平降低时通过过表达S6总蛋白来增加P-S6含量。4E-BP-1磷酸化水平无明显变化,提示我们在子宫内膜癌中FKBP38可能未通过调节4E-BP-1蛋白表达来调节子宫内膜癌细胞增殖、侵袭等生理活动。此外,Akt的磷酸化水平降低,表明过表达FKBP38蛋白可降低Akt蛋白磷酸化水平。但是FKBP38下调Akt的信号通路机制有待进一步研究。