石斛酚对同型半胱氨酸诱导的人微血管内皮细胞NLRP3炎性体激活的影响
王 伟,陈亚军,耿 明,徐忠东,戴 敏
(1.合肥师范学院生命科学学院,安徽 合肥 230601;2.安徽中医药大学药学院,安徽省中药研究与开发重点实验室,新安医学教育部重点实验室,安徽合肥 230031)
动脉粥样硬化(atherosclerosis,AS)是一种动脉内膜炎性疾病,其并发症如心肌梗塞和中风是全世界范围内最常见的死亡原因[1]。前期研究证实血浆同型半胱氨酸(homocysteine,Hcy)升高是AS独立危险因素[2]。Hcy可促进血管壁炎性单核细胞分化和巨噬细胞成熟,诱导血管炎症反应,加速AS病理进程[3],然而Hcy诱导的血管炎症反应具体机制仍不清楚。近期发现[4],血管内皮细胞中Nod样受体蛋白3(NOD-leucine rich repeat and pyrin containing protein 3,NLRP3)炎性体激活在AS的病理过程中起重要作用。NLRP3炎性体能够被包括Hcy在内的多种内外源性物质激活。体外实验发现,Hcy可通过升高细胞内ROS,激活NLRP3炎性体,诱导人血管内皮细胞程序性细胞死亡[5]。NLRP3炎性体激活可促进白细胞介素-1β(interleukin-1 beta,IL-1β)的分泌。IL-1β可介导血管内皮细胞炎症反应,促进血管平滑肌细胞增殖等病理过程参与AS发生和发展[6]。因此,抑制血管内皮细胞NLRP3炎性体激活对防治AS具有重要意义。
石斛酚(gigantol),一种联苄类酚性物质,是石斛的药用有效成分之一。既往研究表明[7],石斛酚能通过核因子-κB(nuclear factor-kappaB,NF-κB)信号途径抑制细菌内毒素脂多糖(lipopolysaccharide,LPS)诱导的小鼠巨噬细胞IL-1β的分泌。石斛酚可减少高葡萄糖诱导的小鼠肾小球系膜细胞活性氧物质(reactive oxygen species,ROS)水平,起到肾脏保护作用[8]。我们前期利用载脂蛋白E基因敲除(apolipoprotein E knockout,ApoE-/-)小鼠AS模型发现,石斛酚可明显抑制模型鼠主动脉黏附分子和趋化因子表达,减少主动脉斑块面积[9]。上述发现提示,石斛酚具有潜在的抑制血管内皮细胞炎症反应作用,然而其具体抗炎机制目前仍不清楚。因此,本实验采用Hcy诱导的人微血管内皮细胞炎症模型,从NLRP3炎性体通路分析石斛酚抗血管内皮细胞炎症反应作用及机制。
1 材料与方法
1.1 细胞和主要试剂人微血管内皮细胞(human microvascular endothelial cells,HMEC-1)购自ATCC;Hcy(#H4628)购自美国Sigma公司;石斛酚(纯度≥95%,#CHB-S-051)购自成都克洛玛生物科技有限公司,实验时采用二甲基亚砜助溶,终浓度不超过0.1%;胎牛血清(FBS,#04-001-1ACS)和DMEM培养基(高糖型,#06-1055-57-1ACS)购自以色列BI公司;细胞活性检测试剂盒(#C0009)、细胞蛋白裂解液(#P0013)、蛋白定量试剂盒(#P0010)、ROS检测试剂盒(#S0033M)购自上海碧云天公司;半胱氨酸天冬氨酸蛋白酶-1(cysteinyl aspartate-specific protease-1,Caspase-1)抗体(#3866)购自美国CST公司;NLRP3抗体(#ab214185)、凋亡相关点状样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC)抗体(#ab155970)和硫氧还蛋白互作蛋白(thioredoxin-interacting protein,TXNIP)抗体(#ab188865)购自英国Abcam公司;GAPDH抗体(#10494-1-AP)购自美国Proteintech公司;ELISA检测试剂盒(#DLB50)购自美国R&D公司;其余试剂均为化学分析纯。
1.2 细胞培养37 ℃水浴复苏液氮保存的HMEC-1细胞,加入正常细胞培养液(含10%FBS的DMEM培养基),混匀后离心(500×g,5 min),细胞以1×108·L-1密度接种于细胞培养皿(100 mm),在37 ℃、5%CO2培养箱内培养,后续实验采用对数生长期细胞。
1.3 细胞活性检测HMEC-1细胞以1×107· L-1密度接种96孔板,分别用Hcy(100 μmol·L-1)或石斛酚(1、5、10 μmol·L-1)处理HMEC-1细胞48 h,对照组加正常培养液,检测步骤严格按照细胞活性检测试剂盒(MTT法)说明书进行,酶标仪测定(美国MD公司,M2)各孔OD(570 nm)值。上述96孔板中,各处理条件另保留不加MTT孔,用于倒置显微镜(日本Olympus公司,#IX71)观察细胞形态学变化。
1.4 ELISA法测定HMEC-1细胞上清液中IL-1β含量HMEC-1细胞以2×109·L-1浓度接种6孔板,分别用Hcy(100 μmol·L-1)、Hcy(100 μmol·L-1)+石斛酚(1、5、10 μmol·L-1)处理HMEC-1细胞48 h,对照组加正常培养液,IL-1β含量严格按照ELISA试剂盒说明书步骤检测。
1.5 Western blot 检测HMEC-1细胞NLRP3、ASC、Caspase-1和TXNIP蛋白水平HMEC-1细胞以2×109·L-1浓度接种6孔板,分组同“1.4”,分别收集各组处理细胞12 h(检测TXNIP蛋白)和24 h(检测NLRP3、ASC和Caspase-1蛋白)蛋白样品。每孔加入细胞蛋白裂解液150 μL,裂解后4 ℃离心(13 000×g,5 min),上清液中总蛋白浓度经试剂盒定量(BCA法)。总蛋白经SDS-聚丙烯酰胺凝胶电泳分离后转膜(PVDF),非特异性抗原封闭1 h后,分别孵育不同一抗:NLRP3抗体(1 ∶500)、ASC抗体(1 ∶2 000)、Caspase-1抗体(1 ∶1 000)、TXNIP抗体(1 ∶2 000)和GAPDH抗体(1 ∶10 000),4 ℃过夜,去除一抗后,HRP标记的二抗(1 ∶5 000)反应2 h。ECL化学发光试剂显色,用ImageJ(1.8.0)软件分析化学发光仪(上海天能科技有限公司,#5200)拍摄的条带灰度值。
1.6 流式细胞仪检测HMEC-1细胞ROS水平[10]细胞以2×109·L-1密度接种6孔板,分组同1.4,各组处理30 min后胰蛋白酶消化收集细胞,ROS荧光探针DCFH-DA(10 μmol·L-1)37 ℃避光孵育20 min后,用PBS漂洗细胞3次,流式细胞仪(美国BD公司,#C6)在FL-1通道检测细胞ROS水平。
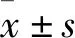
2 结果
2.1 Hcy、石斛酚对HMEC-1细胞形态学和活性的影响与对照组相比,Hcy(100 μmol·L-1)、石斛酚(1~10 μmol·L-1)作用HMEC-1细胞48 h,细胞形态学未观察到明显变化(Fig 1A)。细胞活性实验发现,与对照组相比,Hcy(100 μmol·L-1)、石斛酚各剂量组OD值差异均无统计学意义(Fig 1B),表明本实验体系中Hcy和石斛酚所采用浓度对HMEC-1细胞形态学和活性无明显影响。
Fig 1 Effect of Hcy or gigantol on cell viability of cultured HMEC-1 cells n=6)A:Cell morphology (×400);B:MTT assay.1:Control;2:Hcy(100 μmol·L-1);3:Gigantol(1 μmol·L-1);4:Gigantol(5 μmol·L-1);5:Gigantol(10 μmol·L-1)
2.2 石斛酚对Hcy诱导的HMEC-1细胞IL-1β分泌的影响与对照组相比,Hcy(100 μmol·L-1)作用HMEC-1细胞48 h后,细胞培养液中IL-1β水平明显增加(Fig 2)。与Hcy组相比,石斛酚(5~10 μmol·L-1)可明显减少培养液中IL-1β浓度(Fig 2),表明石斛酚对Hcy诱导的HMEC-1细胞IL-1β分泌具有明显的抑制作用。
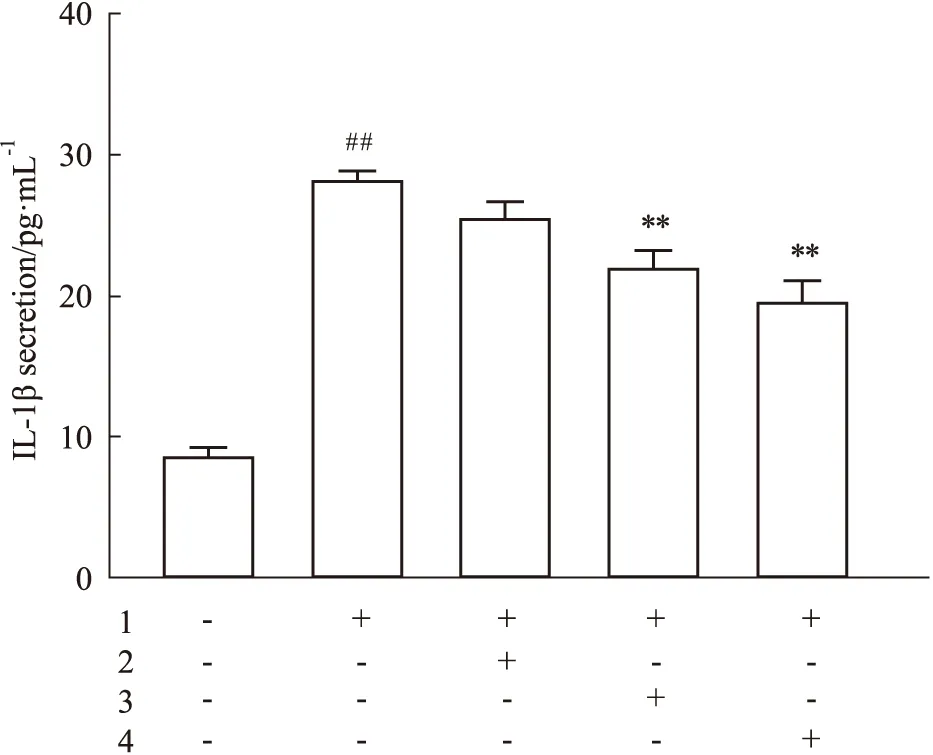
Fig 2 Gigantol inhibits Hcy induced IL-1β secretion in 1:Hcy(100 μmol·L-1);2:Gigantol(1 μmol·L-1);3:Gigantol(5 μmol·L-1);4:Gigantol(10 μmol·L-1).##P<0.01 vs control group,**P<0.01 vs Hcy group
2.3 石斛酚对Hcy诱导的HMEC-1细胞NLRP3炎性体的影响Hcy(100 μmol·L-1)作用HMEC-1细胞24 h后,NLRP3、ASC和Caspase-1蛋白表达明显升高(Fig 3)。与Hcy组相比,石斛酚(5~10 μmol·L-1)可明显抑制Hcy诱导的NLRP3炎性体激活(Fig 3),表明石斛酚干预Hcy诱导的HMEC-1细胞炎症反应可能通过抑制NLRP3炎性体激活。
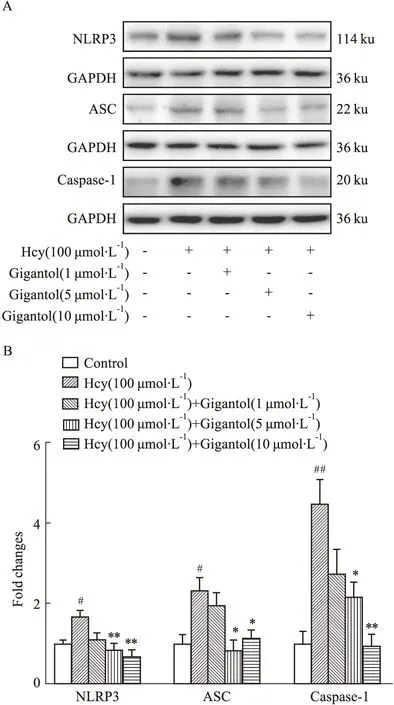
Fig 3 Gigantol inhibits Hcy induced NLRP3 inflammasome activation in HMEC-1 cells n=3)#P<0.05,##P<0.01 vs control group,*P<0.05,**P<0.01 vs Hcy group
2.4 石斛酚对Hcy诱导的HMEC-1细胞TXNIP蛋白表达的影响Hcy(100 μmol·L-1)作用HMEC-1细胞12 h后,TXNIP蛋白表达明显升高(Fig 4)。与Hcy组相比,石斛酚各剂量组可明显减少TXNIP蛋白表达(Fig 4),表明石斛酚可能通过调节TXNIP蛋白表达,抑制Hcy诱导的HMEC-1细胞NLRP3炎性体激活。
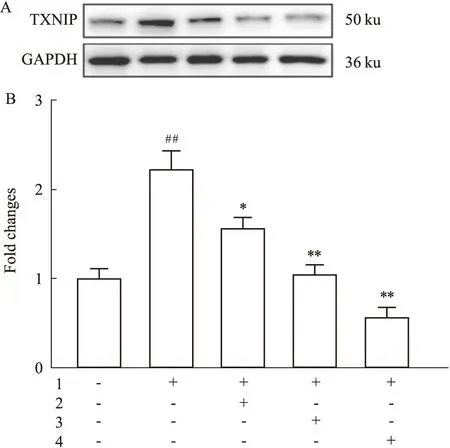
Fig 4 Hcy induced TXNIP expression in HMEC-1 cells inhibited by gigantol n=3)1:Hcy(100 μmol·L-1);2:Gigantol(1 μmol·L-1);3:Gigantol(5 μmol·L-1);4:Gigantol(10 μmol·L-1).##P<0.01 vs control group,*P<0.05,**P<0.01 vs Hcy group
2.5 石斛酚对Hcy诱导的HMEC-1细胞ROS水平的影响Hcy(100 μmol·L-1)作用HMEC-1细胞30 min后,细胞ROS水平明显增加(Fig 5)。与Hcy组相比,石斛酚(5~10 μmol·L-1)可明显减少细胞ROS含量(Fig 5),提示石斛酚可能通过ROS/TXNIP通路抑制Hcy诱导的内皮细胞NLRP3炎性体激活。
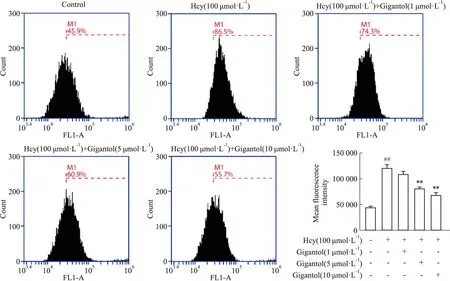
Fig 5 Hcy induced ROS generation in HMEC-1 cells inhibited by gigantol ##P<0.01 vs control group,**P<0.01 vs Hcy group
3 讨论
血管内皮细胞炎症反应是AS发生的始动环节[11]。Hcy可诱导血管内皮细胞炎症反应[12],参与AS病理进程。本实验发现,Hcy可升高HMEC-1细胞ROS水平,上调NLRP3、ASC、Caspase-1及TXNIP蛋白水平,促进IL-1β分泌。石斛酚能明显逆转Hcy诱导的氧化应激,抑制NLRP3炎性体激活,减轻内皮细胞炎症反应。因此,上述发现提示,石斛酚对高同型半胱氨酸血症相关的血管炎症和AS可能具有潜在治疗作用。
血管内皮细胞被认为是一种非典型免疫细胞,其能表达Toll样受体和CD36清道夫受体等模式识别受体,参与NF-κB信号的激活。近期研究发现,Hcy可通过升高细胞内ROS,激活NLRP3炎性体,诱导人血管内皮细胞焦亡和调亡[5]。与前期报道一致[5],本研究发现Hcy能上调HMEC-1细胞NLRP3、ASC和Caspase-1蛋白水平,增强IL-1β分泌,提示HMEC-1细胞NLRP3炎性体激活模型成功建立。然而,本研究未观察到Hcy刺激的HMEC-1细胞出现明显的活性和形态学变化,这可能与我们使用的Hcy浓度较低有关。此外,我们也发现Hcy能明显提升HMEC-1细胞内ROS水平。ROS已被证明可作为上游信号分子参与激活NLRP3炎性体。硫氧还蛋白/TXNIP是一种对氧化还原敏感的信号复合物,已成为氧化还原调节与血管衰老相关疾病发病机制之间联系的关键组分[13]。ROS可诱导TXNIP与NLRP3结合,从而引起NLRP3炎性体激活和肺内皮细胞分泌IL-1β[14]。我们之前在高葡萄糖诱导的肝细胞和果糖诱导的足细胞等体外细胞损伤模型中发现,ROS/TXNIP通路参与了NLRP3炎性体激活[15-16]。本实验发现Hcy作用HMEC-1细胞12 h后能明显提升细胞中TXNIP蛋白表达水平。因此,我们推测ROS/TXNIP通路可能参与了Hcy激活的HMEC-1细胞NLRP3炎性体。
石斛酚抗炎特性逐渐受到关注。体外实验发现,石斛酚可通过NF-κB途径抑制LPS诱导的小鼠巨噬细胞炎性因子IL-1β的释放[7],通过ROS/MAPK/NF-κB通路减少高葡萄糖诱导的小鼠肾小球系膜细胞调亡[8]。在高葡萄糖诱导的人视网膜微血管内皮细胞损伤模型中发现,石斛酚可抑制醛糖还原酶(aldose reductase,AR)/NF-κB信号激活,减少细胞内ROS水平[17]。我们前期研究发现,石斛酚可抑制主动脉粘附分子(ICAM-1和VCAM-1)和趋化因子(MCP-1)mRNA水平,明显减小ApoE-/-小鼠主动脉粥样斑块[9]。本实验发现,石斛酚能逆转Hcy诱导的NLRP3、ASC和Caspase-1蛋白过表达,抑制IL-1β分泌,提示石斛酚对Hcy诱导的HMEC-1细胞NLRP3炎性体激活具有明显的抑制作用。此外,Hcy诱导的细胞ROS升高和TXNIP蛋白过表达均可被石斛酚明显逆转,提示ROS/TXNIP信号通路可能参与石斛酚对Hcy诱导的NLRP3炎性体激活的抑制作用。石斛酚对NLRP3炎性体具体调控机制还有待于后续采用ROS清除剂或TXNIP抑制剂等进一步验证。
综上所述,我们发现石斛酚能抑制Hcy诱导的HMEC-1细胞NLRP3炎性体激活,缓解血管内皮细胞炎症反应,ROS/TXNIP通路可能参与其中。本实验初步揭示了石斛酚抑制血管内皮细胞炎症反应的分子作用机制,为石斛酚防治高同型半胱氨酸血症相关的血管性疾病研究提供了新的实验依据。