miR-96-5p靶向FOXO4对高糖诱导的大鼠视网膜血管内皮细胞增殖和凋亡的影响
李 欢,路 璐
0引言
糖尿病视网膜病变是糖尿病并发症中最严重的一种微血管病变,严重时可导致失明并降低患者生活质量,其发病机制尚未完全阐明,既往研究显示血糖持续性升高是诱导患者视网膜病变的主要原因之一[1]。因此深入探究糖尿病视网膜病变发病机制可为临床预防糖尿病患者发生视网膜病变提供理论指导。研究表明,微小RNA-96-5p(microRNA-96-5p,miR-96-5p)在2型糖尿病患者外周血中表达下调[2]。miR-96在链脲佐菌素(STZ)诱导的糖尿病小鼠心肌组织中表达下调并可能参与心肌细胞增殖及凋亡过程[3]。相关研究表明过表达miR-96可抑制宫颈癌细胞的增殖,促进细胞凋亡[4]。但miR-96-5p在糖尿病视网膜病变过程中的表达变化及其可能作用机制尚未见报道。靶基因预测软件得到叉头框转录因子O4(forkhead box O4,FOXO4)可能是miR-96-5p的靶基因,研究表明FOXO4在糖尿病视网膜中高表达,α-黑色素细胞刺激激素在抗视网膜内皮细胞氧化应激过程中表达下调[5-6]。高糖处理后的视网膜血管内皮细胞中FOXO4表达上调[7]。但miR-96-5p在高糖诱导的大鼠视网膜血管内皮细胞中的表达及其对大鼠视网膜血管内皮细胞增殖和凋亡的影响,且miR-96-5p是否通过调控FOXO4的表达影响大鼠视网膜血管内皮细胞的增殖和凋亡目前还尚未可知。因此,本研究通过体外培养SD大鼠视网膜血管内皮细胞(RRVEC)并构建高糖模型,观察高糖诱导的RRVEC中miR-96-5p与FOXO4表达变化及其对RRVEC增殖、凋亡的影响,为早期防治糖尿病视网膜病变研究提供理论基础,以期为临床治疗提供科学依据。
1材料和方法
1.1材料
1.1.1实验动物SD雄性大鼠10只,体质量200~220g,购自济南朋悦实验动物繁育有限公司,合格证号:SCXK(济)2012-0003。本研究经伦理委员会审批通过。
1.1.2主要试剂胰蛋白酶、Lipofectamine 2000均购自美国Invitrogen公司;MTT试剂盒、荧光定量PCR试剂盒、RNA提取及反转录试剂盒购自美国Sigma公司;细胞培养基、IgG二抗均购自武汉博士德生物有限公司;GAPDH抗体购自杭州贤至生物有限公司;兔抗鼠B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关x蛋白(Bax)、cleaved-caspased-3抗体均购自武汉三鹰生物技术有限公司;兔抗鼠FOXO4、CyclinD1、p21、p27抗体购自美国Santa Cruz公司;BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所;细胞凋亡检测试剂盒购自江苏凯基生物技术股份有限公司;miR-96-5p模拟物(mimic)、无义miRNA(miR-NC)、FOXO4 siRNA(si-FOXO4)、FOXO4阴性对照序列(si-NC)均购自广州锐博生物科技有限公司;pcDNA 3.1购自上海索宝生物科技有限公司;双荧光素酶活性检测试剂盒购自江苏依莱萨生物技术有限公司。
1.1.3主要仪器设备ABI 7500型荧光定量PCR仪购自美国ABI公司;Multiskan Sky 酶标仪购自美国赛默飞公司;CytoFLEX流式细胞仪购自美国贝克曼公司。
1.2方法
1.2.1 SD大鼠视网膜血管内皮细胞培养与鉴定参照文献进行RRVEC分离培养[8]。麻醉大鼠后用脱颈法处死大鼠,消毒后摘除大鼠眼球,用乙醇浸泡30s后使用预冷的PBS缓冲液冲洗3次,剪切视网膜组织并剪碎,放入培养液内,Ⅰ型胶原酶消化视网膜组织,30min后收集消化液,用100μm的网孔过滤消化液,经1500r/min转速离心5min(离心半径13cm),弃上清,向沉淀物中加入DMEM培养基(肝素钠、胎牛血清),细胞接种至24孔板,置于37℃恒温培养箱内培养,每隔2d更换1次培养液,RRVEC稳定传代4代后接种于盖玻片上(密度为1×104个/mL),继续培养24h,细胞贴壁生长后取出盖玻片,采用免疫荧光染色法鉴定细胞,并置于荧光显微镜下观察,分离的细胞均呈铺路石样单层贴壁生长,Cy3(红色荧光)阳性表达。
1.2.2细胞转染与分组收集生长状态良好的RRVEC,将其分为对照组(NG):葡萄糖浓度5.5mmol/L处理;高糖组(HG):葡萄糖浓度30mmol/L处理[9]。分别采用miR-96-5p mimic、miR-NC、si-FOXO4、si-NC转染高糖诱导的RRVEC,分为HG+miR-96-5p组、HG+miR-NC组、HG+si-FOXO4组、HG+si-NC组。通过转染miR-96-5p mimic后再转染pcDNA-FOXO4验证miR-96-5p过表达是否通过抑制FOXO4表达进而促进高糖诱导的RRVEC增殖并抑制细胞凋亡,将细胞分为HG+miR-96-5p+pcDNA组、HG+miR-96-5p+pcDNA-FOXO4组。细胞转染后放入37℃、5%CO2恒温培养箱内培养,6h后更换为含有10%胎牛血清的新鲜培养基,继续培养48h后收集对数生长期细胞进行后续研究。
1.2.3 qRT-PCR检测细胞中miR-96-5p和FOXO4 mRNA表达水平采用实时荧光定量聚合酶链反应(qRT-PCR)法检测miR-96-5p、FOXO4 mRNA表达,分别设计miR-96-5p、FOXO4基因引物并由上海生物工程股份有限公司设计合成(表1)。用Trizol、酚/氯仿提取总RNA进行qRT-PCR反应,配置反应体系20μL:SYBR Premix Ex Taq Ⅱ(2×)10μL,cDNA 2μL,上下游引物各0.8μL,ROX Reference Dye(50×)0.4μL,ddH2O 6μL。反应条件:95℃ 5min循环1次,95℃变性30s,60℃退火30s,72℃延伸30s,共40个循环。收集各样本Ct值并采用2-ΔΔCt法计算miR-96-5p、FOXO4 mRNA相对表达量。
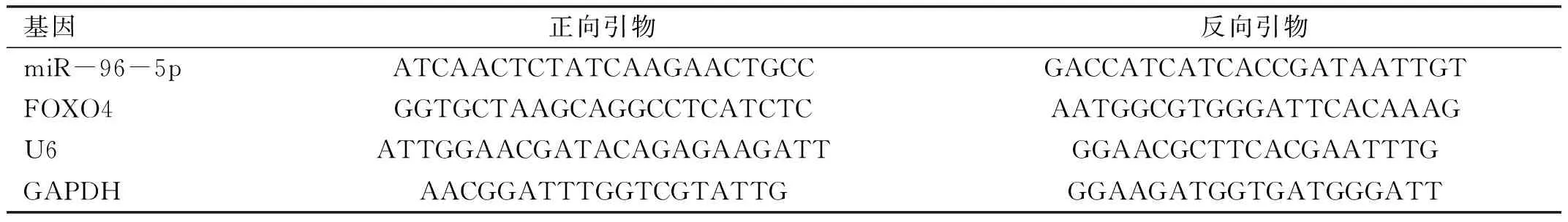
表1 引物序列
1.2.4 Western blotting检测相关蛋白表达采用蛋白免疫印迹(Western blotting)检测FOXO4、CyclinD1、p21、p27、Bcl-2、Bax、cleaved-caspased-3蛋白表达。取对数生长期RRVEC进行实验处理后,预冷PBS洗涤2次,弃上清液,加入蛋白裂解液,孵育20min(冰上进行),取细胞裂解液经转速13000r/min离心20min,取上清并根据BCA蛋白浓度测定试剂盒检测蛋白浓度,20μg蛋白样品加入上样缓冲液,经10% SDS-PAGE电泳反应后用PVDF膜转载分离蛋白,5%脱脂奶粉封闭1h,4℃条件下加入各蛋白一抗孵育过夜,次日用TBST清洗3次×10min,室温条件下加入二抗孵育40min,TBST清洗3次×10min,滴加ECL发光液,置于成像系统观察并用Image-Pro Plus软件分析蛋白条带灰度值,各蛋白相对表达量为目的蛋白条带灰度值与GAPDH条带灰度值的比值。
胡人进村了,大肆搜索,很快发现井下藏着人,胡人把吊桶拉了上来。农夫听到胡人痛叫一声,想是他去捉妇人,反被咬了一口,跟着妇人惨叫一声,就再无声息了。
1.2.5 MTT检测细胞增殖收集细胞RRVEC,预冷PBS洗涤,用0.1%胰蛋白酶消化后加入培养液重悬细胞,调整细胞密度为5×104个/mL,根据实验分组将细胞接种于96孔板(1%明胶包被),置于37℃恒温培养箱培养48h,根据分组条件处理结束前4h分别在每孔中加入20μL MTT试剂(5g/L),放入37℃恒温培养箱继续培养4h弃培养液,加入DMSO(150μL/孔),室温振荡10min后选取570nm波长的酶标仪检测各孔吸光度值(OD570nm),实验均设置3次重复。
1.2.6流式细胞术检测细胞凋亡采用流式细胞术Annexin V-FITC/PI检测细胞凋亡情况。取对数生长期RRVEC进行实验处理后,收集各组细胞,0.25%胰蛋白酶消化,用PBS清洗后经1000r/min离心10min收集细胞,分别加入500μL Binding Buffer,加入5μL Annexin V-FITC充分混匀10min后加入5μL PI孵育5min,利用流式细胞仪检测各组细胞荧光强度并计算细胞凋亡率。实验设置3次重复。
1.2.7双荧光素酶报告实验通过靶基因预测软件确定miR-96-5p与FOXO4具有连续性结合靶点,分别设计含有miR-96-5p结合位点的FOXO4 3’UTR野生型荧光素酶报告基因载体(WT-FOXO4),并设计FOXO4 3’UTR突变后的突变型荧光素酶报告基因载体(MUT-FOXO4),将WT-FOXO4、MUT-FOXO4分别与miR-96-5p mimic或miR-NC共转染RRVEC,置于37℃恒温培养箱继续培养48h后收集细胞并使用荧光素酶活性检测试剂盒检测RRVEC的相对荧光素酶活性。
统计学分析:采用SPSS 21.0统计软件分析实验数据。Shapiro-Wilk检验数据均符合正态分布,经Levene检验方差齐性,两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,若差异具有统计学意义,进一步两两比较采用LSD-t检验。P<0.05为差异具有统计学意义。
2结果
2.1高糖处理对RRVEC中miR-96-5p和FOXO4表达的影响qRT-PCR与Western blotting分别检测高糖处理后RRVEC中miR-96-5p和FOXO4表达变化,结果显示,相较于NG组,HG组细胞中miR-96-5p表达水平显著降低(t=17.191,P<0.05),而FOXO4 mRNA(t=20.443,P<0.05)和蛋白(t=11.714,P<0.05)表达水平均显著升高,见图1。
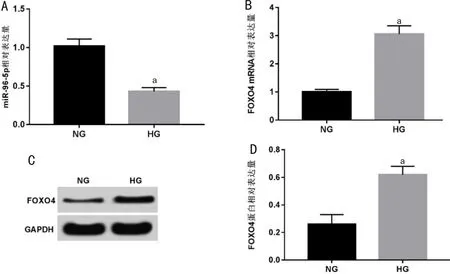
图1 高糖处理对RRVEC中miR-96-5p和FOXO4表达的影响
2.2 miR-96-5p过表达对高糖诱导的RRVEC增殖的影响采用miR-96-5p mimic转染高糖诱导的RRVEC,qRT-PCR检测结果显示(图2A),HG+miR-96-5p组细胞miR-96-5p表达水平较HG+miR-NC组明显升高(t=15.363,P<0.05),表明成功提高高糖诱导的RRVEC中miR-96-5p表达水平。MTT检测高糖诱导的RRVEC转染miR-96-5p mimic 48h后细胞增殖能力变化,结果显示(图2B),HG组细胞增殖活性显著低于NG组(t=15.757,P<0.05);HG+miR-96-5p组细胞增殖活性显著高于HG+miR-NC组(t=13.377,P<0.05),表明上调miR-96-5p表达可明显促进高糖诱导的细胞增殖。Western blotting进一步检测细胞增殖相关蛋白表达,结果显示(图2C、2D),与NG组相比,HG组细胞中CyclinD1蛋白表达显著降低(t=18.783,P<0.05),而p21、p27蛋白表达水平显著升高(t=16.100、15.757,均P<0.05);与HG+miR-NC组相比,HG+miR-96-5p组细胞中CyclinD1蛋白表达水平显著升高(t=19.498,P<0.05),而p21、p27蛋白表达水平显著降低(t=13.587、9.603,均P<0.05),表明miR-96-5p过表达可能通过抑制p21、p27蛋白表达促进CyclinD1蛋白表达,进而促进细胞增殖。
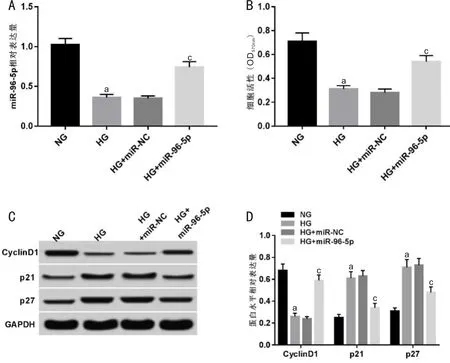
图2 miR-96-5p过表达对高糖诱导的RRVEC增殖的影响
2.3 miR-96-5p过表达对高糖诱导的RRVEC凋亡的影响流式细胞术检测miR-96-5p过表达对高糖诱导的RRVEC凋亡的影响,结果显示(图3A、3C),高糖处理后细胞凋亡率显著高于NG组(t=31.778,P<0.05),而转染miR-96-5p mimic(HG+miR-96-5p组)后细胞凋亡率较HG+miR-NC组明显降低(t=15.078,P<0.05),表明高糖诱导可促进RRVEC凋亡,上调miR-96-5p表达可抑制高糖诱导的RRVEC凋亡。Western blotting检测细胞凋亡相关蛋白表达,结果显示(图3B、3D),HG组细胞Bcl-2蛋白表达水平显著低于NG组(t=10.791,P<0.05),而Bax、cleaved-caspased-3蛋白表达水平均显著高于NG组(t=15.363、17.441,均P<0.05);HG+miR-96-5p组细胞Bcl-2蛋白表达水平显著高于HG+miR-NC组(t=10.804,P<0.05),而Bax、cleaved-caspased-3蛋白表达水平均显著降低(t=8.586、12.182,P<0.05),表明miR-96-5p过表达可能通过上调Bcl-2蛋白表达而下调Bax、cleaved-caspased-3蛋白表达,进而抑制高糖诱导的细胞凋亡。
图3 miR-96-5p过表达对高糖诱导的RRVEC凋亡的影响
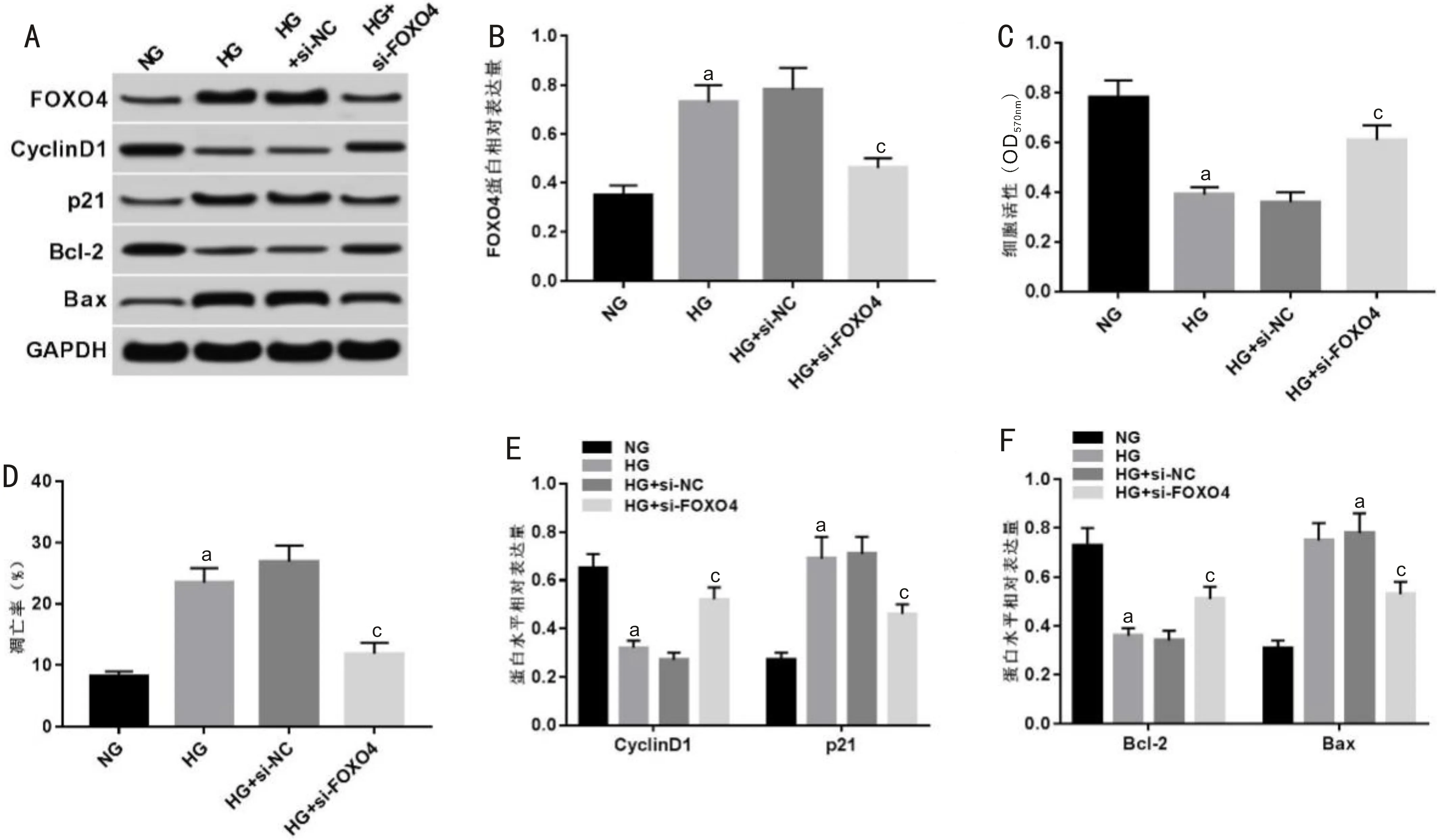
图4 抑制FOXO4表达对高糖诱导的RRVEC增殖和凋亡的影响
2.5 miR-96-5p靶向调控FOXO4的表达双荧光素酶报告实验显示(图5A、5B),RRVEC中miR-96-5p mimic能够显著抑制WT-FOXO4报告载体的荧光素酶活性(t=17.192,P<0.05),miR-96-5p与FOXO4结合位点突变后,miR-96-5p mimic对MUT-FOXO4报告基因载体的荧光素酶活性无明显影响(P>0.05),表明miR-96-5p能够直接靶向RRVEC中FOXO4的3’UTR进而抑制其表达。进一步采用Western blotting法检测miR-96-5p过表达或抑制miR-96-5p表达后FOXO4蛋白表达变化,结果显示(图5C、5D),与miR-NC组相比,转染miR-96-5p mimic的RRVEC中FOXO4蛋白表达水平受到明显抑制(t=13.800,P<0.05),而转染anti-miR-96-5p的RRVEC中FOXO4蛋白表达水平较anti-miR-NC组明显升高(t=18.120,P<0.05),表明miR-96-5p可直接靶向调节FOXO4表达水平。
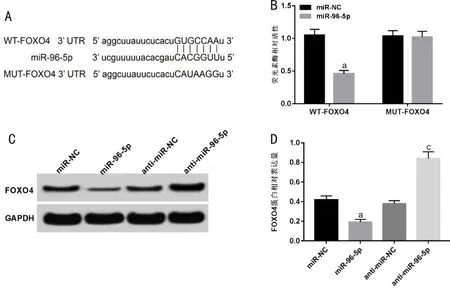
图5 miR-96-5p靶向调控FOXO4的表达
2.6 FOXO4过表达逆转miR-96-5p过表达对高糖诱导的RRVEC增殖和凋亡的作用转染miR-96-5p mimic后再转染pcDNA-FOXO4以此验证miR-96-5p过表达是否通过抑制FOXO4表达进而促进高糖诱导的RRVEC增殖并抑制细胞凋亡。Western blotting检测结果显示(图6A、6B),转染miR-96-5p mimic后再采用pcDNA-FOXO4转染高糖诱导的RRVEC(HG+miR-96-5p+pcDNA-FOXO4组),细胞中FOXO4表达水平显著高于HG+miR-96-5p+pcDNA组(t=15.949,P<0.05),表明细胞转染成功。进一步检测RRVEC增殖及凋亡变化情况,结果显示,与HG+miR-96-5p+pcDNA组比较,HG+miR-96-5p+pcDNA-FOXO4组细胞增殖活性明显降低(t=9.675,P<0.05,图6C),细胞凋亡率明显增加(t=8.937,P<0.05,图6D),p21、Bax蛋白表达升高(t=11.833、8.737,均P<0.05,图6E、6F),CyclinD1、Bcl-2蛋白表达降低(t=9.985、7.904,均P<0.05,图6E、6F),表明FOXO4过表达可逆转miR-96-5p过表达对高糖诱导的细胞增殖和凋亡的作用。
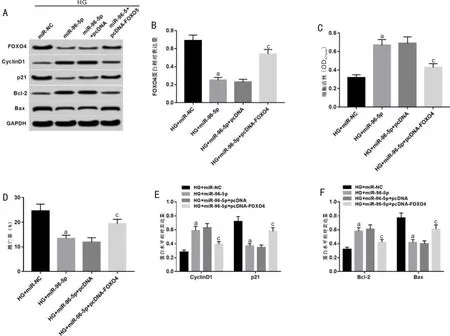
图6 FOXO4过表达逆转miR-96-5p过表达对高糖诱导的RRVEC增殖和凋亡的作用
3讨论
糖尿病视网膜病变发生后血管内皮细胞会暴露在血浆中并极易受到高血糖刺激而发生损伤,随后破坏视网膜屏障,高糖持续刺激情况下可抑制视网膜血管内皮细胞增殖,还可能通过促进细胞凋亡进而促使内皮细胞损伤[10-11]。研究表明,miRNA表达异常可通过调节相关信号通路进而影响糖尿病视网膜病变大鼠视网膜血管内皮细胞增殖与凋亡[12]。目前关于miRNA与糖尿病视网膜病变发生机制的研究相对较少,因此积极寻找新型miRNA与糖尿病视网膜病变发生及发展的关系对临床预防及治疗均具有重要意义。
研究发现,miR-96-5p表达异常可能参与人类滋养层细胞的自噬和迁移损伤过程[13]。长非编码RNA CASC2通过调节miR-96-5p/SYVN1途径进而抑制乳腺癌细胞生长和转移[14]。miR-96-5p通过靶向caspase-9基因进而调控肝癌细胞凋亡[15]。本研究结果显示,高糖处理后RRVEC中miR-96-5p表达水平显著降低,高糖诱导的RRVEC转染miR-96-5p mimic而上调其表达水平,结果发现高糖诱导后细胞增殖能力明显降低,而转染miR-96-5p mimic后细胞增殖能力明显增强,进一步研究显示,转染miR-96-5p mimic后高糖诱导的RRVEC中CyclinD1蛋白表达水平显著增高,而p21、p27蛋白表达水平显著降低。另有研究表明,CyclinD1可正向调控细胞周期,p21、p27可负向调控细胞周期,p21、p27表达水平升高可抑制CyclinD1对细胞周期的调控作用[16-17]。说明上调miR-96-5p表达可通过上调CyclinD1的表达及下调p21、p27的表达进而促进RRVEC增殖。同时本研究结果发现,高糖诱导后RRVEC凋亡率明显增加,miR-96-5p过表达可降低细胞凋亡率,通过检测细胞凋亡蛋白表达,结果发现,miR-96-5p过表达Bcl-2蛋白表达水平明显升高,而Bax蛋白表达水平明显降低。相关研究结果表明,通过抑制高糖诱导的血管内皮细胞中Bax、cleaved-caspased-3的表达,增强Bcl-2的表达能够抑制血管内皮细胞凋亡,最终达到治疗糖尿病血管病变的目的[18]。说明上调高糖诱导的RRVEC中miR-96-5p表达可通过促进Bcl-2表达及抑制Bax、cleaved-caspased-3表达,进而抑制细胞凋亡。提示miR-96-5p过表达可通过影响细胞增殖及凋亡蛋白表达进而影响高糖诱导的细胞增殖及凋亡,由此推测miR-96-5p上调表达可能作为临床早期诊断及防治糖尿病视网膜病变的重要分子标志物。
FOXO4可能通过调控胰岛素等参与糖尿病并发症的发生及发展过程[19-20]。糖尿病条件下沉默FOXO4表达可保护内皮细胞,并可参与内皮组织损伤等过程,同时胰岛素及靶器官中营养物质等均可影响FOXO4表达[21]。相关研究表明,糖尿病视网膜病变组织中FOXO4表达水平明显升高并可能调控血管内皮细胞损伤发生过程[22]。本研究结果显示,高糖诱导后RRVEC中FOXO4表达水平明显升高,通过转染si-FOXO4后发现RRVEC增殖活性明显增强,细胞凋亡率明显下降,促进CyclinD1、Bcl-2的表达,抑制p21、Bax的表达,说明抑制FOXO4表达可通过上调CyclinD1、Bcl-2的表达及下调p21、Bax的表达进而促进高糖诱导的细胞增殖并抑制细胞凋亡。本研究通过双荧光素酶报告基因实验验证FOXO4是miR-96-5p的靶基因,miR-96-5p可负向调控FOXO4表达。为验证miR-96-5p是否通过抑制FOXO4表达进而对高糖诱导的RRVEC增殖及凋亡产生影响,结果发现高糖诱导的RRVEC共转染miR-96-5p mimic与pcDNA-FOXO4后细胞增殖活性明显降低,细胞凋亡率明显增加,CyclinD1、Bcl-2蛋白表达水平明显降低,而p21、Bax蛋白表达水平明显升高,说明miR-96-5p过表达可通过下调FOXO4表达进而促进高糖诱导的细胞增殖并抑制细胞凋亡。提示miR-96-5p过表达能够抑制高糖诱导的RRVEC凋亡并促进细胞增殖。
综上所述,miR-96-5p在高糖诱导的RRVEC中呈低表达,FOXO4表达水平升高,上调miR-96-5p表达可促进高糖诱导的细胞增殖以及抑制细胞凋亡的发生,其作用机制可能是通过抑制靶基因FOXO4表达,上调下游CyclinD1、Bcl-2表达,下调p21、p27、Bax、cleaved-caspased-3表达,提示上调miR-96-5p表达可通过抑制FOXO4表达进而影响细胞增殖及凋亡蛋白表达而保护视网膜血管内皮细胞,可为临床防治糖尿病视网膜病变提供理论依据。但关于miR-96-5p表达变化及其对下游相关信号通路的影响均需进行分子生物学研究证实。

