摘除泪腺和泪腺注射肉毒杆菌毒素A制备大鼠干眼模型的比较
董子奕,应 铭,杨 希,马 伊
0引言
2015年国际干眼病工作组[1]全面修订了对干眼病(dry eye disease, DED)的认识,认为DED是一种多因素导致的眼表疾病,特征是泪膜稳态的丧失并伴有眼表症状,水液不足型是常见的干眼亚型之一。炎症因子是常见的致病因素之一[2-3]。随着发病率的升高,干眼症越来越得到重视[4],建立稳定、高效的干眼症动物模型成为了深入探索干眼症发病机制和观察治疗效果的有力工具。在正常饲育环境下,建立水液不足型干眼症动物模型主要有两类手段:一类为手术干预,例如摘除泪腺、手术去势等方法;另一类为药物诱导,比如眼睑涂抹阿托品眼膏、泪腺注射肉毒杆菌毒素等[5]。本实验分别采用了摘除泪腺以及泪腺注射肉毒杆菌毒素A(botulinum toxin A,BTX-A)诱导大鼠干眼症模型,对比两种水液缺乏型干眼症模型的临床表现、病理学特点以及细胞因子变化,进而分析两种干眼症动物模型的优缺点和应用范围。
1材料和方法
1.1材料
1.1.1实验动物与分组本研究中涉及大鼠的所有程序均经天津市人民医院医学伦理委员会批准,并符合《视觉与眼科研究协会(ARVO)关于动物用于眼科和视力研究的声明》的指导方针。选取健康8周龄雄性Brown Norway(BN)大鼠30只(北京华阜康生物科技股份有限公司),体质量200~250g,清洁级饲养。随机分为3组,每组各10只,均选取左眼为实验眼,第一组左眼不予任何处理作为空白组(A组),第二组摘除左侧主泪腺(B组),第三组左侧泪腺注射肉毒杆菌毒素A(C组)。A、B、C组各10眼。
1.1.2主要药品和试剂注射用A型肉毒毒素:美国艾尔建制药有限公司;泪液检测酚红棉线,荧光素钠试纸:天津晶明新技术开发有限公司;动物组织总RNA提取试剂盒:北京赛百盛基因技术有限公司。引物设计:大连宝生物有限公司设计并合成引物。
1.2方法
1.2.1实验动物模型建立A组大鼠左眼不做任何处理。制作摘除主泪腺干眼症动物模型:将B组大鼠腹腔注射10%水合氯醛(4mL/kg),待动物麻醉后,于左耳下约1cm处做纵行切口,左眼外侧1cm处做横行切口,暴露皮下见眶外泪腺,分离周围组织,将其完整摘除,逐层缝合关闭伤口。制作泪腺注射肉毒杆菌毒素A干眼症动物模型:将C组大鼠腹腔注射10%水合氯醛(4mL/kg),待动物麻醉后在手术显微镜下暴露左侧泪腺,泪腺注射肉毒杆菌毒素A 0.1mL(20mU)。将大鼠置于温度为24℃±2℃,湿度为50%,早8∶00至晚8∶00照明,其余时间黑暗环境下饲养。
1.2.2干眼症动物模型检查项目分别于实验前1d及实验后3、7、14、28、42d,将大鼠进行基础麻醉后检测泪液分泌试验(SⅠt)、泪膜破裂时间(BUT)以及角膜荧光染色评分并在照相裂隙显微镜下拍照记录。泪液分泌试验:根据Fujihara等[6]的试验标准,将一张泪液分泌酚红棉线放入大鼠下睑外1/3处,1min后读取条纹湿润长度并精确到0.1mm。泪膜破裂时间:将10%荧光素钠溶液滴于大鼠结膜囊内,使荧光素均匀分布于大鼠眼表面,固定眼睑,通过裂隙灯钴蓝光观察,记录从最后1次闭眼开始至泪膜出现第1个破裂点时所需时间,取3次的观察时间取平均值。荧光素钠染色评分:将10%荧光素钠溶液滴入大鼠结膜囊内,裂隙灯显微镜钴蓝光下观察1min后角膜染色的情况并评分。参照Koh等[7]的方法,其评分标准如下:将角膜分为四个象限分别评分,分数相加为最终得分。0分:无着染;1分:点状着染≤30个;2分:点状着染>30个,但不弥散;3分:严重的点状着染但不融合成片;4分:着染成斑片状。所有检查均由同一名检查者在同一时间(AM9∶00~12∶00),同一地点、温度、湿度及照明情况下完成。
1.2.3病理学检查实验后第42d,随机从每组中各取出2只大鼠过量麻醉处死,立即摘除左侧眼球,A,C组摘除左侧泪腺组织,4%多聚甲醛固定标本24h,然后用流水冲洗2h,蒸馏水冲洗30min,浸泡于100%、95%、80%、70%乙醇中各5min脱水,二甲苯溶液中透明,60℃石蜡包埋,连续切片,厚度为7μm,45℃摊片,60℃烤片,常规脱蜡入水,苏木精染色试剂盒染色5min,然后用温水冲洗3min,取出苏木精。然后将其浸泡在含0.01% HCl的伊红中1min,最后用自来水冲洗10min。同样进行PAS染色,最后观察角膜、结膜、泪腺的病理变化。
1.2.4实时荧光定量PCR(RT-PCR)测定上皮生长因子(EGF)、白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)的表达量实验后第42d,处死余下大鼠,分别取左眼结膜及角膜组织,使用动物组织总RNA提取试剂盒提取细胞总RNA,紫外分光光度计检测其纯度和浓度,并进行逆转录获取cDNA。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参对照的校准基因(PCR扩增细胞的标志性基因)。引物序列:EGF上游引物为5’-TCGGTGCTGTGCGATTTA-3’,下游引物为 5’-TTTCTGGCAGTTCTCCTC-3’;IL-6上游引物为5’-CAGTTGCCTTCTTGGGACT-3’,下游引物为3’-GCTCTGAATGACTCTGGCTT-5’;TNF-α上游引物为5’-CACGTCGTAGCAAACCACCAA-3’,下游引物为3’-GTTGGTTGTCTTTGAGATCCAT-5’。采用SYBR green I作为荧光信号对以上指标进行聚合酶链式反应扩增,通过计算2-△△ct值取平均值绘制各指标表达量对比图。PCR反应条件:95℃预变性10min;94℃ 15s、60℃ 1min,40个循环;95℃ 15s、60℃ 1min、95℃ 15s至反应结束。

2结果
2.1泪液分泌试验实验后第3d,B组与C组均出现泪液分泌量持续性减少,B、C组在第14d分别减少至3.83±0.41mm以及3.61±0.71mm,A组为7.34±0.31mm,与A组比较差异均有统计学意义(P<0.05),其后B、C组泪液分泌量维持稳定。B、C组间比较差异均无统计学意义(P>0.05),见表1。

表1 A、B、C组泪液分泌试验酚红棉线长度测量比较
2.2泪膜破裂时间测定实验后第3d,各组泪膜破裂时间未见差异改变(P>0.05)。第7d,B组与C组开始出现泪膜破裂时间缩短,B、C组泪膜破裂时间在第28d分别缩短为6.03±0.43、6.20±0.40s,A组为10.87±0.59s,与A组比较差异均有统计学意义(P<0.05),其后B、C组泪膜破裂时间维持稳定。B、C组间比较差异没有统计学意义(P>0.05),见表2。
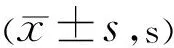
表2 A、B、C组泪膜破裂时间检测比较
2.3角膜染色评分A组角膜上皮光滑,经荧光素钠染色后角膜上皮偶见独立点状着染,未见弥散的点状着染(图1A)。实验后第7d,B、C组角膜上皮点染数量逐渐增多,提示角膜上皮粗糙,但未见明显片状融合,随后B、C组角膜点染明显增多,逐渐出现片状染色(图1B、C)。B、C组角膜评分在实验后第28d分别为5.8±1.5、5.5±1.4分,A组为0.8±0.6分,与A组比较差异均有统计学意义(P<0.05),其后B、C组角膜评分维持稳定。B、C组间比较差异均无统计学意义(表3)。
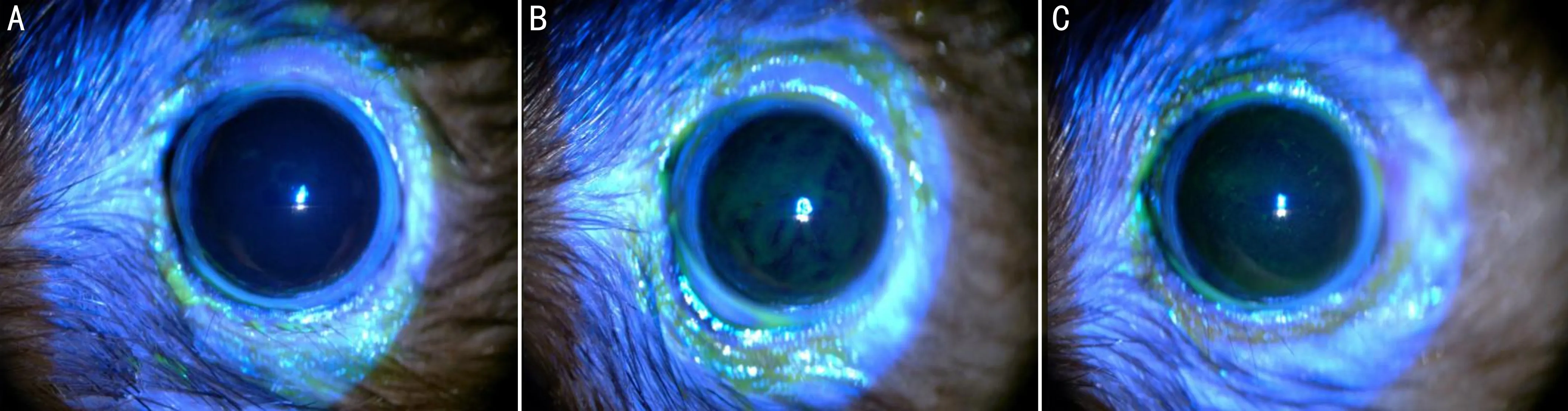
图1 第42d角膜上皮荧光素钠染色
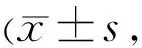
表3 A、B、C组角膜荧光素钠染色评分结果 分)
2.4病理学检查结果HE染色:A组角膜上皮细胞形态正常,排列整齐,上皮完整连续。基底层细胞排列紧密,分布整齐(图2A)。B、C组角膜上皮均存在不同程度表层细胞丝状分离,角膜上皮细胞排列不规则,上皮点状脱落,角膜基质细胞体积明显增大,排列无序,胞核固缩,呈多角状增生(图2B、C)。A组正常泪腺可见腺泡规则,排列紧密,腺上皮细胞核正常、深染,胞浆淡染(图3A);C组萎缩泪腺可见腺泡不清晰,排列疏松,腺上皮细胞变性,细胞核消失,胞浆红染(图3B)。PAS染色:B、C组结膜杯状细胞数目较A组明显减少,胞体萎缩,体积减少,结膜上皮呈鳞状化生(图2D~F)。
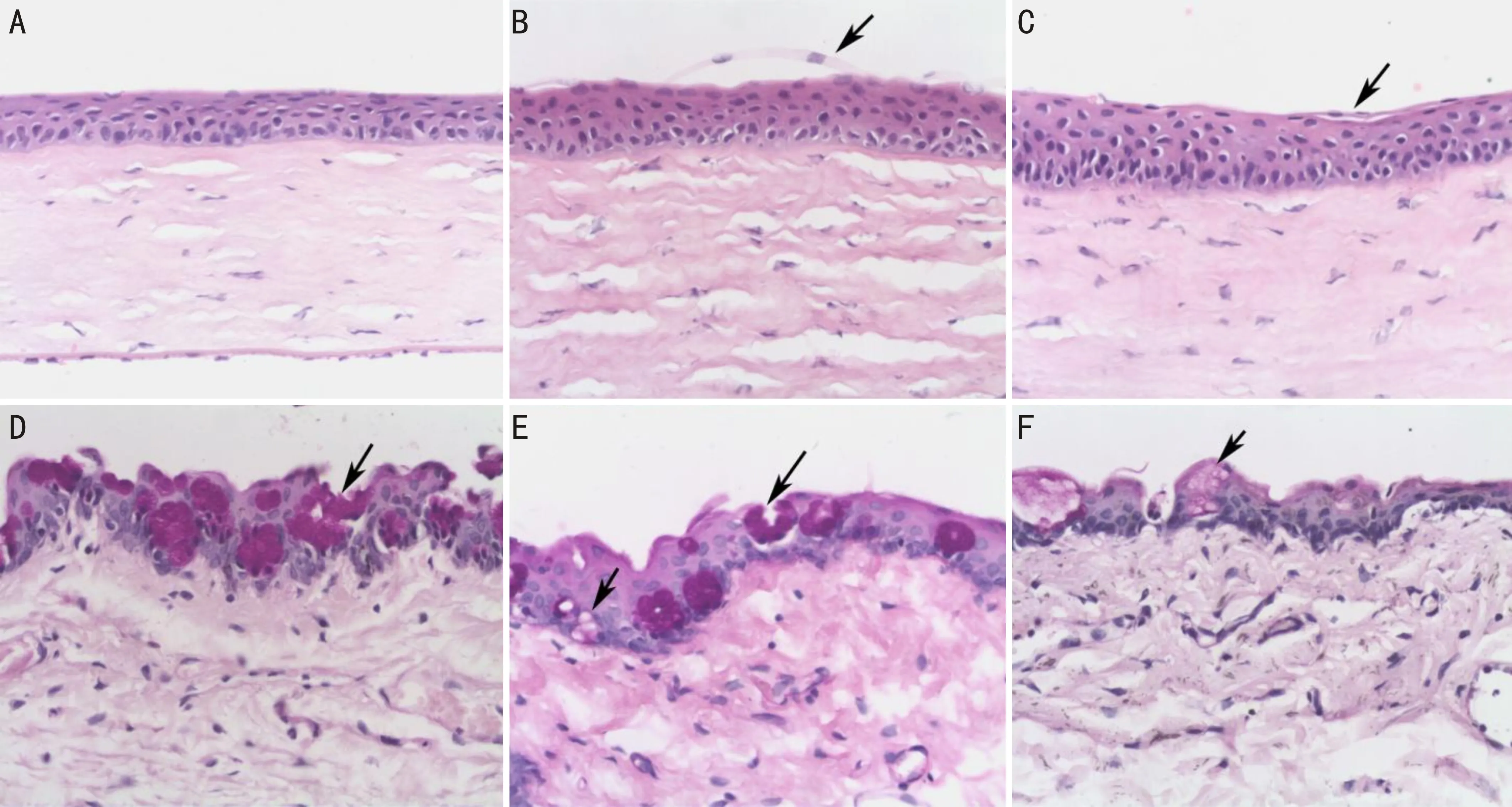
图2 HE和PAS染色
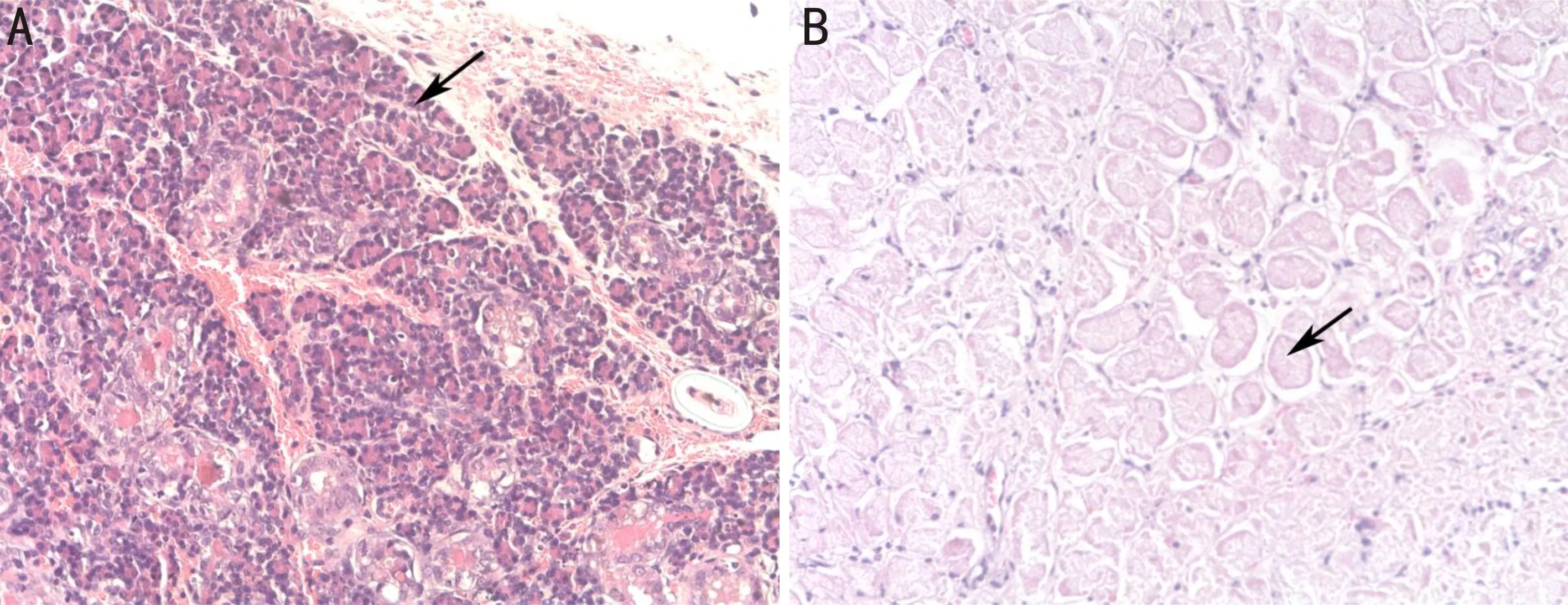
图3 泪腺病理改变(×200)
2.5 RT-PCR结果先观察熔解曲线,所有引物的熔解曲线均只出现单峰,说明反应具有特异性。结膜组织:细胞因子EGF、TNF-α和IL-6在B组及C组中表达量均显著增高(F=10.78,P=0.001;F=32.48,P<0.001;F=30.80,P<0.001),B、C组EGF表达量分别为A组的2.73±1.38倍和3.19±1.04倍;B、C组IL-6表达量分别为A组的4.96±1.63倍和2.17±0.75倍;B、C组TNF-α表达量分别为A组的3.96±1.34倍和3.74±0.70倍,差异均有统计学意义(P<0.05);B、C组间比较,EGF及TNF-α的表达差异均无统计学意义(P=0.826、0.967),IL-6表达差异有统计学意义(P=0.004),见图4A。角膜组织:细胞因子EGF、TNF-α和IL-6在B组及C组中表达量均显著增高(F=12.86,P<0.001;F=17.39,P<0.001;F=60.15,P<0.001),B、C组EGF表达量分别为A组的2.46±1.03倍和3.78±1.60倍;B、C组IL-6表达量分别为A组的6.95±1.35倍和4.25±1.31倍;B、C组TNF-α表达量分别为A组的4.35±1.90倍和4.16±1.13倍,差异均有统计学意义(P<0.05);B、C组间比较,EGF及TNF-α的表达差异无统计学意义(P=0.196、0.993),IL-6表达差异有统计学意义(P=0.003),见图4B。
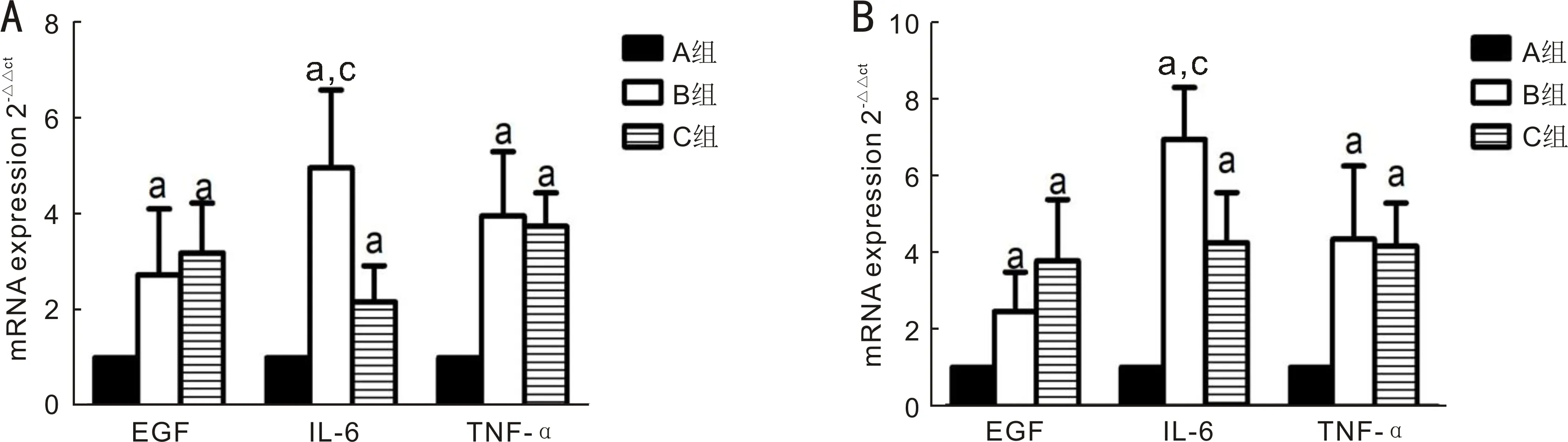
图4 RT-PCR结果
3讨论
干眼症的发生与泪液的分泌或蒸发异常密切相关[8],而泪液通过瞬目运动涂抹在眼表形成一层超薄的泪膜,自外至内分成脂质层、水样层和粘蛋白层,任何一层结构异常均可导致干眼症的发生。大鼠的泪器包括泪腺、泪腺排出管及鼻泪管。主泪腺在激素和神经的调控下分泌出泪液,构成了泪膜水样层的主要成分,因此摘除大鼠主泪腺可以制作干眼症动物模型[9]。泪腺的神经支配非常丰富,通过来自于面神经的副交感神经和来自颈上神经节的细小交感神经纤维共同支配调节。肉毒杆菌毒素是一种嗜神经毒素,能够抑制副交感神经末梢钙离子介导的乙酰胆碱的释放,有A~G7亚型,其中A型和B型最为常见。有报道证实泪腺注射BTX-B后泪腺腺泡发生去神经性萎缩,最终导致泪液分泌减少[10],但此种方式构建的干眼模型存在稳定性差的缺点。BTX-A型最早使用于临床,其药物毒性比B型低,药效持续时间比B型久,因此我们推测BTX-A注射泪腺后可以构建稳定的干眼模型。
泪腺摘除组和泪腺注射BTX-A组从实验后第3d开始均出现了泪液分泌量持续性减少,第7d泪膜破裂时间开始持续性缩短,第28d达到最低点并维持稳定,角膜上皮变得粗糙糜烂,有荧光着染甚至溃疡斑片出现,角膜上皮细胞排列不规则,上皮点状脱落,结膜杯状细胞数量明显减少,BTX-A组的泪腺腺体严重萎缩,以上结果提示本实验得到的模型均符合水液缺乏型干眼的临床特点和病理学特征。泪腺摘除组和泪腺注射BTX-A组在第3d同时出现了泪液分泌量的减少,和既往研究中BTX-B造模后3d出现泪液分泌减少的结果相一致[5,10],说明了BTX-A起效迅速,可以快速地引起泪腺的萎缩。Lin等[11]研究发现BTX-B干眼模型在造模28d后会出现泪液分泌量升高,模型存在欠稳定等缺点,可能和BTX-B药物有效时间短,泪腺暂时性萎缩有关[5],但本实验的BTX-A组没有出现这种现象,提示了BTX-A构建的干眼模型更加稳定。泪腺摘除组和泪腺注射BTX-A组组间比较没有差异,说明这两种造模方式构建的干眼模型在临床表现的严重程度方面是没有差别的。由此可见,本实验中两种方法构建的干眼症模型是成功的。
越来越多的研究表明,炎症在干眼的发病机制中起到了关键的作用[12],多种炎症因子[13]已被证实参与了干眼的病变过程,在损伤角膜上皮结构,破坏泪膜稳定性等方面扮演了重要角色,其中IL- 6和TNF-α尤为重要,它们同属细胞因子网络中的核心成员。IL-6是一种调节炎症反应的细胞因子,是B细胞和T细胞功能的重要调节因子,干眼患者结膜上皮多种炎性因子增高,而IL-6是最有价值的[14]。RT-PCR结果显示摘除泪腺组和注射BTX-A组IL-6因子表达量均明显的提升,摘除泪腺组高于注射BTX-A组,此结果证实了泪腺缺如或泪腺萎缩可以引起IL-6的升高,并且猜测升高的程度可能和泪腺缺损程度呈正相关。TNF-α主要由巨噬细胞产生,具有广泛的生物活性,可以改变多重靶细胞的功能,TNF-α是细胞黏附和趋化的主要介质,主要负责炎症期间细胞迁移的调控。Oshida等[15]指出干眼患者泪液中TNF-α的浓度增高,且浓度高的患者荧光素染色评分高,这表明泪液中TNF-α含量与角膜上皮受损情况呈正相关,暗示TNF-α也是干眼症发生的炎性介质。本实验显示两个模型组的TNF-α因子表达量升高,且两组间比较没有差异,与荧光素钠染色及病理学检查结果相一致。由此证实,泪腺萎缩或缺如导致泪液分泌量减少,泪液渗透压升高,进而激活IL-6和TNF-α介导的炎症反应。
EGF是一种可以修复上皮组织,对抗损伤的因子。先前研究中发现EGF在干燥综合征患者的泪液,泪腺或唾液腺中的表达明显降低[16],但也有证据[17-18]表明干眼导致的角膜损伤可以引起EGF的升高。本实验两种造模方式均可以引起EGF的升高,推测是否和主泪腺受损及角膜上皮损伤后的代偿性反应相关,有待后续实验进一步证实。目前对于EGF的评价呈两极分化,一方面EGF可以促进角膜上皮伤口的愈合,另一方面EGF的升高可能与肿瘤相关。因此干眼症中EGF的表达变化,是否采用EGF治疗,如何使用EGF是安全有效的,这些问题值得进一步研究。
本实验对比了两种诱导水液缺乏型干眼症动物模型的方法:摘除泪腺法模型表现稳定,缺点是手术会造成不可逆的泪腺缺如,并且手术创伤大,要求一定的手术技巧,此种模型适合于观察人工泪液等代替治疗的疗效,但不适用于观察针对于泪腺治疗的效果;泪腺注射BTX-A制备的模型稳定性与泪腺摘除法相近,操作相对简单,其导致的泪腺萎缩更贴合于人类疾病的特点,适合于药物或干细胞修复泪腺功能以及治疗角膜损伤等相关实验。但BTX-A有一定的药物毒性,是否对实验动物造成其他不良影响有待于进一步观察。每一种动物模型均有其优点,也有其弊端,因此在进行干眼病理及药理研究的过程中,需根据实验设计及实验目的去选择合适的动物模型。

