空心硫化铜颗粒包载阿霉素形成的纳米颗粒对胰腺癌BxPC-3细胞株的杀伤效应
张 聪,杭立峰,陈 军,詹 翔,金 雷,余 跃
胰腺癌(pancreatic cancer, PC)是一种高度恶性的消化道肿瘤,发现时往往已经处于肿瘤晚期,对于中晚期PC临床治疗以化疗为主[1-2]。阿霉素作为一种经典的化疗药物,但在体内容易被清除[3-5]。近年来,纳米载药体系可以增强药物体内循环时间引起了广泛关注[6-7]。
光热疗法(photothermal therapy, PTT)是利用光诱导剂在电磁辐射作用下使得肿瘤局部升温从而杀伤肿瘤细胞的一种新型肿瘤治疗方法,在肿瘤治疗领域已经取得广泛进展[8-9]。在肿瘤治疗过程中,单独的化疗往往并不理想,已有文献[10]报道通过结合PTT来实现化疗增敏。硫化铜(copper sulphide, CuS)纳米颗粒作为光热治疗剂引起了广泛的关注[11]。但是由于CuS表面积较小难以携载药物[12-13],该研究旨在通过优化制备方法得到可以携载阿霉素的空心CuS纳米颗粒,同时与PTT相结合进而实现对PC细胞的化疗增敏杀伤效果,为胰腺癌的临床治疗提供进一步的指导。
1 材料与方法
1.1 材料阿霉素盐酸盐(doxorubicin, DOX) 购自北京华丰有限公司;BxPC-3人源PC细胞株购自上海细胞库;噻唑蓝[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide]购自美国Sigma-Aldrich公司;RPMI-1640培养基购自美国Invitrogen公司;血清购自美国Hyclone公司;空心CuS颗粒由中国科学技术大学生命科学学院杭立峰博士馈赠。
1.2 方法
1.2.1纳米颗粒的制备 将制备好的空心CuS颗粒及PEG按质量比1 ∶1在水溶液中进行共同孵育12 h后,离心即可获得PEG修饰的CuS颗粒。通过将PEG-CuS颗粒与DOX共孵育,采用搅拌等方式成功将DOX包载于空心CuS颗粒中。
1.2.2纳米颗粒粒径及血清稳定性检测 分别将100 μl制备好的空心CuS颗粒溶液加入到不同的比色皿中,用动态光散射仪(dynamiclight scatterometer,DLS)来检测纳米颗粒尺寸,温度控制在25 ℃,重复3次测量。为了了解CuS及PEG修饰后的CuS颗粒是否能在血清中稳定存在,将其加入含10%胎牛血清的RPMI-1640溶液中边孵育边缓慢搅拌,然后用DLS分别检测不同纳米颗粒在相应时间点的纳米颗粒粒径大小,分析其在血清中稳定性。
1.2.3细胞培养 人源PC细胞系BxPC-3使用含有1%的双抗及10%的胎牛血清的1640培养基进行培养,37 ℃、5% CO2温箱进行孵育。当细胞密度长到培养皿的70%~80%时,使用胰酶(0.25%)进行消化、传代、种板等。
1.2.4ICP-MS检测PEG-CuS颗粒摄取情况 BxPC-3细胞种植入24孔板中,每孔种植10万细胞,每组设置3个平行对照。温箱中孵育24 h后,加入PEG-CuS颗粒进行孵育。在温箱孵育2、4、6 h后取出培养板,吸去旧的含有颗粒和纳米药物的培养基,向板中各孔使用500 μl 1×PBS缓冲液清洗3次,充分洗去孔板中药物残留。接下来向每孔中加入200 μl胰酶进行消化,CO2温箱孵育3~5 min后终止消化,消化后将其转移至玻璃瓶中,加入硝酸300 ℃高温蒸煮,反复蒸煮3次后,加入王水(浓盐酸 ∶浓硝酸=3 ∶1)溶解,MILI-Q进行定容,ICP-MS进行定量检测。
1.2.5MTT法检测不同纳米药物杀伤PC细胞效果 当BxPC-3细胞密度长到培养皿的70%~80%左右时,BxPC-3细胞种植入96孔板中,每孔种植5 000细胞,CO2温箱孵育过夜,弃去旧培养基,实验共分为3组,分别是CuS纳米颗粒组、阿霉素组、CuS包载阿霉素组。CuS组每孔分别加入浓度为100、50、25、12.5 μg/ml的CuS颗粒;DOX组分别加入浓度为10、5、2.5、1.25 μg/ml的DOX;CuS包载DOX采用100 μg/ml CuS包载后终浓度为5 μg/ml的DOX作为治疗初始组,其余各组对半稀释,依次为50 μg/ml CuS包载浓度为2.5 μg/ml DOX, 25 μg/ml CuS包载浓度为1.25 μg/ml DOX,12.5 μg/ml CuS包载浓度为0.625 μg/ml DOX。每组设置3个平行对照,不加任何药物的孔设为空白对照组。PBS组,游离DOX组,CuS及CuS包载DOX组温箱孵育4 h后均给予1 064 nm激光器处理,时间为5 min,功率为1 W/cm2。照射结束后温箱孵育24 h。24 h后,每孔加入25 μl 5 mg/ml MTT溶液,孵育2~4 h后,弃去旧培养基,每孔加入100微升DMSO混匀,摇床震荡1 h后,酶标仪488 nm波长进行检测。用软件Excel 2013和GraphPad.Prism.V7.0.处理测好的对应孔的吸光度(optical density, OD)值,计算细胞存活率。细胞存活率(%)=(药物细胞组OD值-空白对照组OD 值)/(非光照不加药细胞组OD值-空白对照组OD值)×100%。
1.2.6死活细胞染色法检测不同纳米药物对PC细胞杀伤效果 BxPC-3细胞种植入24孔板中,每孔种植1×105个细胞,实验分为4组:PBS对照组、CuS组、游离DOX组及CuS包载DOX组。温箱中孵育24 h后,分别加入浓度为100 μg/ml的CuS颗粒,浓度为5 μg/ml的DOX,CuS浓度为100 μg/ml包载后终浓度为5 μg/ml的DOX组进行孵育。在温箱孵育4 h后,PBS组,游离DOX组,CuS及CuS包载DOX组温箱孵育4 h后均给与1 064 nm激光器处理,时间为5 min,功率为1 W/cm2。根据死活染色试剂盒的具体步骤进行死活染色,倒置荧光显微镜下进行观察。
2 结果
2.1 空心CuS颗粒的粒径及血清中稳定性首先通过DLS验证颗粒的粒径位于356.3 nm左右,如图1A所示,之后使用PEG进行表面修饰后,PEG-CuS颗粒粒径为209.8 nm左右,同时采用透射电镜对PEG-CuS进行表征,如图1B所示,PEG修饰后的CuS颗粒约200 nm左右,这与DLS下的结果相一致的。为了验证颗粒在体内的稳定性,使用10%血清模拟体内血液循环。通过将PEG-CuS颗粒置于10%血清中,可以看出颗粒的粒径在一定范围内波动,可以验证材料血清中稳定存在的,如图1C所示。
2.2 ICP-MS定量分析结果显示BxPC-3细胞对纳米颗粒在6 h时间点摄取最多在CO2温箱中分别孵育2、4、6 h后,PEG-CuS颗粒与PC细胞孵育后,对细胞摄取量进行定量分析后,在2、4、6 h时间点,PC细胞对PEG-CuS的摄取率随着时间的推移而提高,在4 h时间点(20.20%)摄取率高于2 h时间点(12.95%)(P<0.05,t=4.083),在第6小时时间点摄取量(32.98%)高于第4小时(20.20%)(P<0.01,t=5.889),差异均具有统计学意义。
2.3 MTT法显示CuS包载阿霉素组在光热情况下杀伤效果最好细胞水平上,分别将BxPC-3细胞与CuS及DOX、CuS包载DOX共孵育后进行光照处理(1 064 nm,1 W/cm2),从MTT法及死活染色法去验证杀伤效果。从图2中可以看出,CuS包载阿霉素+光照(100 μg/ml CuS包载浓度为5 μg/ml的DOX组)这组杀伤效果最好,对PC细胞杀伤率高达88.3%,优于单独的CuS+光照治疗组(100 μg/ml)的52.04%(F=711.6,P<0.000 1)及游离DOX组(5 μg/ml)的45.58% (F=711.6,P<0.000 1),差异具有统计学意义。
2.4 死活细胞染色法检测各治疗组杀伤情况对各治疗组细胞通过死活染色试剂盒进行染色,红色细胞代表死细胞,绿色细胞代表活细胞。如图3所示,之后通过对图片中细胞存活率进行统计分析得出结论:CuS包载DOX组杀伤效果最强,优于游离DOX组(P<0.000 1,F=201.8)及空心CuS组(P<0.000 1,F=201.8)。

图1 纳米颗粒的相关表征
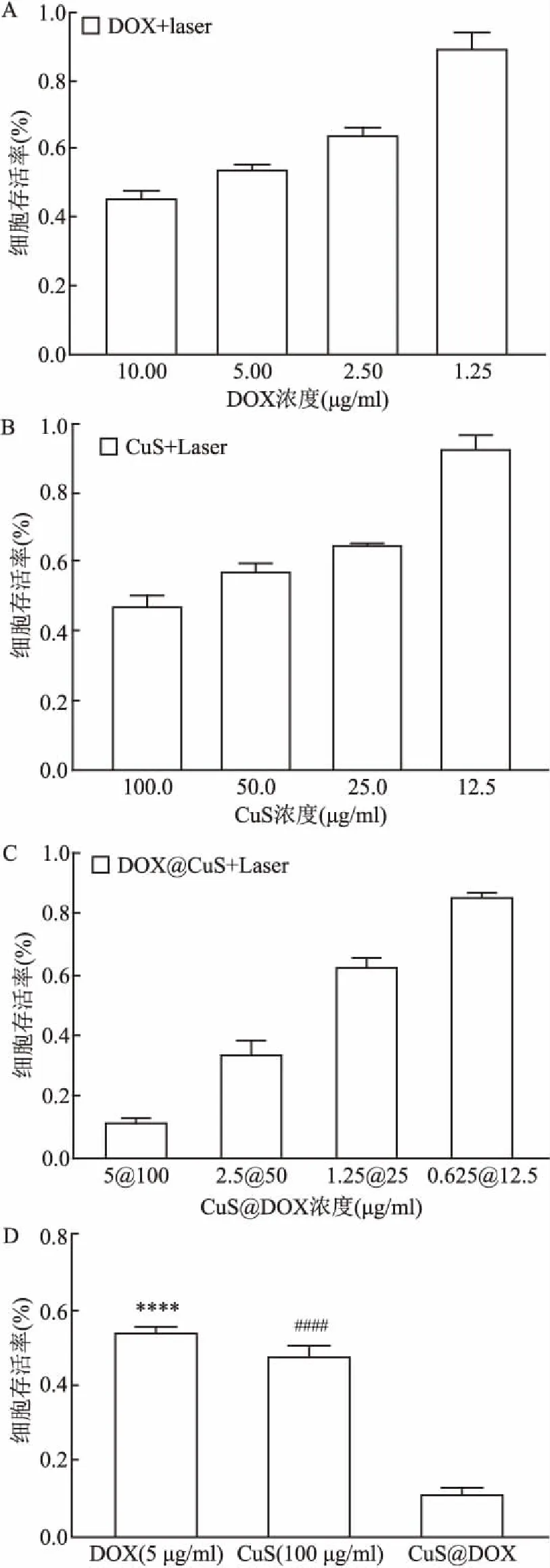
图2 空心CuS颗粒及游离DOX及CuS包载DOX对PC杀伤情况

图3 死活染色法检测各治疗组杀伤情况
3 讨论
PTT是近年来出现的一种有效的肿瘤治疗技术。光热剂被递送到目标细胞或组织,然后通过激光照射将吸收的光能转化为热能,导致癌细胞的热消融[14-15]。CuS纳米颗粒由于具有稳定的近红外吸收、低成本和高稳定性等优点,是一类很有前途的新型光热剂[16-17]。
DOX作为一种经典的杀伤肿瘤的化疗药,虽然取得了较强的杀伤肿瘤效果,但是也带来了强烈的毒副作用,从而限制了其在临床治疗中的应用。近年来,纳米载药体系引起了广泛关注。纳米载药体系主要通过囊封、包埋、吸附等方式包载临床药物,包载后可以改善药物水溶性,提高药物的选择性,增强药物在肿瘤位置富集强度及减少药物对正常组织的副作用等[18]。因此,本研究设计并制备得到空心CuS纳米颗粒用于携载化疗药DOX。细胞水平结果显示,通过PEG修饰后的CuS纳米颗粒随着时间的推移PC细胞对其摄取率是提高的。接下来进一步通过MTT和死活染色结果均显示通过化疗与光热联合后,杀伤效果增强,对PC细胞杀伤率高达88.3%,证明了两种方案结合的有效性。
综上所述,本研究证明了CuS纳米颗粒通过其空心结构成功携载阿霉素,一方面,通过PEG修饰后PC细胞对CuS摄取率随着时间的推移而提高,而且有文献报道通过PEG修饰后可以实现纳米药物的血液循环时间延长,并基于肿瘤部位的EPR效应进一步实现肿瘤富集作用[19];另一方面,通过与PPT疗法相结合实现了对肿瘤杀伤的化疗增敏作用。而通过PEG修饰的CuS纳米颗粒在动物水平上是否与细胞水平保持一致,有待进一步研究。

