人COX1蛋白真核表达载体的构建及其生物信息学分析
董 媛,李建华,贾俊臻,冯文卓,孟晨阳,贺佳美,唐一鑫,王会岩
(吉林医药学院检验学院生物技术教研室,吉林 吉林 132013)
前列腺素E1(prostaglandin E1,PGE1)也称前列地尔,是临床上治疗勃起功能障碍的局部用药物[1],对糖尿病[2]和肾损伤[3]等疾病也有疗效。目前市场上合成PGE1主要通过化学合成法和生物合成法[4],但是产出率低,且增加了环境污染的风险。利用羊精囊中存在的天然环氧合酶(cyclooxygenase,COX),催化二十碳不饱和脂肪酸发生环氧化反应可生成PGE1[5]。但是羊精囊资源有限,成本极高,且存在人畜共患病的潜在风险。如果能够通过基因工程手段实现COX的体外表达,既能提高PGE1产量,又能控制生产过程,降低风险。
COX有2种亚型:COX1和COX2[6],二者是同工酶,COX1是结构酶,而COX2是诱导酶,主要作用是促进PGE的合成。目前,对于COX1研究多倾向于药理学和药效学研究领域,如COX1对化学肝损伤的保护作用、调节动脉粥样硬化、参与直肠癌和胃癌的发生发展等,而对其真核表达载体的构建和体外表达COX1的酶活性报道较少。COX1为一种膜整合蛋白,由599或600个氨基酸残基组成,含有23或24个氨基酸残基构成的信号肽[7]。本研究通过构建人COX1基因真核表达载体,并在HEK-293F细胞中表达,验证COX1酶催化活性,以期寻找替代羊精囊合成PGE1的新途径。
1 材料与方法
1.1 细胞、主要试剂和仪器新鲜羊精囊,购于吉林省吉林市江南批发市场。pCMV6-Entry Vector和感受态细胞E.coliDH5-α购自北京天根生化科技有限公司,人胚肾细胞HEK-293F由实验室保存,人微血管内皮细胞(human microvascular endothelial cells, HMECs)购自上海研谨生物科技有限公司。质粒提取试剂盒和RNA提取试剂盒购自北京全式金生物科技有限公司,逆转录试剂盒购自江苏省吴江近岸蛋白质科技有限公司,EndoFectinTM-Expi293转染试剂购自北京义翘神州生物科技有限公司,T4 DNA连接酶、SgfⅠ和MluⅠ限制性内切酶购自北京NEB生物科技有限公司,PGE1检测试剂盒购于上海泽叶生物科技有限公司,Anti-Myc-Tag mAb (HRP-Conjugated)、HRP-Goat Anti-Mouse IgG(H+L)和ECL 化学发光试剂盒购自美国Abmart公司。K160 PCR扩增仪(力康生物科技有限公司),GelDoc EZ凝胶成像仪(美国Bio-Rad公司),CO2培养箱(美国赛默飞公司)。
1.2 PCR扩增目的基因COX1根据GenBank中COX1编码基因序列(coding sequence,CDS)NM_000962,由生工生物工程(上海)股份有限公司设计特异性引物并合成。引物序列(上游引物下划线为SgfⅠ酶切位点,下游引物下划线为MluⅠ酶切位点):上游引物5′- ATGCGATCGC-ATGAGCCGGAGTCTCTTGCTCC-3′,下游引物5′-CGACGCGTTCAGAGCTCTGTGGATGGTCG-CTC-3′。
采用RNA提取试剂盒提取HMECs总RNA后,逆转录成cDNA,以cDNA为模板,采用常规PCR扩增COX1基因。逆转录体系及步骤参照逆转录试剂盒说明书。PCR反应体系:模板1 μL,上游引物1 μL ,下游引物1 μL,2×Taq Mix 12 μL,灭菌水10 μL。PCR反应条件:95℃、5 min;95℃、45 s,60℃、45 s,72℃、1 min,30个循环;72℃、10 min。
1.3 重组真核表达载体pCMV6-COX1的构建将 PCR 产物利用胶回收试剂盒纯化回收,采用SgfⅠ酶和MluⅠ酶分别对pCMV6载体和COX1 PCR扩增产物37℃双酶切1 h,DNA电泳,胶回收目的条带(载体约4 900 bp,COX1目的基因约1 800 bp),T4 DNA连接酶16℃连接过夜。连接产物转化大肠杆菌DH5-α感受态细胞,涂布于Kana+的LB平板,37℃倒置培养12~16 h。
1.4 COX1重组真核表达质粒的鉴定挑取单菌落,接种于LB液体培养基,37℃、180 r·min-1振荡培养24 h,提取质粒,分别采用双酶切法和PCR法鉴定。阳性克隆测序,与COX1基因序列进行比对。
1.5 COX1蛋白生物信息学分析采用Expasy数据库中的ProtParam工具分析蛋白质的疏水性[8];采用SignalP 4.1软件分析蛋白信号肽,采用TMHMM Server v.2.0在线分析软件预测COX1蛋白跨膜区域[9],采用NetPhos 3.1 Server 在线工具分析磷酸化位点,采用PSIPRED方法预测蛋白质的二级结构[10];采用SWISS-MODEL程序进行折叠模式识别,并用Qmean工具进行评估,选取最佳三级结构结果[11]。
1.6 COX1基因真核表达载体转染HEK-293F细胞接种阳性克隆于150 mL LB液体培养基中,37℃、180 r·min-1振荡培养24 h,提取质粒,取30 μg无内毒素质粒,根据EndoFectinTM-Expi293转染试剂操作说明书,转染入7.5×107mL-1的HEK-293F细胞中(25 mL),5% CO2培养箱中培养,分为转染重组质粒2 d组和转染重组质粒5 d组,同时设未转染的HEK-293F细胞为对照组,分别收集各组细胞培养上清及细胞,细胞超声破碎提取总蛋白,细胞培养上清经超滤浓缩,Western blotting法检测COX1蛋白表达水平,以Image J V1.8.0软件分析条带灰度值,以目的蛋白条带灰度值与GAPDH条带灰度值比值代表COX1蛋白表达水平。
1.7 羊精囊提取粗酶混合物将5个羊精囊去除脂肪和结缔组织后称质量,剪碎后加入2倍质量的0.154 mol·L-1KCl匀浆,9 000 r·min-1离心10 min,取上清,重复2次,合并上清液,用2 mol·L-1柠檬酸调节pH值至4.8~5.0,9 000 r·min-1离心10 min,取沉淀,加入25 mL磷酸盐/EDTA-Na2缓冲液(pH值 8.2磷酸盐缓冲液∶0.125 mol·L-1EDTA-Na2=9∶1)重悬,备用[5]。
1.8 COX1酶催化二高-γ-亚麻酸合成PGE1含量的测定酶促反应体系[5]:转染后HEK-293F细胞上清或羊精囊提取的COX1粗酶(40%)、对苯二酚(0.01%)、还原型谷胱甘肽(0.1%)和二高-γ-亚麻酸(1%和5%),以磷酸盐/EDTA-Na2缓冲液补足体积至5 mL,加入二高-γ-亚麻酸后立即搅拌,通入足量空气,37℃水浴或者温箱中反应1 h,2 000 r·min-1离心10 min,取上清,采用PGE1试剂盒检测,以梯度稀释的标准品浓度为横坐标,吸光度(A)值为纵坐标,绘制标准曲线,每个样品重复测定3次。
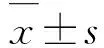
2 结 果
2.1 PCR扩增目的基因COX1以HMECs的cDNA为模板,利用PCR法扩增目的基因COX1,扩增产物与实际大小一致,约1 800 bp。见图1。
Lane 1:DNA marker;Lane 2:COX1 gene.
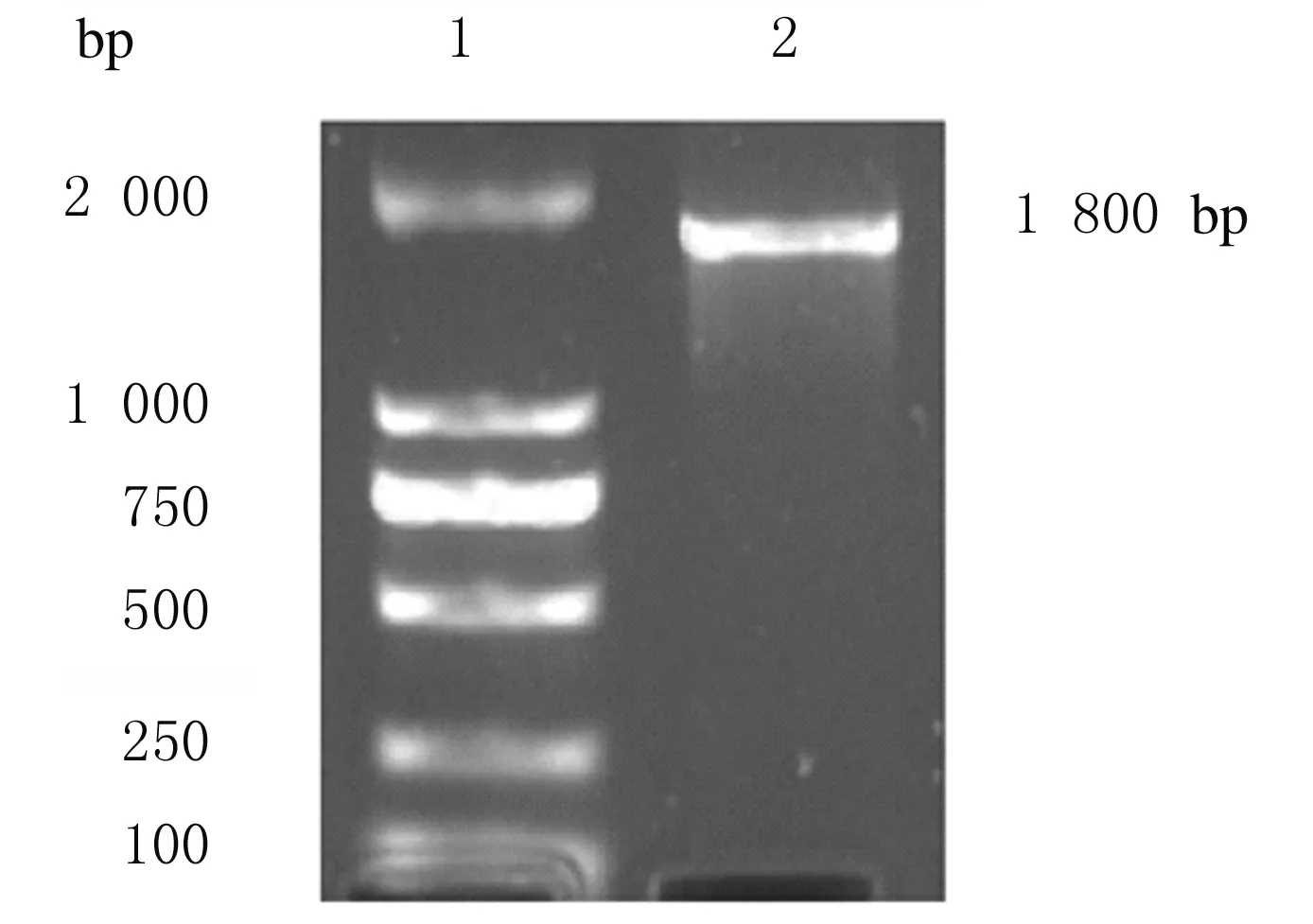
2.2 COX1基因真核表达载体的鉴定提取的重组质粒经SgfⅠ和MluⅠ双酶切,酶切5 min和10 min效果比较无明显差异,得到目的基因COX1和载体pCMV6-Entry 2个片段。见图2。
Lane 1: DL5 000 DNA marker;Lane 2: Recombinant plasmid;Lane 3: Product digested by double enzyme for 5 min;Lane 4: Product digested by double enzyme for 10 min;Lane 5, 6: DL2 000 DNA marker;Lane 7: COX1 gene.
经双酶切鉴定成功的质粒送往生工生物工程(上海)股份有限公司测序,测序结果与美国国家生物技术信息公司(NCBI)网站上的COX1全基因序列进行比对,结果显示无明显差异,测序比对结果见图3(插页四)。
2.3 COX1蛋白生物信息学分析COX1编码区蛋白有658个氨基酸,总平均亲水性(grand average of hydropathicity, GRAVY)值为-0.217,相对分子质量为75 321.09,等电点为8.28,不稳定指数为46.36,说明该蛋白为水溶性蛋白,但稳定型差。采用SignalP 4.1软件在线分析COX1蛋白,显示其含有信号肽,位置在1~53位氨基酸(图4,见插页四)。采用TMHMM Server v.2.0在线分析软件预测COX1蛋白跨膜区域,采用NetPhos 3.1 Server 在线工具分析磷酸化位点,结果显示:34~53位氨基酸处于跨膜区域(图5A,见插页四),COX1蛋白有36个丝氨酸磷酸化位点,14个苏氨酸磷酸化位点,9个酪氨酸磷酸化位点(图5B,见插页四)。
采用PSIPRED方法预测COX1蛋白的二级结构,采用SWISS-MODEL程序预测三级结构。COX1二级结构中,不规则卷曲所占比例最大(46.2%),其次为α螺旋(41.03%),延伸链和β-转角分别占10.18%和2.58%。COX1蛋白三级结构较为致密,分子结构中存在较多的α螺旋和不规则卷曲,与二级结构预测结果一致。见图6(插页四)和图7(插页四)。
2.4 Western blotting法检测HEK-293F细胞和细胞培养上清中COX1蛋白表达水平分别收集转染重组质粒2 d和5 d组HEK-293F细胞和细胞培养上清,利用Western blotting法检测COX1蛋白表达水平,结果显示:COX1蛋白相对分子质量约为70 000,与实际大小一致。转染COX1基因的HEK-293F细胞和细胞培养上清中均表达COX1蛋白,转染重组质粒2 d组与转染重组质粒5 d组细胞中COX1蛋白表达水平(0.71±0.03和0.67±0.08) 比较差异无统计学意义(P>0.05),但转染重组质粒5 d组细胞培养上清中COX1蛋白表达水平(5.93±0.25)明显高于转染重组质粒2 d组(4.93±0.37)(P<0.05)。见图8。
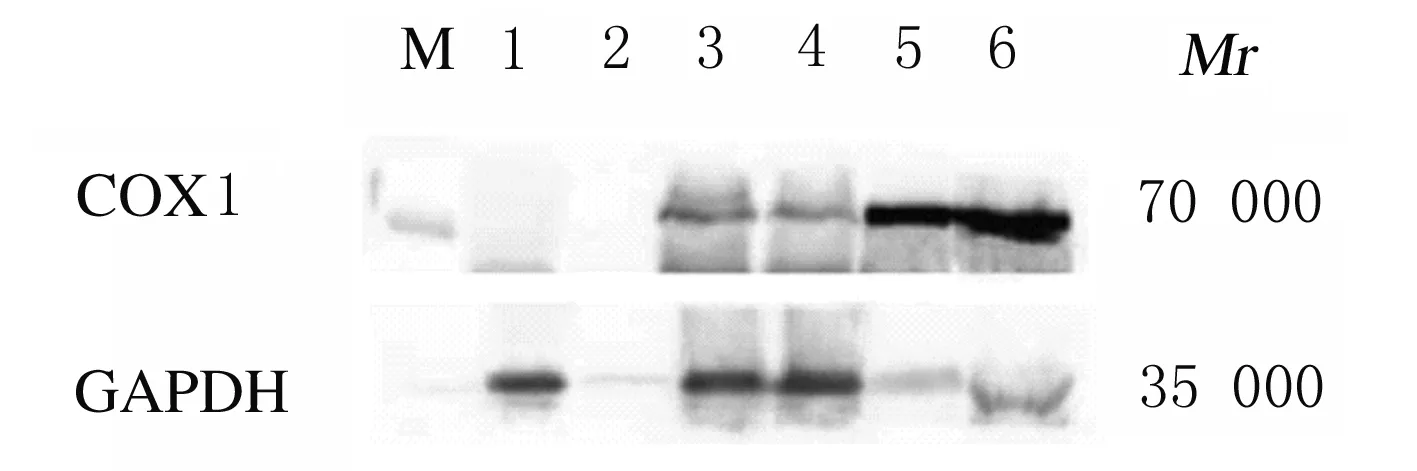
M: Protein marker;Lane 1:Cells in control group;Lane 2: Cell culture supernatants in control group;Lane 3: Cells in transfection 2 d group;Lane 4: Cells in transfection 5 d group;Lane 5: Cell culture supernatants in transfection 2 d group;Lane 6: Cell culture supernatants in transfection 5 d group.
2.5 真核表达COX1蛋白和羊精囊提取粗酶催化底物合成PGE的含量以二高-γ-亚麻酸(1%和5%)为底物,按照PGE1检测试剂盒使用说明书,绘制得标准曲线Y= 671.32X-33.113(R2= 0.999 3),分别计算细胞培养上清中真核表达COX1蛋白和羊精囊提取粗酶混合物催化底物合成PGE1含量,真核表达COX1蛋白能够催化底物合成PGE1,其活性相当于为5个羊精囊提取的粗酶活性的(90.30±0.06)%。见表1。
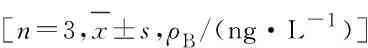
表1 真核表达COX1蛋白和羊精囊提取的粗酶混合物催化底物合成PGE1的含量
3 讨 论
PGE1具有广泛的药理和生理作用,包括扩张血管、保护缺血心肌、改善心功能和治疗糖尿病等[12-13],临床上用来治疗各种心脏病、慢性呼吸疾病和各种类型肝炎等多种疾病[14-16],市场需求量大。目前虽然实现了PGE1的生物合成和化学合成,但是化学合成方法步骤复杂,副产物多,纯化困难,生产量一直受限;而生物合成由于使用的羊精囊属于动物组织来源,受到原料局限,且容易增加人畜共患病风险,导致PGE1产品价格居高不下。
研究[17-18]表明:COX1是生物合成PGE1的关键酶,COX1通过催化花生四烯酸氧化合成PGE1,一般情况COX1主要存在于胃、肠道上皮细胞和血管内皮细胞中,起到保护黏膜细胞和改变血管张力的作用。在胃肠疾病中,尤其是胃肠道炎症和肿瘤组织中,常见COX1异常表达[19-20],但其在各种胃肠疾病中的作用机制至今尚不清楚。研究[21]显示:COX1在正常黏膜组织中长期存在,是稳态的维持者和PGE1的分泌者。生理条件下,COX1的表达量维持在一个稳定的状态,很难满足PGE1大量生产的要求。
获取COX1的编码区并构建其真核表达载体是研究COX1生理功能及其在PGE1体外生物合成过程中作用的基础。本研究首先成功构建pCMV6-COX1重组载体,双酶切、PCR和测序结果表明:目的基因COX1成功连接到真核表达载体pCMV6。随后通过生物信息学分析了COX1蛋白编码区的结果显示:COX蛋白含有信号肽,包含跨膜区,属于分泌型蛋白,在真核表达系统HEK-293F细胞中表达后,COX1蛋白主要分泌在细胞培养基中,也验证了生物信息学预测结果的可靠性,真核表达的COX1蛋白有利于后续纯化,且蛋白结构更接近天然活性蛋白状态,结构完整,可用于研究COX1的更多生理功能和新型抑制剂的开发。
为了验证真核表达的COX1有环氧合酶催化活性,能够催化二高-γ-亚麻酸合成PGE1,本研究建立了一个体外酶促反应体系,同时与羊精囊粗酶提取物活性进行比较,结果表明:25 mL细胞培养上清预处理后,其酶活性与5个羊精囊制备的粗酶活性相当,解决了羊精囊提取的粗酶混合物催化合成PGE1生产方法效率低、质量不稳定的瓶颈,为高效合成PGE1提供了新的方法。故通过优化表达工艺和纯化COX1蛋白等手段可以进一步提高COX1蛋白的酶活性,进而提高PGE1产量。
综上所述,本研究获得的COX1蛋白具有理想的体外催化特性,构建的pCMV6-COX1重组载体为后续深入研究COX1的生理功能和其在病理过程中的作用以及筛选COX1抑制剂的研究奠定了基础。

