宫颈癌HeLa细胞外泌体对细胞迁移和侵袭的影响及其Wnt/β-catenin信号通路机制
刘 晶,王 景,葛 静,冯艳萍,房桂英,王 旭,杨艳红,李 林
(河北医科大学第一医院妇产科,河北 石家庄 050031)
宫颈癌患者治疗失败及预后比较差的主要原因为宫颈癌的转移,但其侵袭转移的分子机制尚不十分清楚。外泌体为一种双层膜包裹的小囊泡,在生理和病理条件下由细胞释放到胞外[1]。研究[2-3]显示:外泌体携带包括mRNA、DNA、长链非编码RNA(LncRNAs)、微小 RNA(microRNAs)、脂质和蛋白等一系列生物活性物质,在恶性肿瘤的侵袭、转移、血管生成和化疗耐药等过程中发挥重要作用。宫颈癌细胞来源外泌体也受到大家关注,易红艳等[4]通过差速超速离心法分离出宫颈癌Siha细胞 外泌体,并发现Siha细胞外泌体可介导癌前细胞Ect1上皮间质转化,从而提高其侵袭能力。但宫颈癌HeLa细胞外泌体对其侵袭迁移的影响及可能机制尚未完全清楚。本文作者通过分离宫颈癌HeLa细胞外泌体,观察其对HeLa细胞迁移、侵袭及Wnt/β-连环蛋白(β-catenin)信号通路的影响,探讨宫颈癌细胞来源的外泌体对宫颈癌细胞的作用和可能机制。
1 材料与方法
1.1 细胞、主要试剂和仪器人宫颈癌HeLa细胞(ATCC细胞库)。FKH-26染剂和胰蛋白酶(美国Sigma公司),RPMI 1640培养基和胎牛血清(美国Hyclone公司),兔抗人CD63抗体、兔抗人CD81抗体、兔抗人Wnt1抗体、兔抗人β-catenin抗体和兔抗人T细胞因子4(T cell factor 4,TCF4)抗体(美国Abcam公司)。共聚焦显微镜(德国Leica公司),JEM-1400透射电子显微镜(日本电子公司),Transwell小室(美国Corning公司),Matrigel基质胶(美国BD公司)。
1.2 无外泌体血清制备和HeLa细胞培养将Hyclone胎牛血清100 000 g离心70 min,去除沉淀得到无外泌体胎牛血清。将HeLa细胞用无外泌体的胎牛血清配置的RPMI 1640培养基(含10%胎牛血清)培养。
1.3 HeLa细胞培养上清液中外泌体的收集将对数生长的HeLa细胞用胰蛋白酶消化,用无外泌体的胎牛血清配置的RPMI 1640培养基(含10%胎牛血清)培养48 h,收集HeLa细胞培养上清,500 g离心10 min,再12 000 g离心20 min,取上清液,经0.22 μm孔滤器过滤,过滤后100 000 g离心2 h,用磷酸盐缓冲液(PBS)液重悬沉淀,100 000 g离心2 h,沉淀用PBS液重悬即为HeLa细胞外泌体,保存备用。
1.4 电镜下观察外泌体形态表现将上述获得的沉淀用PBS(含2%多聚甲醛)重悬,吸取适量重悬液滴加到电镜用铜网上,干燥30 min,PBS液清洗,加入1%戊二醛固定5 min,蒸馏水冲洗,用0.4%醋酸双氧铀染色5 min,醋酸双氧铀和甲基纤维素混合物染色并包被10 min,晾10 min,透射电镜下拍照并观察外泌体形态表现。
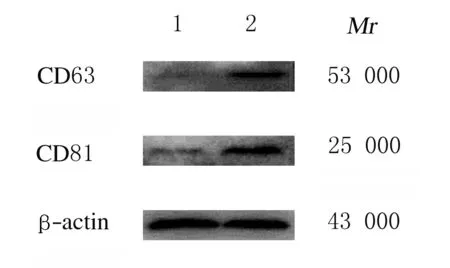
1.5 Western blottig检测外泌体标志蛋白CD63和CD81蛋白表达情况取20 μL重悬的上述外泌体,加入蛋白裂解液10 μL,冰上裂解30 min,12 000 g离心20 min,收集上清液即为外泌体蛋白。取80 μg外泌体蛋白经电泳2 h,半干法转膜,脱脂奶粉封闭1 h,加入相应一抗(兔抗人CD63抗体、兔抗人CD81抗体,稀释比例1∶1 000),过夜孵育,以β-actin为内参。加入二抗孵育1 h,ECL显色,暗室曝光显影,每组设7个复孔,凝胶成像系统获得蛋白条带图片,采用Image J软件分析目标蛋白表达情况。
1.6 HeLa细胞摄取外泌体实验PKH-26为膜标记染料,可与外泌体脂膜结合并发出红色荧光,可用于外泌体存在的鉴定。将1 μL PKH-26染料与100 μL外泌体孵育,加入1 mL Diluent C,加入200 μL 1% BSA/PBS,再加入3 μL PKH-26染料孵育20 min,100 000 g离心70 min,获得标记好的外泌体沉淀。将HeLa细胞置于12孔板中培养,达70%融合时更换为含标记好的外泌体的新鲜培养基孵育24 h,PBS清洗,多聚甲醛固定20 min,DAPI染色细胞核,共聚焦荧光显微镜下观察HeLa细胞摄取外泌体情况。
1.7 Transwell小室实验检测细胞侵袭能力用Matrigal胶包被Transwell小室上室。用无血清培养基饥饿培养HeLa细胞12 h,用胰蛋白酶消化细胞, 1 000 g离心5 min,PBS清洗,用含BSA的无血清培养基重悬HeLa细胞,调整HeLa细胞密度为1 × 105mL-1,取200 μL细胞悬液加入Transwell小室的上室,并设外泌体组(Exo组)和对照组,Exo组细胞中加入20 μL外泌体悬液,对照组细胞中加入20 μL无血清培养基,每组设7个复孔。小室的下室加入去除外泌体的培养基,培养24 h后,棉签擦去基质胶及上室细胞,PBS冲洗,结晶紫染色,显微镜下观察并计算侵袭细胞数,代表细胞迁移能力。
1.8 细胞划痕实验测定细胞迁移能力在12孔板背后用记号笔均匀划3条平行横线,横线横穿过孔,间隔0.8 cm。调整对数生长的HeLa细胞密度为1 × 105mL-1,在12孔板中加入HeLa细胞过夜孵育,24 h后用10 μL枪头垂直背后横线垂直划痕,PBS冲洗去除划下细胞,细胞分为Exo组和对照组,Exo组细胞总加入含外泌体悬液50 μL的无血清培养基,对照组细胞加入等量无血清培养基,置于培养箱中培养,分别于0 h和24 h拍照观察细胞迁移距离,代表细胞迁移能力。每组设7个复孔。
1.9 Western blotting检测细胞中Wnt1、β-catenin和TCF4蛋白表达水平将HeLa细胞分为Exo组和对照组,接种到培养皿中培养至细胞达80%以上融合时,更换培养基,Exo组细胞中加入含50 μL外泌体悬液的培养基,对照组加入50 μL不含外泌体的培养基培养,每组设7个复孔。24 h后提取各组细胞总蛋白,以兔抗人Wnt1、兔抗人β-catenin和兔抗人TCF4抗体为一抗,稀释比例为1∶1 000,采用Western blotting法检测细胞中Wnt1、β-catenin和TCF4蛋白表达水平,具体步骤见“1.6”。目的蛋白表达水平 = 目的蛋白条带灰度值/β-actin条带灰度值。
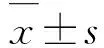
2 结 果
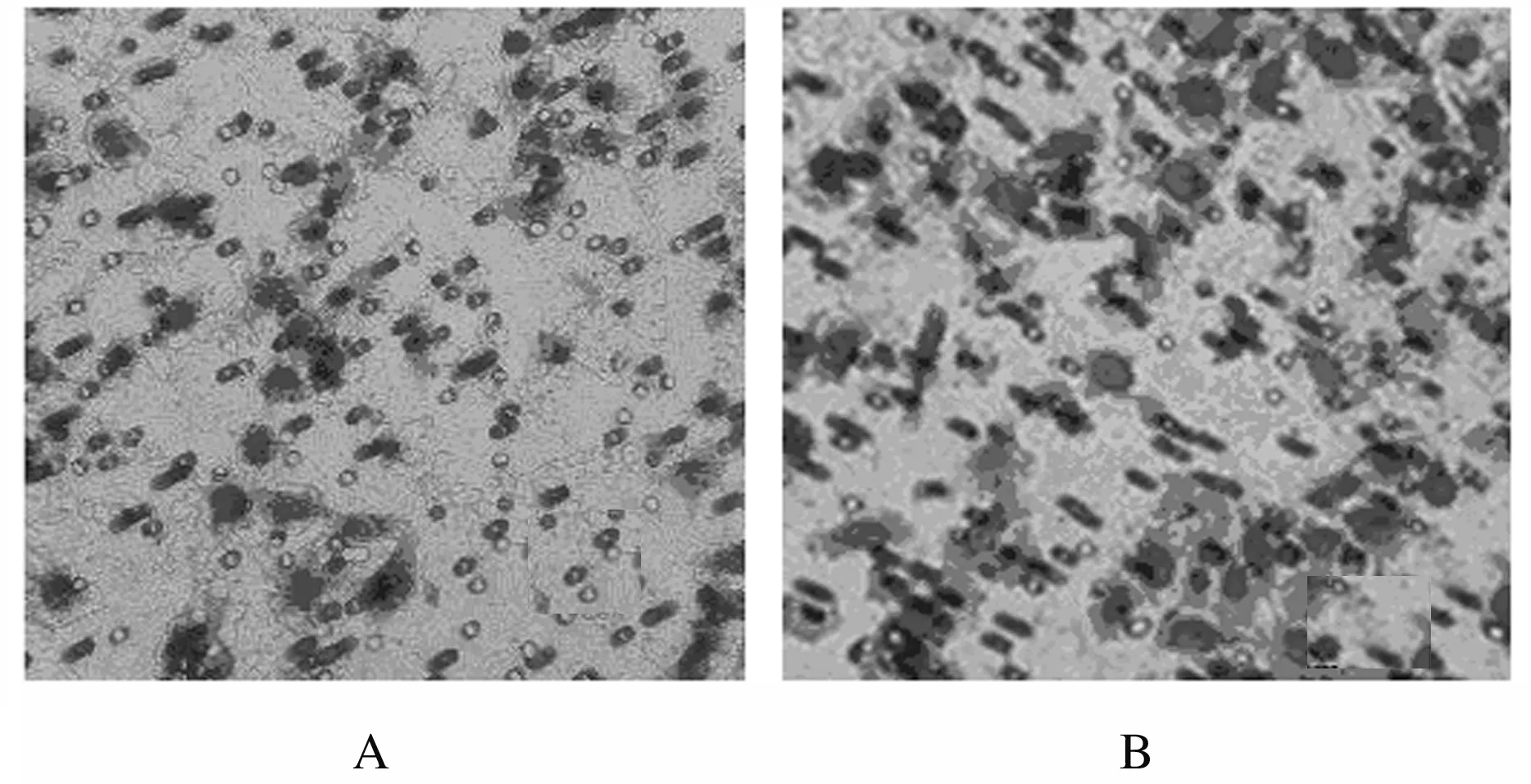
2.1 HeLa细胞来源外泌体鉴定透射电镜下观察:通过超速离心法获得HeLa细胞培养上清中有呈圆形或椭圆形、直径为40 ~ 100 nm的囊泡状小体。Western blotting法检测结果显示:囊泡状小体中富含CD63蛋白和CD81蛋白,表明HeLa细胞中分离的物质为外泌体。见图1和图2。

A: Bar = 100 nm; B: Bar = 25 nm.
2.2 HeLa细胞摄取外泌体情况HeLa细胞外泌体采用PKH26荧光标记(PKH26染剂不影响外泌体特性,且可与外泌体膜结构稳定结合发出红色荧光), HeLa细胞用DAPI荧光进行核染色,培养24 h,共聚焦荧光显微镜观察,对照组HeLa细胞膜表面无标记外泌体附着,Exo组HeLa细胞膜表面有标记的外泌体附着。见图3(插页七)。
Lane 1:Control group;Lane 2:Exo group.
2.3 2组HeLa细胞中侵袭细胞数Transwell小室实验结果显示:与对照组比较, Exo组HeLa细胞中侵袭细胞数明显升高(P<0.01)。见图4和表1。
A:Cotrol group; B:Exo group.
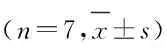
表1 2组HeLa细胞中侵袭细胞数和迁移距离
2.4 2组HeLa细胞迁移距离与对照组比较,Exo组HeLa细胞迁移距离明显增加(P<0.01)。见表1和图5。

A,B:0 h; C,D:24 h;A,C:Control group; B,D:Exo group.
2.5 2组HeLa细胞中Wnt/β-catenin信号通路相关蛋白表达水平与对照组比较,Exo组HeLa细胞中Wnt1、β-catenin和TCF4蛋白表达水平均明显升高(P<0.01)。见表2和图6。
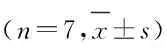
表2 2组HeLa细胞中Wnt1、β-catenin和TCF4蛋白表达水平

Lane 1:Control group;Lane 2:Exo group.
3 讨 论
外泌体是一种细胞外囊泡,直径为50~140 nm,由细胞经过内吞、融合-外排等调控过程形成;外泌体通过携带蛋白质、核酸等生物活性小分子在细胞之间进行信号传递[5]。外泌体可从各种体液、细胞培养液上清中分离,其功能和组成由其细胞来源决定[6]。外泌体在恶性肿瘤微环境中含量非常丰富,在恶性肿瘤的侵袭和转移中发挥重要作用[7]。如肿瘤来源的外泌体增强涎腺腺样囊性癌细胞的侵袭和转移[8],M2巨噬细胞来源的外泌体促进结肠癌细胞迁移和侵袭[9],食管癌细胞来源外泌
体促进食管癌细胞的迁移和侵袭能力[10],胰腺癌外泌体促进肿瘤转移[11]。本研究采用超速离心法成功分离得到宫颈癌HeLa细胞外泌体,并发现HeLa细胞来源外泌体可促进HeLa细胞本身侵袭和迁移能力,表明宫颈癌HeLa细胞外泌体在其自身侵袭和迁移过程中也发挥重要作用,但其作用机制尚不清楚。
为探讨宫颈癌HeLa细胞外泌体在宫颈癌HeLa细胞侵袭和迁移中的作用机制,本文作者对HeLa细胞中Wnt/β-catenin信号通路及其下游基因进行研究,结果显示:宫颈癌HeLa细胞来源外泌体可升高HeLa细胞中Wnt1、β-catenin和TCF4蛋白表达水平。Wnt/β-catenin信号通路在恶性肿瘤细胞的侵袭和迁移中发挥重要作用,宫颈癌的侵袭迁移与Wnt/β-catenin信号通路关系密切[11-12]。β-catenin在细胞中以游离型和结合型两种形式存在,结合型β-catenin通过与上皮钙黏蛋白结合调节恶性肿瘤细胞之间的黏附;游离型β-catenin通过Wnt信号通路作用于恶性肿瘤细胞核内的转录因子淋巴增强因子/T细胞因子(LEF/TCF)在恶性肿瘤的发生发展过程中发挥重要作用[13-14]。Wnt/β-catenin信号通路的激活机制比较复杂,在Wnt蛋白缺失的情况下,细胞中的β-catenin被磷酸化,磷酸化的β-catenin由蛋白酶降解,因此在细胞内保持比较低的水平;在Wnt蛋白存在的条件下,β-catenin磷酸化水平低,导致胞内β-catenin大量积累,随后进入细胞核中,可在细胞核中与LEF/TCF形成复合物,调控相关基因表达,参与恶性肿瘤细胞的侵袭和迁移过程[15-16]。TCF家族为Wnt信号通路的分子开关,在恶性肿瘤的侵袭和转移中发挥重要作用,尤其是TCF4与恶性肿瘤的发生发展有密切关联[17-18]。在宫颈癌中Wnt/β-catenin信号通路激活,Wnt1和β-catenin蛋白表达水平升高,其下游的TCF4蛋白表达水平也升高。外泌体可通过Wnt/β-catenin信号通路发挥生物学作用,如脂肪来源间充质干细胞外泌体通过Wnt /β-catenin信号通路保护心肌免受缺血/再灌注损伤[19];缺氧结直肠癌细胞来源外来体通过Wnt/β-catenin信号传导促进血管生成[20];骨髓间充质干细胞来源外泌体通过Wnt/β-catenin途径促进胃癌进展[21]。本研究中宫颈癌HeLa细胞来源外泌体可升高HeLa细胞中Wnt1、β-catenin和TCF4蛋白表达水平,表明宫颈癌HeLa细胞来源外泌体可能通过促进Wnt/β-catenin 信号通路及其下游的TCF4基因抑制宫颈癌细胞的侵袭和迁移过程。
综上所述,宫颈癌HeLa细胞来源的外泌体可促进宫颈癌细胞的侵袭和迁移能力,其机制可能与HeLa细胞来源外泌体可促进Wnt /β-catenin信号通路的激活及下游TCF4基因的表达有关。

