汕头市妇女HPV-52感染与宫颈鳞状上皮病变的关系
王媛媛,陈依超,郑 洁,彭燕燕,王少洪
(1.汕头市中心医院病理科,广东 汕头515041;2.汕头市中心医院临床医学研究中心,广东 汕头 515041;3.汕头市中心医院检验科,广东 汕头 515041)
据2018年全球癌症数据统计显示,子宫颈癌发病率占恶性肿瘤发病率的6.6%,死亡率居第4位[1]。根据我国国家癌症中心发布的2015年全国癌症数据统计结果显示:恶性肿瘤中子宫颈癌新发病例数居第6位,占比6.04%,死亡率居第8位,占比3.61%[2]。众所周知,持续性的人乳头状瘤病毒(human papillomavirus,HPV)感染是子宫颈癌发生的首要和必要条件,HPV检测及宫颈薄层液基细胞学筛查(thinlayer liquid-based cytology test,LCT)有助于发现早期病变[3-4]。本课题前期研究发现:在汕头市宫颈病变筛查人群中,单一感染及多重感染最常见的亚型是HPV-52[5],但HPV-52感染在该地区的致病特点,目前尚未见文献报道。本研究立足于汕头市人群,分析HPV-52感染在宫颈鳞状上皮病变中的发病风险,拟为研制针对这一特定人群HPV感染疫苗提供理论依据,并为该市HPV-52感染人群提供诊断、治疗及预防的参考依据。
1 材料与方法
1.1 研究对象
回顾性分析汕头市中心医院2015年1月1日—2018年7月31日期间门诊、体检及住院患者同时进行HPV检查及LCT检查者37 700例作为研究对象。研究对象中去除LCT检查不满意标本,同时排除有宫颈鳞状细胞和腺细胞异常4例及188例腺细胞异常标本,只针对子宫颈鳞状细胞学异常进行相关统计。患者为汕头本市人群,按照美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南,对其中3 924例进行了宫颈活检。本研究经过汕头市中心医院伦理委员会批准。
1.2 宫颈HPV及LCT检查
患者同时行宫颈HPV检测及LCT检查。患者于非月经期取样,取样前3 d禁性生活,无阴道用药,无盆浴,充分暴露宫颈,无菌棉球拭净阴道及宫颈口分泌物,取材采用JUNO一次性使用宫颈细胞采样刷(北京世纪众诺医疗器材有限公司),将刷毛紧贴宫颈口,毛刷基底面沿宫颈外口顺指针旋转5圈,取出采样刷放入SafePath妇科细胞保存液(北京世纪众诺医疗器材有限公司)。推动取样刷杆的套装,使刷头落入保存液中,样本贴条形码。
HPV分型检测采用医用核酸分子快速杂交基因分型试剂盒(购自广东凯普生物科技股份有限公司),包含15种高危HPV,即HPV-16、-18、-31、-33、-35、-39、-45、-5l、-52、-53、-56、-58、-59、-66和-68;6种低危型HPV DNA,即HPV-6、-11、-42、-43、-44、CP8304。HPV标本放入装有细胞保存液的样本管中,振荡器上振荡20 s,加入SafePath样本密度分离液,1 080 r/min,离心2 min 15 s,再吸取样本0.5 mL至离心管中,14 000 r/min离心1 min,弃上清,加入400 μL溶液Ⅰ,振荡,在沸水或者干浴锅上加热15 min。再加入400 μL溶液Ⅱ,盖上盖子,振荡数秒,使溶液Ⅱ充分混匀;室温下放置2 min,14 000 r/min离心5 min,去上清。14 000 r/min离心1 min,把剩余的残液吸干净,然后在室温下自然晾干3~5 min后,加入60 μL的溶液Ⅲ溶解DNA,在振荡器上振荡10 s左右。取上清液进行PCR反应。采用上海生工公司合成的HPV通用PCR引物MY(5′-CGTCCMARRGGAWACTGATC-3′,5′-GCMC AGGZGWCATAAYAATGG-3′,其中 R=A+G,W=A+T,Y=C+T,产物长度为452 bp)。PCR扩增体系为PCR混合液23.25 μL,DNA聚合酶0.75 μL,1 μL模板构成,通过博日PCR扩增仪进行。反向点杂交(HHM-2型医用核酸分子快速杂交仪)检测扩增产物与包被有型特异性探针膜杂交结果,采用碱性磷酸酶系统定性检测从而对21种HPV基因型进行分型检测。扩增时将反应管放入PCR扩增仪,按照凯普生物化学有限公司的人乳头状瘤病毒分型检测试剂盒(PCR+膜杂交法)说明书进行扩增。20℃、10 min;95℃、9 min;95 ℃、20 s,55 ℃、30 s,72 ℃、30 s,72℃、5 min,4℃ HOLD进行扩增,40个循环。杂交结果阳性判读为杂交条膜上的Biotin对照显色,同时HPV杂交点也显色。检测结果阳性点为清晰可见的蓝紫色圆点。如果有一个或一个以上HPV分型点为阳性表示该类型HPV检测阳性。结果可为单一或混合HPV感染。
LCT采样同上,离心弃上清液后常温下用PsP50518制片染色一体机(TRiPath公司,美国)制片。细胞学检查结果由两位病理医师按照伯塞斯达系统(the Bethesda system,TBS)分级标准(2014版)分为:未见上皮内病变或恶性病变(negativefor intraepithelial lesion or malignancy,NILM)36 442例(96.66%,36 442/37 700)、非典型鳞状细胞,意义不明确(atypical squamous cells of undetermined significance,ASC-US)714例(1.89%,714/37 700)、低级别鳞状上皮内病变(low-gradesquamousintraepitheliallesion,LSIL)147例(0.39%,147/37 700)、非典型鳞状细胞,不排除高级别鳞状上皮内病变(atypical squamous cells cannot exclude HSIL,ASC-H)151例(0.40%,151/37 700)、高级别鳞状上皮内病变(high grade squamous intraepithelial lesion,HSIL)201例(0.53%,201/37 700)和鳞状细胞癌(squamous cell carcinoma,SCC)45例(0.12%,45/37 700)。
1.3 组织病理学检查
共3 924位患者进行了子宫颈活检,病理诊断按照妇科肿瘤病理诊断标准进行分类,由2位妇科肿瘤专业的病理医师进行阅片。其中诊断为慢性炎症者1 882例、宫颈LSIL者1 326例、宫颈HSIL者510例、SCC者203例、阴道鳞癌1例、鳞癌合并腺癌2例。以病理活检结果作为诊断金标准,其中阴道鳞癌1例及鳞癌合并腺癌2例不纳入本次统计,本文只统计发生在宫颈部位的单一的鳞状细胞病变。
1.4 统计学处理
使用SPSS 19.0软件建立数据库,计数资料率的比较采用频数分布进行统计,构成比和率的比较采用卡方检验,以α=0.05为检验水准。风险评估采用卡方检验2×2列表。
2 结果
2.1 HPV-52感染亚型频数分布及宫颈细胞学ASCUS及以上患者中常见型别
在37 700位患者中HPV-52的感染率为3.55%(1 338/37 700),其中HPV-52单一感染率为65.92%(882/1 338),HPV-52多重(指两种及以上HPV亚型)感染率为34.08%(456/1 338)。HPV-52多重感染456例中包含两重感染313例,三重及以上感染143例,两重感染中排在前3位的亚型依次是HPV-58/52(12.46%,39/313)、HPV-53/52(11.18%,35/313)和 HPV-16/52(11.18%,35/313),见图1和图2。HPV-52多重感染者LCT筛查出ASC-US及以上病变患者中,最多见HPV-16/52型,宫颈细胞学HSIL患者中最多见HPV-16/52型。
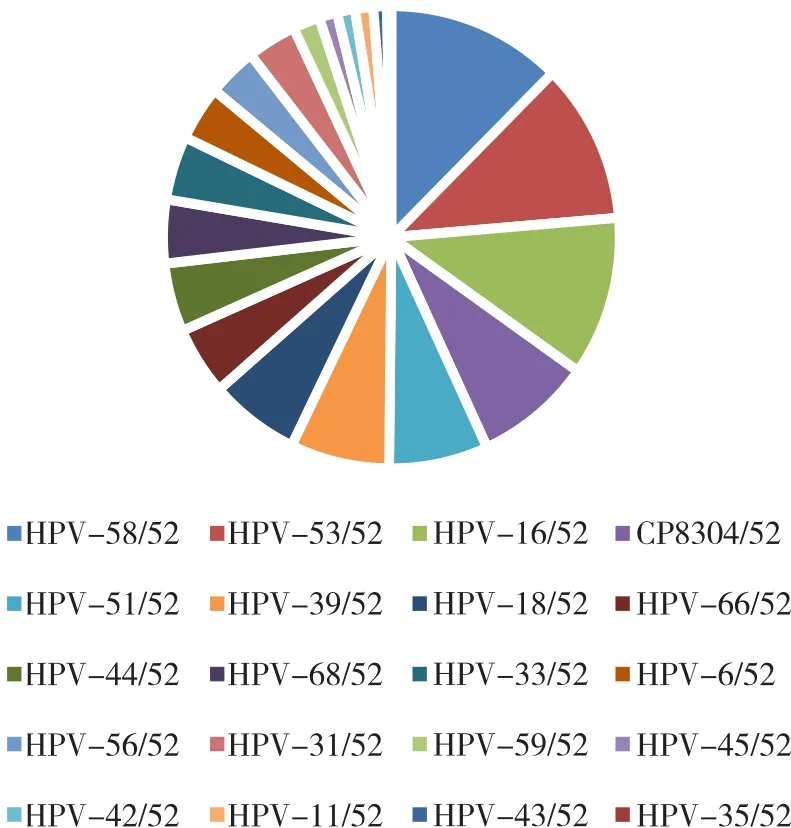
图1 HPV-52两重感染频数分布
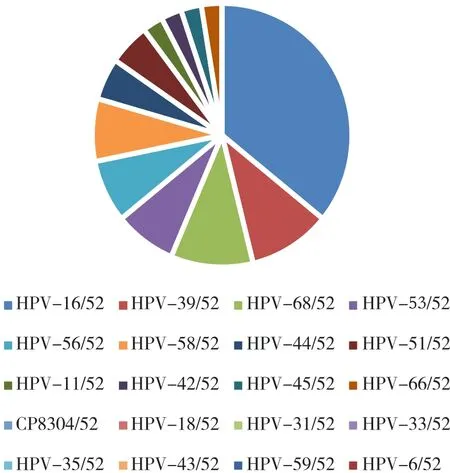
图2 HPV-52两重感染细胞学筛查异常分布
2.2 宫颈组织活检中HPV-52感染特点及风险
宫颈组织活检结果发现:与HPV-52单一感染比较,HPV-52/16多重感染患HSIL或者SCC风险增加(P<0.01,OR=8.27),并且增加从HSIL发展为SCC的风险(P=0.01,OR=12.65),而包含HPV-52但不包含HPV-16的多重感染与HPV-52单一感染比较,患HSIL/SCC风险(P=0.51)和从HSIL发展为SCC的风险(P=0.41)均未明显增加。与包含HPV-52但不包含HPV-16多重感染比较,HPV-52/16多重感染患HSIL/SCC的风险(P<0.01,OR=3.36)和从HSIL发展到SCC的风险(P=0.03,OR=1.29)均显著增加。与HPV-52单一感染比较,HPV-16单一感染患HSIL/SCC的风险(P<0.01,OR=6.93)和从HSIL发展到SCC的风险(P<0.01,OR=41.86)均显著增加,见表1及表2。

表1 HPV-52多重感染发生HSIL/SCC风险分析
3 讨论
HPV是球形DNA病毒,具有嗜上皮性,基因型众多,其中40种可以感染女性生殖道,并且存在地域性及种族差异。中国整体人群感染前5位的亚型分别为16、52、58、53和18[6-7]。HPV-52、-58、-16是韩国和我国华南地区宫颈上皮内病变最常见的感染亚型[8-9]。汕头市与厦门、漳州同属于东南沿海,地理位置邻近,具有相同的感染亚型HPV-58、-16、-18[10-11]。同时汕头又具有本市人群中特有的最常见感染亚型HPV-52。本研究发现HPV-52多重感染常见的亚型分别是HPV-58/52(12.46%,39/313)、HPV-53/52(11.18%,35/313)、HPV-16/52(11.18%,35/313)。从细胞学筛查结果中发现,含有HPV-52的多重感染中,细胞学异常患者,尤其是HSIL患者中最多见的是HPV-16/52感染。宫颈活检结果进一步证实,只要含有HPV-16亚型的感染,无论是与HPV-16单一感染还是包含HPV-52的多重感染,与HPV-52单一感染比较,均增加患HSIL或者SCC风险(P均<0.01),并且增加HSIL癌变风险(P均<0.01)。Bruni等[12]Meta分析显示 HPV-16、HPV-18是全世界最常见的HPV致癌亚型。本研究结果与上述研究结果一致,本地区HPV感染致癌亚型主要是HPV-16。HPV-52单一感染活检结果为慢性炎症或者低度鳞状上皮内病变者248例,诊断为高度鳞状上皮内病变者43例,只有1例诊断为鳞状细胞癌。HPV-52多重感染不含HPV-16的患者活检中为慢性炎症或者鳞状上皮内低度病变者135例,诊断为鳞状上皮内高度病变者29例,无宫颈鳞状细胞癌患者。本研究结果表明无论HPV-52的单一感染与合并不包含HPV-16的多重感染比较主要发生慢性炎症或者LSIL、HSIL病变,并且不增加患HSIL或者SCC风险,也不增加癌变风险。So等[13]的研究结果中也证实HPV-52引起宫颈上皮内瘤变(CINII及CINI)。
总之,本研究发现HPV-52是汕头市HPV感染最常见亚型,该亚型主要引起宫颈LSIL或者HSIL病变,当HPV-52合并HPV-16感染时癌变风险增加,应重视HPV-52合并HPV-16患者的癌变风险防控。

