不同普通野生稻居群的根表铁膜形成能力
唐璐 王晟 但建国

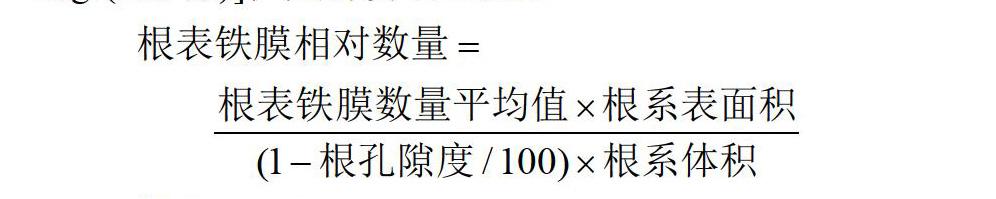
摘 要:為深入了解普通野生稻的根表铁膜形成能力及其与根系特征的关系,本研究对海南省不同地区的8个普通野生稻居群进行了水培铁胁迫试验。结果表明:普通野生稻的根表铁膜随居群而异。HLY、XLB、HQF等3个居群具有较强的根表铁膜形成能力,其根表铁膜相对数量分别为480.58、382.66、364.05 mg Fe/(cm·株)。根表铁膜数量与根生物量、主根表面积、侧根表面积、根系表面积和根系体积均呈正相关;而根表铁膜相对数量与根生物量、根系表面积、侧根表面积及其所占比率呈正相关;但是,根表铁膜含量仅与侧根表面积所占比率呈正相关,根表铁膜厚度与这些根系特征参数均无相关性。根表铁膜的4个指标与根孔隙度之间均无相关性。因此,侧根表面积及其所占比率是影响根表铁膜的重要因子,可作为筛选具有较多根表铁膜的普通野生稻居群的关键依据。
关键词:普通野生稻;铁膜;根系特征中图分类号:S31;S511.9 文献标识码:A
Iron Plaque Formation on Roots from DifferentOryza rufipogon Populations
TANG Lu, WANG Sheng, DAN Jianguo*
Institute of Tropical Agriculture and Forestry, Hainan University, Haikou, Hainan 570228, China
Abstract: In order to determine the effects of root characteristics on iron plaque formation on the roots ofO. rufipogon, eight populations were collected from different areas in Hainan, and investigated with hydroponic experiments. Iron plaque was induced by exposing the roots to a Kimura B nutrient solution supplemented with 0.532 mmol/L FeSO4for 24 h. All the four iron plaque indices showed that iron plaque formation on the roots was significantly different among theO. rufipogon populations. The relative amount of iron plaque for HLY, XLB, and HQF populations was 480.58, 382.66, 364.05 mg Fe/(cm·plant), respectively, which was much higher than those for the others. The amount of iron plaque per plant was positively related to most parameters of the roots, such as root biomass, surface area of adventitious roots, surface area of lateral roots, surface area and volume of root system. The relative amount of iron plaque on the roots had positive correlation with surface area of the lateral roots and its proportion, as well as root biomass and volume of root system. The content of iron plaque on the roots was only positively related to the proportion of surface area of the lateral roots. However, the amount of iron plaque per root surface area was not significantly correlated with the above parameters of the roots. All the four iron plaque indices had no correlation with root porosity. In summary, the major factors influencing iron plaque formation on the roots were surface area of lateral roots and its proportion, which could be used as the pivotal root parameters for confirming the populations ofO. rufipogonwith more iron plaque on roots.
Keywords: Oryza rufipogon; iron plaque; root characteristics
DOI: 10.3969/j.issn.1000-2561.2020.06.027
普通野生稻(Oryza rufipogon Griff.)作为栽培稻的祖先,其资源价值研究越来越被人们重视。普通野生稻由于经受不良环境的选择而拥有丰富的遗传多样性,这也是亚洲栽培稻(Oryza sativaL.)的重要基因源[1-4]。普通野生稻属于多年生水生植物,其根系发达,根生物量与根孔隙度也远大于亚洲栽培稻[5]。水生植物的根系表面因适应淹水和环境胁迫会形成铁氧化物胶膜(简称根表铁膜),它的形成需要根系处于局部氧化状态和富含大量的Fe2+的环境[6-7]。
水稻根系发达的通气组织提高了根系的泌氧能力[8-9],同时根孔隙度也可以用来反映根系通气组织的发育程度即根系的泌氧能力[10]。因此,根系泌氧能力强的植株向根系输送的氧气越多,根表铁膜形成的量越大。根表铁膜通过吸附和共沉淀作用既可以阻止植物根系吸收的As、Se、Al等金属或类金属向地上部分转运[11-13],缓解土壤中Fe2+的毒害作用[14],也可以促进对P、Zn的吸收[15-17],因此,根表铁膜在水生植物治理环境污染或水稻安全生产中起到积极的作用。此外,水稻根系形成的铁膜主要为水合氧化铁[18],该物质能减缓稻田中甲烷的排放[19-22]。普通野生稻的根系较水稻更为发达,而国内外关于普通野生稻根表铁膜的研究非常少,因此,本研究试图从海南省不同地区的野生稻居群中,筛选出根表铁膜形成能力较强的居群,为今后的深入研究提供材料。
1 材料与方法
1.1材料
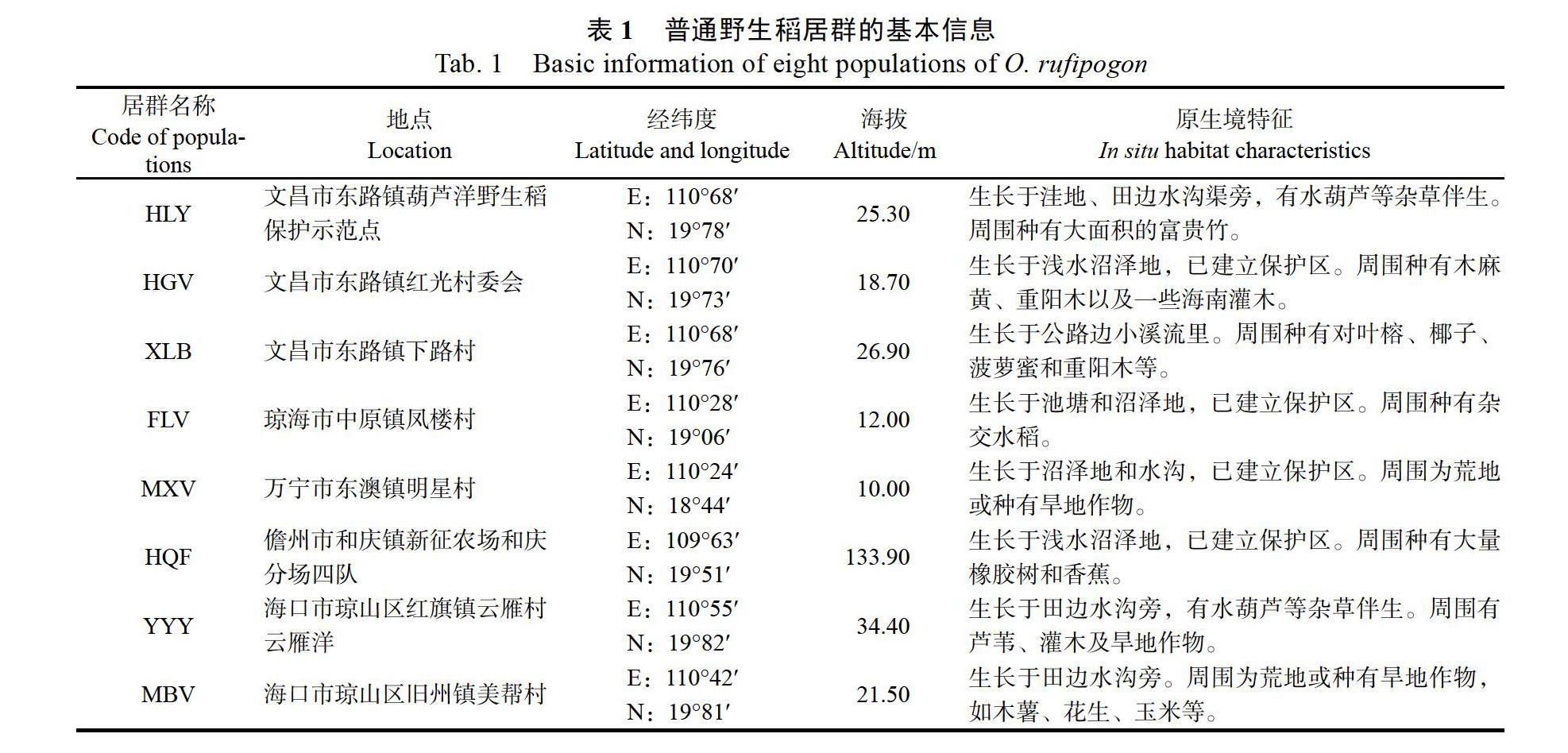
供试材料采自海南省不同地区的8个普通野生稻居群,其基本信息见表1。普通野生稻的主要生境特征和形态特征[23]包括:多年生水生植物,喜光、喜温、喜湿;具强大的须根系和不定根;叶片狭长,披针形;叶舌顶部尖二裂;叶鞘基部紫色、淡紫色或绿色。HGV、FLV、MXV、HQF等居群分别采自海南省的4个普通野生稻保护区[24-25]。其余4个居群(HLY、XLB、YYY、MBV居群)的植株形态特征见图1。
1.2方法
1.2.1 普通野生稻的培养 用木村B营养液培养[26]采集的普通野生稻植株。选取芽龄为10~ 13 d的生根幼苗,从母株剪下后移至黑色塑料圆桶(内径20 cm,高度20 cm)进行水培。将幼苗插入圆形泡沫板小孔中,用海绵固定幼苗上部。每桶盛木村B营养液4 L,每7 d更换一次营养液。每桶种植10株幼苗,每个居群各20株。幼苗水培条件为自然光照和变温。待植株长至一定高度时,需调整植株位置,使其根茎交界处距泡沫板(即水面)4 cm。
1.2.2 铁胁迫试验 胁迫试验持续时间设定为24 h[12]。具体操作方法:从每个居群中挑选出株高相近的植株(株龄43~46 d)进行铁胁迫处理,此时植株均处于分蘖期。同时,将有备选植株的泡沫板移至装有4 L去离子水的塑料桶中,处理12 h。然后用4 L含有高浓度Fe (II)的营养液进行铁胁迫处理[Fe (II)营养液是将木村B营养液中的Na2EDTA-Fe (II) 90 μmol/L替换为FeSO4·7H2O 0.532 mmol/L],即铁胁迫前和铁胁迫处理时的Fe2+浓度分别为5.0 mg/L和29.7 mg/L。所有植株均在自然光照和变温条件下生长。铁胁迫24 h后取出植株,用自来水冲洗根部,再用去离子水冲洗3遍,然后用吸水纸吸干根表水分。每个居群各选取3株,测定生物学性状、根表面积和体积。剪下其余植株的根,置于4 ℃保存,用于测定根孔隙度、根表铁膜及根含水量。所有测定均为3次重复。
1.2.3 生物学性状、根表面积和体积的测定 生物学性状测定包括株高、分蘖数、地上部生物量和根生物量。测定生物量时,将待测植株的地上部和根置于105 ℃杀青30 min,然后在70 ℃烘干3 d至恒重。根表面积和体积的测定采用鲜根直接测量法,测量主根与侧根的长度和根中部的直径,估算主根和侧根的表面积和体积。
1.2.4 根孔隙度的測定 采用比重瓶法测定根孔隙度[27],其步骤与计算方法见黄剑冰等[5]的报道。
1.2.5 根表铁膜的提取、测定和计算 采用DCB (Dithionite-Citrate-Bicarbonate)法提取根表铁膜[13],用原子吸收分光光度计测定铁含量,具体步骤见黄剑冰等[5]和任杰等[22]的报道。根据提取液铁含量、根重和根含水量计算出根表铁膜含量[5, 13, 27-28](以每克干根含多少毫克Fe计,mg/g)。用根表铁膜含量的平均值乘以根生物量即得到根表铁膜数量[5, 29-30](以每株含多少毫克Fe计,mg/株)。用根表铁膜数量的平均值除以根系表面积得到根表铁膜厚度[31](以每平方厘米含多少微克Fe计,μg/cm2)。此外,本研究提出了一个新的指标:根表铁膜相对数量[以每株每厘米含多少毫克Fe计,mg/(cm·株)],其计算公式为:
1.3数据处理
采用Excel 2003进行数据处理和制图。采用SPSS 18.0进行数据分析,利用Duncan法进行多重比较。
2 结果与分析
2.1生物学性状及根孔隙度
由表2可以看出,8个普通野生稻居群在株高、分蘖数和根生物量方面呈明显差异。XLB居群长势最好,株高达118.50 cm,显著大于HLY居群和HQF居群(P<0.05),HQF居群最矮,仅为105.50 cm。FLV居群的分蘖最多,有5个分蘖,但仅与YYY居群(3个分蘖)呈显著差异(P< 0.05)。根生物量以FLV居群最大(466.33 mg),与HGV、HQF、YYY、MBV等4个居群的差异均达到显著水平(P<0.05),MBV居群拥有最小的根生物量(121.33 mg)。各居群的地上部生物量和根孔隙度均无显著差异。地上部生物量介于1.27~2.45 g。根孔隙度的最高均值和最低均值分别出现于HLY居群(39.14%)和HQF居群(33.28%)。
2.2根系表面积与体积
在8个普通野生稻居群中,主根表面积、根系表面积和根系体积均以FLV居群最大,其值分别为457.12、538.07、15.11 cm3/株(表3)。FLV居群的主根表面积与XLB居群无显著差异,但同其他6个居群之间的差异均达显著水平(P<0.05)。根系表面积和根系体积在FLV、XLB、MXV居群之间均无显著差异,而FLV居群的根系表面积和根系体积同其他5个居群之间的差异均达显著水平(P<0.05)。HLY居群和FLV居群的侧根表面积分别为92.16、80.95 cm2/株,均显著大于HGV、YYY、MBV居群;HGV居群的侧根表面积最小,仅为15.60 cm2/株。从侧根表面积占根系表面积的比率来看,HLY居群(31.79%)最高,HQF居群(26.31%)次之,这2个居群的侧根表面积所占比率均显著大于其他居群;HGV居群最低,仅达8.89%。
2.3根表铁膜
根表铁膜的4种评价指标在不同普通野生稻居群之间的差异性见图2。HLY、HGV、HQF居群的根表铁膜含量较高,介于20.24~22.25 mg/g之间,XLB居群次之,但都显著大于其他4个居群(P<0.05);FLV居群的根表铁膜含量最低,仅为7.25 mg/g。根表铁膜数量以XLB居群最高,为6.86 mg/株,与MXV、YYY、MBV居群呈显著差异(P<0.05);而HLY居群的根表铁膜数量也显著大于YYY居群和MBV居群(P<0.05)。不同居群的根表铁膜厚度之间的差异性类似于根表铁膜含量,以HLY、HGV、HQF居群的根表铁膜厚度较高,XLB居群和YYY居群次之,FLV、MXV、MBV居群的根表铁膜厚度显著小于其他居群(P<0.05)。根表铁膜相对数量的最高均值出现在HLY居群[480.58 mg/(cm·株)],与XLB居群和HQF居群无显著差异,但同其他5个居群的差异均达显著水平(P<0.05);MBV居群的根表铁膜相对数量最低,仅为68.17 mg/(cm·株)。
2.4相关性分析
根表铁膜4个指标与普通野生稻根系特征参数的相关分析表明(表4),根表铁膜含量仅与侧根表面积所占比率有显著的正相关性(P<0.05)。根表铁膜数量与根生物量、主根表面积、侧根表面积、根系表面积和根系体积均呈极显著的正相关(P<0.01)。根表铁膜厚度与这些根系特征参数均无相关性。根表铁膜相对数量与根生物量、侧根表面积和侧根表面积所占比率均呈极显著的正相关性(P<0.01),但与根系表面积仅为显著正相关(P<0.05)。
3 讨论
本研究通过水培铁胁迫试验评价了海南省8个普通野生稻居群的根表铁膜形成能力及其与根系特征参数的相关性。通过研究根表铁膜含量、根表铁膜数量、根表铁膜厚度和根表铁膜相对数量等4个指标表明,普通野生稻的根表铁膜形成能力随居群而异,其中HLY居群和HQF居群的根表铁膜形成能力较强;XLB居群次之,因其根表铁膜含量和根表铁膜厚度比HLY居群和HQF居群小。根表铁膜数量与根生物量、主根表面积、侧根表面积、根系表面积和根系体积均呈正相关,而根表铁膜相对数量与根生物量、侧根表面积、根系表面积和侧根表面积所占比率呈正相关性,但是,根表铁膜含量仅與侧根表面积所占比率有显著的正相关性,根表铁膜厚度与这些根系特征参数均无相关性。因此,本研究认为侧根表面积及其所占比率是影响根表铁膜形成能力的重要因子。
根表铁膜含量、根表铁膜数量和根表铁膜厚度是文献中常用的3个指标。虽然根表铁膜数量还分别包含了根生物量和根系表面积的信息,但仍缺少了其他重要根系特征的信息[5]。本研究提出的根表铁膜相对数量包含有4个根系特征的信息,即根生物量、根系表面积、根孔隙度和根系体积,计算公式中的“(1?根孔隙度/100)×根系体积”用来间接表征根系的呼吸耗氧能力,与根表铁膜相对数量呈反比,而根生物量和根系表面积与根表铁膜相对数量呈正比。跟水稻一样,普通野生稻的根系由不定根和各级侧根组成。小侧根没有通气组织和泌氧屏障,但拥有更大的根表面积,是根系泌氧的重要场所[5, 32-33]。因此,侧根表面积在根表铁膜的形成中起重要的作用[34]。在本研究中,普通野生稻的根表铁膜数量和根表铁膜相对数量均与侧根表面积呈极显著的正相关,根表铁膜相对数量还与侧根表面积所占比率呈极显著的正相关性,由此可见,与根表铁膜数量相比,根表铁膜相对数量能更好地反映出侧根对根表铁膜的贡献。
普通野生稻常年生长于水生环境中,其根系的通气组织比水稻更发达[35-36],但普通野生稻根表铁膜的4个指标与根孔隙度之间均无相关性,这是由于这8个居群的根孔隙度均较高(33.28%~ 39.14%),居群之间无显著差异。Wu等[28]曾报道,水稻的根孔隙度与根表铁膜含量呈正相关,但与根表铁膜厚度无相关性。
本研究结果是在水培条件下获得的。淹水土壤中的生物地球化学因子和根际微生物对水稻等水生植物不定根和侧根的产生[37-38]、泌氧、根表铁膜的形成[18]均有较大的影响,因此,采用原生境土壤培养的方式对不同普通野生稻居群的根表铁膜作进一步研究是十分必要的。此外,根的通气组织和泌氧屏障具有空间异质性,对根系泌氧和根表铁膜的空间分布也有影响[39],需用数学模型对此进行表征和分析[40-41]。在今后的研究中,可從这一角度来探讨普通野生稻根系的解剖学特征与根表铁膜之间的关系。
致谢 感谢海南大学何美丹博士在普通野生稻采集中提供帮助。
参考文献
[1] 董玉琛. 作物野生种质资源及其利用[C/OL]// 第一届全国野生稻大会, 2003: 13-18. [2019-02-10] http://www. wanfangdata.com. cn/details/detail.do?_type=confe?rence&id= 6892958
[2] 庞汉华. 普通野生稻优异种质资源主要特点与利用展望[J]. 种子, 1998(3): 31-32.
[3] 王效宁, 韩东飞, 云 勇, 等. 利用SSR标记分析海南普通野生稻的遗传多样性[J]. 植物遗传资源学报, 2007(2): 184-188.
[4] 刘 迪, 孟卫东. 海南野生稻的遗传多样性及其保护与利用[J]. 杂交水稻, 2010, 25(S1): 525-527.
[5] 黄剑冰, 任 杰, 唐 璐, 等. 栽培稻和普通野生稻居群根表铁膜形成能力的比较研究[J]. 热带作物学报, 2017, 38(3): 421-425.
[6] 刘侯俊, 张俊伶, 韩晓日, 等. 根表铁膜对元素吸收的效应及其影响因素[J]. 土壤, 2009, 41(3): 335-343.
[7] Jiang F Y, Chen X, Luo A C. Iron plaque formation on wetland plants and its influence on phosphorus, calcium and metal uptake[J]. Aquatic Ecology, 2009, 43(4): 879-890.
[8] 杨旭健, 傅友强, 沈 宏, 等. 水稻根表铁膜及其形成的形态、生理及分子机理综述术[J]. 生态学杂志, 2014, 33(8): 2235-2244.
[9] 刘依依, 傅志强, 龙文飞, 等. 水稻根系泌氧能力与根系通气组织大小相关性的研究[J]. 农业现代化研究, 2015, 36(6): 1105-1111.
[10] 李奕林. 水稻根系通气组织与根系泌氧及根际硝化作用的关系[J]. 生态学报, 2012, 32(7): 2066-2074.
[11] Liu W J, Zhu Y G, Smith F A,et al. Do phosphorus nutrition and iron plaque alter arsenate (As) uptake by rice seedlings in hydroponic culture?[J]. New Phytologist, 2004, 162(2): 481-488.
[12] Zhou X B, Shi W M, Zhang L H. Iron plaque outside roots affects selenite uptake by rice seedlings (Oryza sativa L.) grown in solution culture[J]. Plant and Soil, 2007, 290(1/2): 17-28.
[13] Chen R F, Shen R F, Gu P,et al. Response of rice (Oryza sativa) with root surface iron plaque under aluminium stress[J]. Annals of Botany, 2006, 98(2): 389-395.
[14] Mi W J, Cai J B, Tuo Y,et al. Distinguishable root plaque on root surface ofPotamogeton crispus grown in two sediments with different nutrient status[J]. Limnology, 2013, 14(1): 1-11.
[15] Liang Y, Zhu Y G, Xia Y ,et al. Iron plaque enhances phosphorus uptake by rice (Oryza sativa) growing under varying phosphorus and iron concentrations[J]. Annals of Applied Biology, 2006, 149(3): 305-312.
[16] Xu D F, Xu J M, He Y,et al. Effect of iron plaque formation on phosphorus accumulation and availability in the rhizosphere of wetland plants[J]. Water, Air, and Soil Pollution, 2009, 200(1-4): 79-87.
[17] 刘文菊, 尹 君, 毕淑芹, 等. 根表铁膜对水稻吸收污灌土壤中的锌的影响[J]. 土壤与环境, 2001(4): 270-272.
[18] Khan N, Seshadri B, Bolan N,et al. Root iron plaque on wetland plants as a dynamic pool of nutrients and contaminants[J]. Advances in Agronomy, 2016, 138: 1-96.
[19] Hori T, Müller A, Igarashi Y,et al. Identification of ironreducing microorganisms in anoxic rice paddy soil by13C- acetate probing[J]. The ISME Journal, 2010, 4(2): 267-278.
[20] Huang B, Yu K, Gambrell R P. Effects of ferric iron reduction and regeneration on nitrous oxide and methane emissions in a rice soil[J]. Chemosphere, 2009, 74(4): 481-486.
[21] Liu S W, Zhang L, Liu Q H,et al. Fe(III) fertilization mitigating net global warming potential and greenhouse gas intensity in paddy rice-wheat rotation systems in China[J]. Environmental Pollution, 2012, 164: 73-80.
[22] 任 杰, 唐 璐, 陳菊培, 等. 水合氧化铁提前施用对持续淹水条件下水稻甲烷的减排效应[J]. 热带作物学报, 2018, 39(4): 635-640.
[23] 范树国, 张再君, 刘 林, 等. 中国野生稻的种类、地理分布及其特征特性综述[J]. 武汉植物学研究, 2000(5): 417-425.
[24] 王晓玲, 郭安平, 孔 华, 等. 海南主要普通野生稻的调查及利用RAPD技术进行鉴别分析[J]. 广西植物, 2008(6): 741-745, 749.
[25] 徐中亮, 李厚奇, 何美丹, 等. 海南普通野生稻居群植被物种多样性研究[J]. 中国农学通报, 2012, 28(29): 203-207.
[26] Ma J, Takahashi E. Effect of silicon on the growth and phosphorus uptake of rice[J]. Plant and Soil, 1990, 126(1): 115-119.
[27] Mei X Q, Ye Z H, Wong M H. The relationship of root porosity and radial oxygen loss on arsenic tolerance and uptake in rice grains and straw[J]. Environmental Pollution, 2009, 157(8-9): 2550-2557.
[28] Wu C, Ye Z H, Li H,et al. Do radial oxygen loss and external aeration affect iron plaque formation and arsenic accumulation and speciation in rice?[J]. Journal of Experimental Botany, 2012, 63(8): 2961-2970.
[29] Lee C H, Hsieh Y C, Lin Z H,et al. Iron plaque formation and its effect on arsenic uptake by different genotypes of paddy rice[J]. Plant and Soil, 2013, 363(1/2): 231-241.
[30] 傅友強, 杨旭健, 吴道铭, 等. 磷素对水稻根表红棕色铁膜的影响及营养效应[J]. 中国农业科学, 2014, 47(6): 1072-1085.
[31] Holzschuh M J, Carlos F S, Carmona F D C,et al. Iron oxidation on the surface of adventitious roots and its relation to aerenchyma formation in rice genotypes[J]. Revista Brasileira de Ciência do Solo, 2014, 38(1): 185-192.
[32] Rebouillat J, Dievart A, Verdeil J L,et al. Molecular genetics of rice root development[J]. Rice, 2009, 2(1): 15-34.
[33] Kirk G J D, Greenway H, Atwell B J,et al. Adaptation of rice to flooded soils[M]// Progress in Botany. Springer Berlin Heidelberg, 2014, 75: 215-253.
[34] 蔡妙珍, 罗安程, 章永松, 等. 水稻根表铁膜对磷的富集作用及其与水稻磷吸收的关系[J]. 中国水稻科学, 2003(2): 94-97.
[35] 高立志, 张寿洲, 周 毅, 等. 中国野生稻的现状调查[J]. 生物多样性, 1996(3): 38-44.
[36] Colmer T D. Long-distance transport of gases in plants: a perspective on internal aeration and radial oxygen loss from roots[J]. Plant Cell and Environment, 2003, 26(1): 17-36.
[37] Gonin M, Bergougnoux V, Nguyen T D,et al. What makes adventitious roots?[J]. Plants, 2019, 8(7): 240.
[38] Muller B, Guédon Y, Passot S,et al. Lateral roots: random diversity in adversity[J]. Trends in Plant Science, 2019, 24(9): 810-825.
[39] Yamauchi T, Abe F, Tsutsumi N,et al. Root cortex provides a venue for gas-space formation and is essential for plant adaptation to waterlogging[J]. Frontiers in Plant Science, 2019, 10: 259.
[40] Beckett P M, Armstrong W, Armstrong J. Mathematical modelling of methane transport by phragmites: the potential for diffusion within the roots and rhizosphere[J]. Aquatic Botany, 2001, 69(2/4): 293-312.
[41] Armstrong W, Armstrong J. Plant internal oxygen transport (diffusion and convection) and measuring and modelling oxygen gradients[M] //van Dongen J T, F Licausi F. Low-oxygen stress in plants. Oxygen sensing and adaptive responses to hypoxia. Berlin: Springer Vienna, 2014: 267-297.

