绵马酚抑制多粘菌素耐药关键蛋白MCR-1 的机制研究
贾 月,华 欣,刘思国
(1. 吉林农业大学 动物科学技术学院, 吉林 长春 130118;2. 中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069;3. 东北林业大学 生命科学学院,黑龙江 哈尔滨 150040)
近10 年来,随着临床上抗生素使用频率的逐年增加,不断出现新的细菌抗性机制,导致各种耐药细菌相继出现,对人畜健康造成巨大损害。多粘菌素(Polymyxin B)是阳离子多肽类抗生素,带正电荷的多粘菌素与带负电荷的类脂A结合,增加细胞膜的通透性,破坏革兰氏阴性菌的细胞膜结构,被认为是人类抵抗革兰氏阴性菌感染的“最后一道防线”[1]。然而,一些细菌对多粘菌素逐渐产生耐药性,研究证实由质粒介导的多粘菌素耐药基因mcr-1 可在不同地区、不同种属之间通过接合型质粒相互传播[2]。MCR-1 蛋白的氨基酸序列与磷酸乙醇胺转移酶家族高度相似,具有磷酸乙醇胺转移酶活性,作用于类脂A 的pNetN 部分;磷酸乙醇胺由R1 基团和R2 基团组成,在MCR-1 的催化下,R1 基团的酰基键断裂转移至类脂A 的4 号位或1 号位上形成类脂A 复合物,降低了类脂A与多粘菌素的亲和力[3-4]。因此,要延长多粘菌素作为临床上治疗革兰氏阴性菌感染的使用期限,研发高效的MCR-1 抑制剂是最可行的方法。
绵马酚(Aspidinol)是鳞毛蕨科植物的主要活性成分,在香鳞毛蕨中较为常见。香鳞毛蕨的主要活性成分为酚类化合物,其中间苯三酚类化合物最为常见,具有抗炎症、抗菌、抗病毒等活性,对于治疗真菌性疾病有良好的效果。绵马酚为单环间苯三酚类化合物,化学式为C12H16O4[5-7]。现在对于绵马酚的研究还很少,但由于间苯三酚类化合物具有的多种生理活性,国际上对绵马酚的研究仍然十分关注。
本研究发现绵马酚可以抑制MCR-1 蛋白活性,通过联合药敏试验、杀菌效果测定、透射电镜观察菌体形态、质谱检测类脂A 的结构及Biacore 大分子互作验证绵马酚与MCR-1 蛋白结合情况等实验确定了绵马酚具有抑制MCR-1 蛋白的抗多粘菌素的耐药特性,从而为开发更多的MCR-1 蛋白抑制剂提供了相关实验依据。
1 材料与方法
1.1 主要实验材料质粒小提试剂盒、胶回收试剂盒均购自BioFlux 公司,ExTaq、DL2000 DNA Marker、DL10000 DNA Marker、DL15000 DNA Marker购自TaKaRa 公司,BamH Ⅰ、XhoⅠ、T4 连接酶购自Thermo 公司; 24 株mcr-1 阳性大肠杆菌,即JD01、JD02、 JD03、 JD04、 JD05、 JD06、 JD07、 JD08、JD09、JD010、JD11、JD012、ZD01、ZD02、ZD03、ZD04、ZD05、ZD06、ZD07、ZD08、ZD09、ZD10、ZD11 及ZD12,其中JD01~JD12 来源于黑龙江省某鸡场,ZD01~ZD12 来源于黑龙江省某猪场,均由本实验室于2016 年分离并保存;参考株ATCC25922 为本实验室保存;pET-28a 载体、DH5α和BL21 感受态细胞均购自TaKaRa 公司;多粘菌素B、卡那霉素购自Sigma-Aldrich,纯度均为98%;绵马酚为本实验室提取,纯度为98%;LB 琼脂培养基(LB Agar)、LB 肉汤培养基(LB Broth)购自美国BD医疗器械有限公司。
1.2 主要仪器Biacore 大分子互作仪购自美国GE公司,型号为Biacore T200;质谱仪购自SCIEX 公司,型号为TripleTOF 6600。
1.3 联合药敏试验采用棋盘微量稀释法[8]测定绵马酚(10 240 μg/mL)和多粘菌素(10 240 μg/mL)的最小抑菌浓度(MIC),然后依据CLSI 公布测定不同药物组合对分离菌的抑制作用的标准方法,在96 孔板中加入100 μL 稀释后的药物,使多粘菌素的浓度由上到下依次降低2 倍,绵马酚的浓度由左到右依次降低2 倍,随后分别加入24 株mcr-1 阳性大肠杆菌分离株菌液100 μL(终浓度为5×105cfu/mL),37 ℃培养14 h~16 h,得出多粘菌素与绵马酚联合使用时各自的MIC,并根据绵马酚及多粘菌素的MIC 值得到其FIC 指数[9],FIC=(联合时甲药的MIC/甲药的MIC)+(联合时乙药的MIC/乙药的MIC),当FIC<0.5为协同作用,即两种药物联合后的药效大于同样浓度的两种药物抗菌作用的总和;0.5
1.4 绵马酚联合多粘菌素使用时对mcr-1 阳性大肠杆菌的杀菌效果的检测根据1.3 结果进一步验证绵马酚联合多粘菌素的杀菌效果,在2 mL 的LB 液体培养基中复苏mcr-1 阳性大肠杆菌JD08,37 ℃培养1 h,随后向JD08菌株中分别加入终浓度为10 μg/mL的多黏菌素、终浓度为32 μg/mL 的绵马酚和终浓度为10 μg/mL 的多黏菌素+32 μg/mL 的绵马酚联合作用各1管,置于37 ℃培养,分别于1 h、2 h、4 h、6 h、8 h、10 h 和12 h 各取100 μL 菌液加到LB 固体琼脂培养基上,倒置37 ℃过夜培养,次日进行细菌计数。根据活菌数绘制时间-活菌数曲线,同时以正常培养的JD08 菌株为阴性对照,验证绵马酚联合多粘菌素使用时对mcr-1 阳性大肠杆菌的杀菌效果。
1.5 透射电镜观察mcr-1 阳性大肠杆菌菌体形态根据1.3及1.4实验结果,由于经过验证绵马酚单独使用对mcr-1 阳性大肠杆菌无效,因此选取联合作用试验组进一步试验。将mcr-1 阳性大肠杆菌JD08 菌液培养至OD650nm0.6 时分成三份,每份2 mL,取出2 份分别转接入含10 μg/mL 多粘菌素的LB 液体培养基中及含10 μg/mL 的多粘菌素+32 μg/mL 的绵马酚的LB 液体培养基中,另外一份作为阳性对照。将3 份菌液37 ℃培养4 h 后送哈尔滨兽医研究所电镜室进行透射电镜观察。
1.6 绵马酚对MCR-1 蛋白的活性鉴定MCR-1 是一种磷酸乙醇胺转移酶,在磷酸乙醇胺存在的情况下,MCR-1 催化磷酸乙醇胺的酰基键断裂,生成类脂A 复合物和甘油二酯。通过体外模拟MCR-1 催化磷酸乙醇胺反应,可检测绵马酚对MCR-1 的蛋白活性。本试验采用氯仿/甲醇/水混合相萃取法[10]分别提取mcr-1 阳性大肠杆菌JD08 菌株和含有16 μg/mL 的绵马酚的mcr-1 阳性大肠杆菌JD08 菌株中类脂A,利用质谱仪检测类脂A 的结构。
1.7 重组载体pET-28a-mcr-1 的表达与纯化根据GenBank登录的mcr-1基因序列(KP347127.1),使用primer premier 5.0 设计特异性引物:F-5'-ATGGATC CAGTGCGCCAAAAGATACCATTT-3'/R-5'-GATCTCGA GTCAGCGGATGAATGCGGT-3', 以JD08 菌 液 为 模板,PCR 扩增mcr-1 基因,预计片段大小为987 bp。PCR 扩增程序:95 ℃5 min、94 ℃30 s、56 ℃30 s、72 ℃1 min 40 s,30 个循环,72 ℃7 min。PCR 扩 增产物经1%琼脂糖凝胶电泳检测回收纯化后,与pEF-28a 载体均用BamHⅠ/XhoⅠ双酶切后连接,连接产物转入DH5α 感受态细胞,经PCR 鉴定及酶切鉴定后提取质粒由吉林省库美生物科技有限公司测序。 将验证正确的重组质粒转入BL21 感受态细胞,经终浓度为1 mmol/L IPTG 诱导表达后离心和超声破碎,上清经镍柱亲和层析纯化,收集洗脱液进行SDS-PAGE 电泳,观察蛋白的表达,然后超滤浓缩即为重组蛋白MCR-1,采用BCA 蛋白定量试剂盒测定蛋白浓度后-20 ℃保存备用。
1.8 MCR-1 蛋白与绵马酚的Biacore 分子互作检测使用pH 4.0 的醋酸钠溶液将MCR-1 蛋白偶联至CM5 芯片,将CM5 芯片装进仪器后用不同浓度(1.56 μmol/L、3.125 μmol/L、6.25 μmol/L、12.5 μmol/L、25 μmol/L、50 μmol/L)的绵马酚溶液置于质谱仪中,按照操作程序进行检测,试验结束后拟合MCR-1 蛋白与绵马酚之间的结合情况。
2 结 果
2.1 联合药敏试验结果选取24 株mcr-1 阳性大肠杆菌菌株进行药敏试验,经过联合用药和单独用药试验,结果显示,单独使用绵马酚时,mcr-1 阳性大肠杆菌对绵马酚均耐药;单独使用多粘菌素时,其MIC 值大多数为8 μg/mL(13 株),少数为4 μg/mL(7 株)和16 μg/mL(4 株);绵马酚与多粘菌素联合作用时,多粘菌素的MIC 值均降低至1 μg/mL(14 株)或2 μg/mL(10 株)。本实验中联合使用多粘菌素及绵马酚的MIC 值比单独使用多粘菌素时有着明显的下降,其FIC 指数为0.07(2 株)、0.133(11 株)和0.258(7 株),均小于0.5,属于协同作用,仅有4 株mcr-1 阳性大肠杆菌的FIC 指数为0.508,为相加作用(表1)。表明绵马酚与多粘菌素联合使用时对mcr-1 阳性大肠杆菌产生了协同效果,抑菌效果明显高于单独使用多粘菌素或绵马酚时的抑菌效果。同时,结果发现大多数mcr-1 阳性大肠杆菌的MIC值为8 μg/mL, JD08 菌株最具代表性,因此选取JD08 菌株进行后续实验。
2.2 绵马酚联合多粘菌素使用时对mcr-1 阳性大肠杆菌的杀菌效果的检测结果向JD08 菌株中加入终浓度为10 μg/mL(10 倍MIC)的多黏菌素、终浓度为32 μg/mL(4 倍MIC)的绵马酚和终浓度为10 μg/mL 的多黏菌素+终浓度为32 μg/mL 的绵马酚联合作用,活菌数计数结果显示,单独使用32 μg/mL 绵马酚对于mcr-1 阳性的大肠杆菌JD08 无杀菌效果,其活菌量与正常培养的JD08 菌株相似;10 μg/mL 的多黏菌素对JD08 菌株几乎无杀菌效果;32 μg/mL 的绵马酚联合10 μg/mL 的多黏菌素使用时对JD08 菌株有较好的杀菌效果,在8 h 时细菌基本死亡,未检测到活菌(图1)。表明联合使用绵马酚和多粘菌素对mcr-1阳性大肠杆菌有良好的杀菌效果。
2.3 透射电镜观察mcr-1阳性大肠杆菌菌体形态结果通过电镜观察正常培养的JD08菌株、10 μg/mL多粘菌素作用的JD08 菌株及10 μg/mL 多粘菌素+32 μg/mL绵马酚的作用的JD08菌株,结果显示mcr-1阳性大肠杆菌JD08 菌体形态较好,外膜完整,仅有轻微形变,可能是制作切片过程中的损伤(图2A);10 μg/mL的多粘菌素作用的JD08菌体内容物少量流失,电子密度降低(图2B);10 μg/mL的多粘菌素及32 μg/mL的绵马酚共同作用的JD08菌体形变明显,内容物流失严重,多数菌体只剩外膜结构,同时观察到较多蛋白类物质,疑似菌体内容物(图2C)。表明联合使用绵马酚和多粘菌素对mcr-1 阳性大肠杆菌菌体的外膜产生了较大损伤,绵马酚加剧了多粘菌素对mcr-1 阳性大肠杆菌的损伤程度,这些损伤可造成细菌死亡。
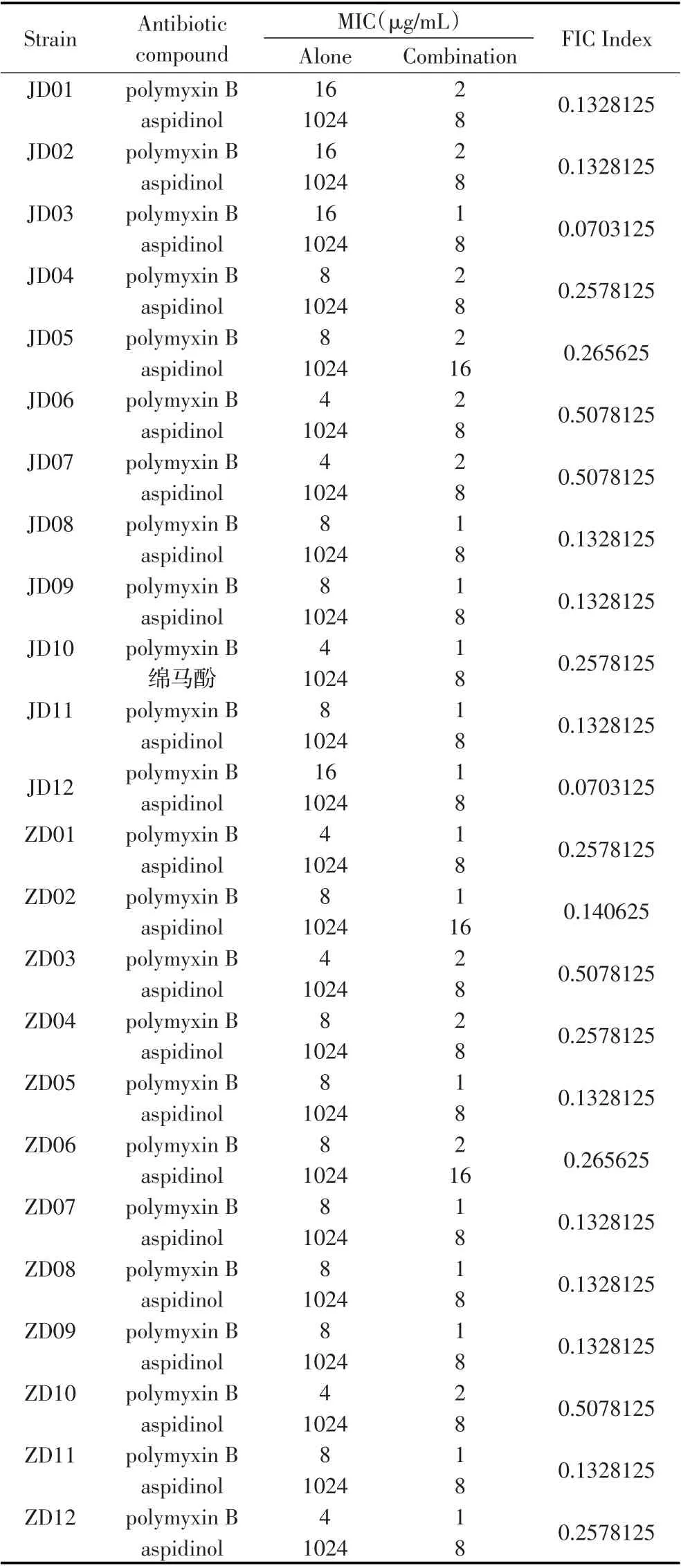
表1 不同来源的mcr-1 阳性大肠杆菌的多粘菌素与绵马酚联合药敏实验Table 1 MIC values of the polymyxin B and aspidinol combination therapy for different sources of mcr-1 positive E.coli
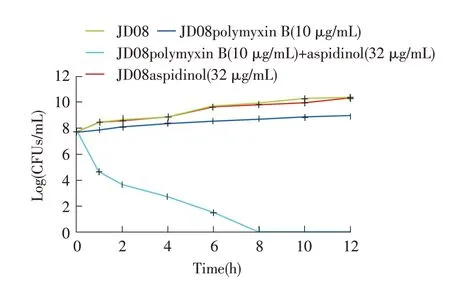
图1 绵马酚联合多粘菌素对mcr-1 阳性大肠杆菌的杀菌曲线Fig.1 Time-killing curves of polymyxin B combined aspidinol against mcr-1 positive E.coli
2.4 绵马酚对MCR-1蛋白的活性检测结果采用氯仿/甲醇/水混合相萃取法提取类脂A,如图3A 所示,在mcr-1 阳性大肠杆菌JD08 中分离出的类脂大小为1 920.3 U,相比于未经修饰的正常的类脂A(1 797.1 U)增加了大约123 U。而如图3B 所示,在绵马酚存在的情况下,MCR-1蛋白的作用受到抑制,发生转移的酰基键含量大大减少。MCR-1蛋白具有磷酸乙醇胺转移酶的作用,与使用绵马酚处理的JD08菌株中未修饰的类脂A的比例相比,未使用绵马酚处理的JD08菌株中经过修饰的类脂A的比例发生了显著改变。表明绵马酚影响了MCR-1蛋白发挥催化活性,使类脂A形成了类脂A 复合物,而绵马酚有抑制MCR-1 蛋白的作用,使形成的类脂A复合物大量减少。

图2 透射电镜观察mcr-1 阳性大肠杆菌JD08 形态Fig.2 The morphology of mcr-1 positive E.coli JD08 under transmission electron microscope

图3 质谱检测JD08 菌株中类脂A 的变化情况Fig.3 Detection of Lipid A in JD08 strain by Mass spectrometry
2.5 MCR-1 蛋白的表达与纯化结果将经过双酶切验证及测序正确的pET-28a-mcr-1 重组载体经IPTG 诱导后表达MCR-1 蛋白,上清通过镍树脂纯化后进行SDS-PAGE 检测,结果显示在38 ku 处有目的蛋白表达,与预期一致,表明正确构建了pET-28a-mcr-1 重组载体(图4),并且MCR-1 蛋白在上清表达。对表达上清纯化后经CA 定量试剂盒测得蛋白质浓度为11.17 mg/mL(图5)。
2.6 MCR-1 蛋白与绵马酚的Biacore 分子互作检测通过不同浓度的绵马酚与偶联至CM5 芯片上的MCR-1 蛋白相互作用,检测MCR-1 蛋白与绵马酚的亲和力,Biacore 分析结果显示,绵马酚与MCR-1 蛋白相互作用响应值随绵马酚浓度增高不断增强,根据拟合结果分析显示,MCR-1蛋白与其小分子抑制剂的亲和力常数为1.47 μmol/L(图6)。表明两者之间存在直接结合,绵马酚属于MCR-1蛋白的小分子抑制剂。
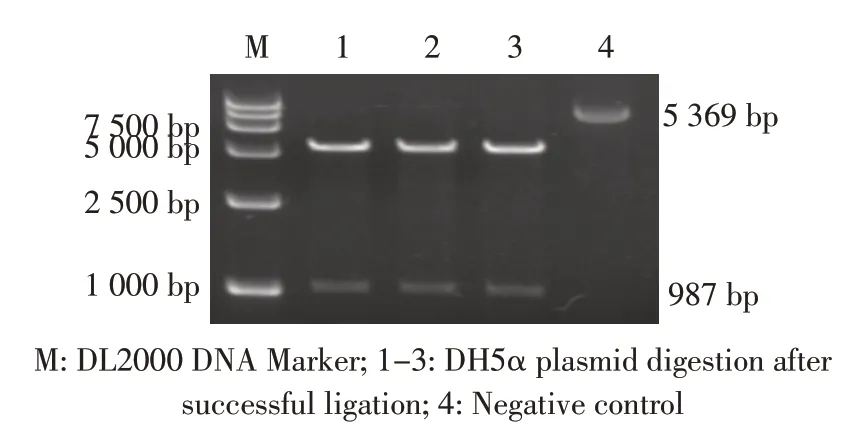
图4 重组载体pET-28a-mcr-1 酶切验证结果Fig.4 The digestion rusult of recombinant vector pET-28a-mcr-1

图5 重组蛋白MCR-1 的SDS-PAGE 检测Fig.5 Detection of purified MCR-1 recombinant protein by SDS-PAGE

图6 Biacore 测定绵马酚与MCR-1 蛋白之间相互作用力Fig.6 The interaction between Mianmatol and MCR-1 protein by Biacore
3 讨 论
mcr-1 是2015 年首次被报道的由质粒介导的多粘菌素耐药基因[1],自发现以来已在30 多个国家检出,这表明mcr-1 基因已在全球范围内存在,在我国已有25 个省/自治区分离到了携带有mcr-1 基因的细菌[11]。同时,在动物源性食品和医院感染病人样品中也分离出了携带有mcr-1 基因的细菌。氨基酸序列分析结果显示MCR-1 蛋白与已报道的磷酸乙醇胺转移酶家族约有60%的相似性,即MCR-1 蛋白可能具有磷酸乙醇胺转移酶活性[1]。Zhou 等研究了紫檀芪和多粘菌素对mcr-1 阳性大肠杆菌产生了协同效果,其MIC 值由8 μg/mL 降低到1 μg/mL[11]。Lan 等通过虚拟筛选确定了1-苯基-2-(苯胺基)乙酮属于MCR-1 抑制剂,并对此设计了1-苯基-2-(苯胺基)乙酮的衍生物。通过分子对接发现其中两种衍生物6p和6q 可以通过氢键与Glu246和Thr285相互作用,并占据MCR-1 蛋白的空腔[12]。Zhou 等证实蛇床子素可恢复多粘菌素对mcr-1 阳性肠杆菌的抑菌活性[13]。
本实验基于对mcr-1 基因的基础研究上筛选和鉴定了MCR-1 蛋白的小分子抑制剂-绵马酚,通过联合药敏实验验证了绵马酚与多粘菌素联合可显著增强对mcr-1 阳性大肠杆菌的抑菌效果,其MIC 值由8 μg/mL 或16 μg/mL 降 低 到1 μg/mL 或2 μg/mL,杀菌实验和透射电镜观察均表明单独使用多粘菌素或绵马酚均无法完全杀灭细菌,但联合使用时具有显著的杀菌效果。进一步证明绵马酚能够增加多粘菌素的杀菌效果,而多粘菌素是作用在类脂A 上发挥作用,MCR-1 为磷酸乙醇胺转移酶,同样作用于类脂A 上,从质谱检测结果发现经过绵马酚处理的未经修饰的类脂A 含量相比经过修饰的类脂A 含量多。Biacore 大分子互作结果也可以看出绵马酚于MCR-1 蛋白属于直接结合,因此绵马酚很大可能是MCR-1 的小分子抑制剂。推测可能是由于绵马酚能够与MCR-1 蛋白的催化区域中的某个位点发生结合,使MCR-1 蛋白失活,无法生成类脂A 复合物,恢复了多粘菌素的功效,破坏革兰氏阴性菌的外膜结构,造成细菌死亡。Stojanoski[14]、Hinchliffe[15]、Wei[16]、Xu[17]和Ma[18]等人通过实验发现了E246A、T285A、K333A、H395A、H466A、H478A 等突变体恢复了多粘菌素对mcr-1 阳性菌的敏感性,本研究团队将会针对以上涉及到的几种重要的突变位点进行中重点研究,以明确多粘菌素耐药关键蛋白MCR-1 的小分子抑制剂的作用机制,为开发MCR-1 抑制剂提供帮助。

