胃癌患者微小RNA-150表达水平与术前新辅助化疗效果的关系
王珏 徐晓燕 孙岩岩 韩震 李卉
胃癌是一种常见的消化系统恶性肿瘤,发病较为隐匿,发病率和死亡率均较高。虽然根治性手术是治疗胃癌的一种有效方法,但仍存在局部复发和远处转移的风险。因此,寻找一种相对安全的治疗方法以减缓胃癌的进展尤为重要[1]。有关文献指出,新辅助化疗已广泛应用于消化系统恶性肿瘤的治疗,可有效提高患者术后的生存率[2-3]。多种分子在胃癌耐药性的发展中起着调节作用,其中微小RNA(miRNA)起重要作用。miRNA是一类内源性小分子单链非编码RNA,其是参与调节基因的转录过程,使靶基因的表达受到抑制,从而发挥调节作用[4]。miRNA可参与组织器官的发育和形成过程,与疾病的发展密切相关,与细胞增殖、分化和凋亡有关[5]。miR-150是近期发现的一种miRNA,对恶性肿瘤起重要调节作用[6]。本研究选择于我院接受胃癌根治性手术的90例患者作为对象,旨在探讨其外周血miR-150表达与胃癌术前新辅助化疗效果的关系。
对象与方法
1.对象:2016年1月~2018年5月于我院拟实施胃癌根治性手术的90例患者。胃癌的诊断标准参考2015年美国国家综合癌症网络(NCCN)胃癌临床实践指南。纳入标准:(1)在我院由同一组医护人员实施手术操作;(2)为首诊患者且化疗前均通过胃镜取活组织病理检查证实;(3)愿意接受3个周期的术前新辅助化疗。排除标准:(1)胃肠道穿孔、梗阻、腹腔内广泛感染;(2)伴有其他部位恶性肿瘤或已发生远处转移;(3)伴有严重的心脑血管疾病、血友病、血管性血友病、维生素K缺乏等;(5)伴有其他类型禁忌证,如上消化道大出血、梗阻等。90例胃癌患者中男47例,女43例,年龄38~75岁,平均年龄(56.3±10.6)岁。本研究通过我院医学伦理委员审核批准[院(2015)74号],所有患者均知情同意。
2.方法
(1)患者一般资料和临床资料收集:收集所有患者的一般资料(性别、年龄)和临床资料[国际抗癌联盟及美国肿瘤联合会胃癌肿瘤淋巴结转移(TNM)分期、淋巴结转移情况、病灶直径及肿瘤分化程度]。根据TNM分期系统(第8版)[7]对所有患者进行TNM分期,所有患者均于术前1周内行超声造影检查测量肿瘤直径,根据胃癌诊疗规范(2018年版)[8]中的肿瘤分化程度标准判断所有患者的肿瘤分化程度。
(2)术前化疗方案:所有患者于第1~14日每日2次餐后服用替吉奥(80mg/m2);于第1日将奥沙利铂(130 mg/m2)溶于500 ml 5%葡萄糖溶液中持续2 h静脉滴注。以21天为1个周期,连续治疗3个周期[9]。
(3)疗效评价标准:参照WHO实体瘤疗效评价标准分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。有效=CR+PR,无效=SD+PD。根据疗效将90例胃癌患者分为有效组(64例)和无效组(26例),两组患者的年龄、性别比较差异均无统计学意义(P>0.05)。见表1。
(4)实时荧光定量聚合酶链反应(real-time PCR)检测miR-150表达水平:取患者空腹静脉血,加入适量体积的红细胞裂解液,在室温下混匀放置10 min,以10 000 r/min离心1 min,丢弃上清,将沉淀的白细胞加入1 ml TRIzol中裂解5 min,于4 ℃下以12 000 r/min离心10 min,取其上清,离心、干燥,再加入40 μl无RNA酶的水,用枪反复吹打混匀,使其完全溶解,获得总RNA溶液。逆转录参数:取5 μl RNA模板,加入上下游引物、逆转录酶,总体积10 μl,于37 ℃水浴60 min后,将其逆转录为cDNA。根据逆转录试剂盒(北京全式金生物科技有限公司)说明书操作。以U6snRNA为内参照基因,加入上下游引物、SYBR Green、Taq聚合酶进行real-time PCR,循环参数:95 ℃变性5 min;然后95 ℃、60 ℃20 s,72 ℃ 20 s,78 ℃ 20 s,共40个循环,检测其荧光信号,以2-△△Ct表示miR-150的相对水平。

结 果
1.有效组与无效组患者的临床资料比较:所有患者中,Ⅰ期19例,Ⅱ期38例,Ⅲ期26例,Ⅳ期7例;淋巴结转移者41例;高分化22例,中分化32例,低分化32例,未分化4例;肿瘤直径≥3.0 cm 33例,<3.0 cm 31例。两组患者的TNM分期、淋巴结转移情况、肿瘤分化程度比较差异均有统计学意义(P<0.05);两组患者的年龄、性别、病灶直径比较差异均无统计学意义(P>0.05)。见表1。
2.有效组和无效组患者外周血miR-150表达水平比较:有效组患者外周血miR-150表达水平明显高于无效组(0.504±0.113比0.227±0.086),差异有统计学意义(t=11.233,P<0.001)。见图1。
3.胃癌患者术前新辅助化疗效果影响因素的logistic回归分析:结果显示,TNM分期增高、分化程度降低、发生淋巴结转移是胃癌患者术前新辅助化疗效果不佳的独立危险因素(P<0.05)。外周血miR-150表达水平升高是胃癌患者术前新辅助化疗效果不佳的独立保护因素(P<0.05)。见表2。
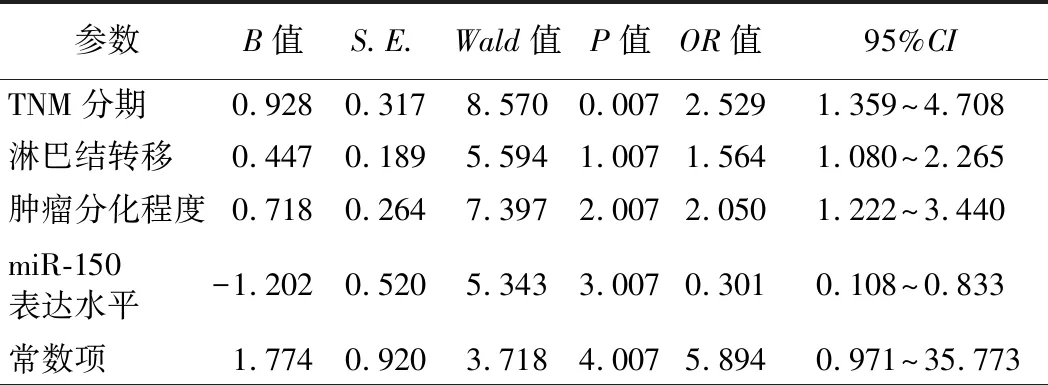
表2 胃癌患者术前新辅助化疗效果的多因素分析结果
讨 论
胃癌早期临床症状不明显,大多患者发病时已经处于晚期,采取单一的根治疗法难以达到较好的治疗效果。除了与淋巴结清扫和手术切除是否完全相关外,肿瘤转移和复发还与微转移病变的存在及其进一步的增殖和生长有关;理论上化疗时期越早,产生的耐药细胞越少[10],因此术前新辅助化疗能有效控制胃癌的转移和复发。动物实验表明,在小鼠肿瘤切除后机体会分泌某些促进肿瘤细胞增殖的物质,如生长刺激因子等,这些因子可加速转移性病变的生长,并诱导癌细胞产生耐药性[11]。术前新辅助化疗可降低肿瘤分期,减少肿瘤细胞数量,抑制增殖刺激因子的出现,并消除潜在的微转移。术前新辅助化疗方案是晚期胃癌患者综合治疗的主要方法[12]。
以5-氟尿嘧啶为主的化疗药物可提高患者生存率,但会引起强烈的不良反应,预后较差。奥沙利铂是第三代铂类化疗药物,可发生烷基化,生成的结合物可抑制DNA合成,从而发挥抗细胞毒性和抗肿瘤作用[13-14]。替吉奥属于5-氟尿嘧啶衍生物,是一种口服抗癌剂,抗癌机制与5-氟尿嘧啶基本相同。5-氟尿嘧啶产生水衍生物,然后作用于DNA以抑制其复制和合成,进而发挥抗细胞和肿瘤毒性作用[15]。此外,5-氟尿嘧啶毒性较小,水溶性较高,不会损伤患者的消化道,也不会产生交叉耐药,对肾脏无不良反应,可配合奥沙利铂治疗恶性肿瘤[16]。
miR-150是RNA家族中的单链小分子,长度约为22个核苷酸,可直接参与肺癌、乳腺癌、脑肿瘤、肝癌和淋巴瘤等多种肿瘤的发展[17]。miR-150在肿瘤细胞中的表达特征为肿瘤组织中低表达和癌旁组织中高表达,这种差异表达与肿瘤的发生、发展密切相关,从而揭示了miR-150对肿瘤抑制作用的机制是通过调控特定靶基因的表达来调节肿瘤的发展[18]。
本研究结果显示,有效组患者外周血miR-150水平明显高于无效组,表明miR-150表达缺失的原因可能是肿瘤对化疗药物耐药,但具体机制应通过进一步的体外和体内实验来证实。有效组与化疗无效组患者的年龄、性别、病灶直径比较差异均无统计学意义,但两组患者TNM分期、淋巴结转移和肿瘤分化程度比较差异显著,表明术前新辅助化疗的效果仅与患者的临床分期、是否有淋巴结转移及肿瘤分化程度有关,与患者的年龄、性别和病灶的大小无关。胃癌患者术前新辅助化疗效果影响因素的logistic回归分析结果显示,TNM分期增高、分化程度降低、发生淋巴结转移是其术前新辅助化疗效果不佳的独立危险因素,而外周血miR-150表达水平升高是胃癌患者术前新辅助化疗效果不佳的保护因素。
综上所述,胃癌患者外周血miR-150表达水平下调可能与患者术前新辅助化疗效果不佳有关,临床上可通过检测外周血miR-150表达水平来预测胃癌患者的术前新辅助化疗效果。

